矩形瓣在Kasai手术治疗Ⅲ型胆道闭锁近中期预后的回顾性研究
梁 挺, 王 意, 王群群, 孙聚珊, 李万富
(1新疆医科大学第一附属医院小儿外科, 乌鲁木齐 830054; 2锦州医科大学研究生院, 锦州 121000)
胆道闭锁(Biliary atresia,BA)是一种在儿童中由于纤维炎性组织堵塞肝内、外胆管最终导致肝衰竭的疾病。它是胆汁淤积症的最常见病因,并且是在全世界范围内小儿科学中进行肝移植的最常见指征,在儿童进行肝移植中占40%~50%[1]。胆道闭锁是新生儿中进展最快的胆道疾病,在就诊时肝外胆管可能已经完全闭锁。如果不进行治疗,进行性肝纤维化将会导致肝硬化、门脉高压、肝衰竭,最终导致在2岁左右死亡[2]。葛西教授率先创立肝门空肠吻合术(Hepatic Portoenterostomy,HPE,即Kasai手术)用以治疗Ⅲ型BA。肝门-空肠吻合术(Kasai 手术)是治疗BA最主要的手术方式,成功的Kasai手术可以延长患儿的自体肝生存时间,然而术后易发生胆管炎,导致患儿肝功能恶化,从而影响患儿的预后[3]。胆管炎反复发作严重影响 Kasai 手术效果,防治胆管炎对改善 BA 患儿预后、延长自体肝生存时间具有重要的临床意义[4]。张金哲[5]曾设计出矩形瓣来预防肝肠吻合术后胆管炎的发生率从而改善患儿预后、延长自体肝生存时间。但是有研究发现抗反流瓣和延长胆管支长度并不能预防胆管炎的发生[6-7],但其研究并没有比较生存率之间的差异。本研究着重对近中期(2~3 a)肝功能总胆红素(TBil)、谷丙转氨酶(ALT)恢复情况及生存率对比分析,来探究矩形瓣在Kasai手术治疗III型胆道闭锁中对近中期预后的影响。
1 资料与方法
1.1临床资料2013年 1月-2017年1月本研究共随访63例Ⅲ型胆道闭锁患儿。所有的病例经查体、术前腹部B超、术中探查、胆道造影确诊为Ⅲ型胆道闭锁。 手术由同一名经验丰富的主任医师完成,采用经典的Kasai术式(RF-组,n=33)和经典的Kasai术+矩形瓣成形术(RF+组,n=30)。
63例患儿中,RF-组33例,RF+组30例,2组患儿的年龄及性别比、平均住院时间、术中出血量、进食时间及手术时间均无统计学意义(表1)。

表1 2组患儿术前情况比较
注:“*”表示术前ALT与TBil结果不符合正态分布,因此选用中位数及四分位间距表示。
1.2随访方法及观察指标患儿术后1年每6个月随访1次,随访观测指标包括:体格检查、腹部B超及肝功能生化检查。由专人为每名患儿做随访记录,并建立相应数据库。
1.3手术方法
1.3.1 RF-组手术方法 取右肋缘下斜切口,开腹后先做肝门部解剖,经胆囊置管造影,证实为III型胆道闭锁,自胆囊床分离胆囊,结扎胆囊动脉,继续游离至胆囊颈后切开肝十二指肠韧带表面的被膜,游离闭锁的胆总管远端并进行结扎,近端沿入肝方向游离至门静脉左右分支的前方,在肝被膜表面将纤维块同肿大的淋巴结一并切除,注意此操作在放大镜下进行。术中对剪除创面给予压迫止血。于距离屈氏韧带25 cm处离断空肠,缝合关闭盲端,经结肠后上拉至肝门,用5-0可吸收缝线间断缝合空肠与肝门部纤维结缔组织断面,近端肠管开口距离肝肠吻合口45 cm处行端侧吻合,关闭横结肠系膜裂孔及空肠系膜裂孔,然后逐层关腹。
1.3.2 RF+组手术方法 在行经典kasai手术的基础上再行矩形瓣成形术:在胆道支靠近吻合口处5 cm的肠管肠系膜对缘切开浆肌层浅层,捏紧肠壁,用刀柄沿浆肌层切口划开肌层直至暴露出粘膜层,逐渐分离切开的浆肌层。沿准备并拢缝合的半周肠壁将浆肌层从粘膜层外全部剥开直至肠系腹缘。距系膜2 mm 处切下剥开的浆肌层,盐水纱布压迫止血。将剥掉浆肌层的胆道支肠管与相邻的胃十二指肠支并拢缝台,使其形成一5 cm长的矩形瓣。
1.4术后处理术后使用广谱三代头孢抗生素静脉滴注2 w;术后3~5 d静脉滴注强的松龙,剂量为20 mg/d,每3 天递减5 mg,直至5 mg/d,改为口服强的松龙5 mg/kg/d连用3个月;术后7 d开始口服熊去氧胆酸,每日15 mg/kg,服用1 a。
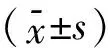
2 结果
2.12组患儿术后肝功能情况比较选取术后ALT和TBil作为评估肝功能的指标,经过验证均不符合正态分布,故采取中位数及四分位间距表示。分别以12、18、24、30、36个月作为观察时间,通过用 Wilcoxon秩和检验发现,RF+组与RF-组术后肝功能差异均无统计学意义(表2)。

表2 2组患儿术后近中期肝功能生化情况比较[M(QU-QL)]
2.2两组患儿近中期生存率比较Kaplan-Meier 生存分析(图1)显示:Kasai术后RF-组和RF+组的自体肝生存率,12个月生存率分别为72.7%和73.3%,18个月生存率分别为66.7%和73.3% ,24个月生存率分别为60.6%和63.3%,30个月生存率分别为57.6%和60.0%,36个月生存率分别为48.5%和46.7%。 经COX回归模型分析,不同手术方式对近中期自体肝生存率无影响(P>0.05)。

图1 2组患儿近中期生存函数
3 讨论
Tanaka等[8]和Bowles等[9]通过对行矩形瓣和其他抗反流阀的胆道闭锁患儿术后进行钡剂造影的临床研究发现钡剂并没有反流至肝门部,因此说明矩形瓣、肠套叠瓣和其他抗反流阀可以阻挡肠内容物反流至胆管支。理论上,如果肠管内的内容物被抗反流阀阻挡进入胆管支,就会降低Kasai术后胆管炎的发生率,从而使肝功能得到恢复,并且避免进一步恶化。但Sartorelli等[6]通过回顾性研究发现抗反流阀对预防胆道闭锁患儿Kasai术后胆管炎发生作用不大。Chuang等[7]也发现设置抗反流瓣和延长胆管支长度对术后胆管炎的发生率没有影响。这表明术后胆管炎的发生以及术后肝功能的恶化可能与其他因素有关而与肠内容物的返流关系不大,例如:(1)肠黏膜屏障的损伤和萎缩。(2)机体免疫功能下降。(3)肠道菌群失调,引起肠道菌群过度增殖。 Chuang等[7]研究表明肠道微生物也迁移可能也是导致患儿术后早期胆管炎的关键因素之一。
自体肝的生存率是胆道闭锁患儿Kasai手术最重要的评价指标,欧美主要地区1、2 a和5 a自体肝生存率分别为53.7%、46.7%和46%[10-11],我国多中心协作组研究显示2年自体肝生存率为56.1%[12]。本组病例1、2 a自体肝生存率分别为73%和61.5%。结合患儿手术年龄因素与术后肝功能恢复情况以及自体肝生存率的关系,提示应积极在患儿年龄≤90 d时进行Kasai手术能获取更大程度的肝功能恢复,从而有利于患儿的长期自体肝生存。
Kasai手术作为胆道闭锁的标准治疗方案发展至今,关于其手术方式的选择还存在很大争议[13]。本研究过程中尽量排除了一些干扰因素,例如:胆肠吻合的术式、外科的技术操作、术后的药物治疗(糖皮质激素、利胆药和抗生素)。本研究Kasai术后近中期生化水平的评估选用ALT和TBil两项作为观察指标,最终发现RF+组与RF-组的生存率以及近中期肝功能恢复情况没有明显的差异。可见Kasai手术中行矩形瓣抗反流阀在近中期生化恢复及生存率上较传统Kasai手术并无明显优势。
[1] 王意,李万福,梁挺.胆道闭锁的病因新进展[J].新疆医学,2017,47(1):84-88.
[2] BEZERRA J A, SPINO C, MAGEE J C,et al. Use of corticosteroids after hepatoportoenterostomy for bile drainage in infants with biliary atresia : the START randomized clinical trial[J]. JAMA,2014,311( 17): 1750-1759.
[3] 陈亚军,李万福,张廷冲,等.胆道闭锁Kasai手术的精准处理[J].中华实用儿科临床杂志,2013,28(11):832-834.
[4] ZHAN J H, CHEN Y J. How to evaluate diagnosis and management of biliary atresia in the era of liver transplantation[J]. Chin J Pediatr Surg,2014,35( 4):245-247.
[5] 张金哲.介绍矩形瓣手术[J].临床小儿外科杂志,2017,16(2):105-108.
[6] SARTORELLI K H, HOLLAND R M, ALLSHOUSE M J, et al. The intussusception antireflux valve is ineffective in preventing cholangitis in biliary atresia[J]. J Pediatr Surg,1996,31(3):403-406.
[7] CHUANG J H, LEE S Y, SHIEH C S, et al. Reappraisal of the role of the bilioenteric conduit in the pathogenesis of postoperative cholangitis[J]. Pediatr Surg Int,2000,16(1-2):29-34.
[8] TANAKA K, SHIRAHASE I, UTSUNOMIYA H, et al. A valved hepatic portoduodenal intestinal conduit for biliary atresia[J]. Ann Surg,1991,213(3):230-235.
[9] BOWLES B J, ABDUL-GHANI A, ZHANG J. Fifteen years’ experience with an antirefluxing biliary drainage valve[J]. J Pediatr Surg,1999,34(11):1711-1714.
[10] SUPERINA R, MAGEE J C, BRANDT M L, et al. The anatomic pattern of biliary atresia indentified at time of Kasai hepatoportoenterostomy and early postoperative clearance of jaundice are significant predictors of transplant-free survival[J].Ann Surg,2011,254(4):577-585.
[11] DAVENPORT M, ONG E, SHARIF K, et al. Biliary atresia in England and Wales:results of centralization and new benchmark [J].J Pediatr Surg,2011,46(9):1689-1694.
[12] 宋再,钟微,余家康,等.胆道闭锁多中心综合诊断治疗方案研究[J].中华小儿外科杂志,2011,32(2):81-85.
[13] SUNDARAM S S, MACK C L, FEDDLDMAN A G, et al. Biliary atresia:Indications and timing of liver transplantation and optimization of pre-transplant care [J]. Liver Transpl,2017,23(1):96-109.

