蛹虫草固态发酵豆渣的功能性成分与抗氧化活性
,, ,,,, ,
(南京农业大学食品科技学院,江苏南京 210095)
豆渣是在制作豆油、豆浆、豆腐等产品过程中产生的主要副产品。我国每年的豆渣产量巨大,大部分用来作为饲料。每100 g干豆渣含有大约42.4~58.2 g碳水化合物,15.2~33.4 g蛋白质,8.3~10.9 g脂肪[1]。由于豆渣含有丰富的营养,同时豆渣本身含有70%~80%的水分,使得豆渣适合微生物生长。近年来,越来越多的研究者利用微生物发酵豆渣,生产有功能活性的物质和食品[2-5]。伍时彬等用米曲霉固态发酵豆渣制曲,并添加纤维素酶,提取物具有较高的抗氧化活性[2]。江成英等利用多菌种固态发酵豆渣,生产富含β-胡萝卜素、膳食纤维等功能性成分的发酵食品[3]。Li等用羊肚菌发酵豆渣,发酵后豆渣粉中总酚含量由5.99 mg/g提高至7.70 mg/g[6]。
蛹虫草(Cordycepsmilitaris)为子囊菌门,肉座目,虫草菌科、虫草属真菌。蛹虫草与冬虫夏草两者的化学成分、营养成分和药用功能非常相似。蛹虫草的主要活性成分之一是虫草素,虫草素具有抑菌、抗病毒等生物活性,表现出免疫调节、抗肿瘤、抗衰老等药理功能[6]。研究表明,基质经蛹虫草固态发酵,能提高发酵基质的功能活性。朱振元等用蛹虫草固态发酵大米,提高了大米的营养价值与抗氧化能力[7]。彭志妮等[8]用蛹虫草固态发酵大豆,增加大豆抗氧化活性物质,提高了发酵大豆的抗氧化能力。
微生物发酵豆渣会产生一些新的功能性成分,但将发酵豆渣作为功能性食品,对其进行高值化利用的研究较少,发酵豆渣还未被充分开发利用。蛹虫草具有多种功能活性物质,在日常保健方面有广阔的应用前景,有关利用虫草发酵豆渣的研究,目前尚未见报道。本研究以蛹虫草CM-1为发酵菌株,固态发酵豆渣,以期在降低成本同时获得较高的附加值。研究发酵前后豆渣中虫草素、总酚、多糖等功能性成分及抗氧化活性变化,对这些指标进行相关性分析和主成分分析,为利用发酵豆渣开发成功能性食品或配料提供理论参考。
1 材料与方法
1.1 材料与仪器
蛹虫草CM-1(CordycepsmilitarisCM-1) 由南京农业大学食品微生物实验室保存,分离自江苏省睢宁县的蛹虫草,经形态学与分子生物学鉴定,确定该菌株为蛹虫草;马铃薯葡萄糖琼脂(Potato Dextrose Agar,PDA)培养基(g/L) 土豆200、葡萄糖20、琼脂20,pH自然;大豆 燕之坊东北小黄豆;2,2′-联氮-二-3-乙基-苯并噻唑-6-磺酸二铵盐(2,2′-Azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)、1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl radical 2,2-Diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH)、2,4,6-三(2′-吡啶基)-1,3,5-三嗪(2,3,5-Triphenyltetrazolium chloride,TPTZ)、甲醇 美国Sigma Aldrich公司;虫草素标准品 上海源叶生物有限公司;葡萄糖、琼脂粉、铁氰化钾、三氯乙酸、氯化铁、醋酸钠、醋酸、过硫酸钾、碳酸钠、没食子酸 均为分析纯,南京寿德试剂有限公司。
LHS-150SC恒温恒湿箱 上海苏净实业有限公司;岛津AUY-120分析天平 上海恒一科技有限公司;TDL-5-A离心机 上海安亭科学仪器厂;Waters 2695高效液相色谱仪(PAD检测器Waters 2996) 日本Waters公司;HetoPowerDry LL3000真空冷冻干燥机 美国Thermo公司;Kjeltec TM2300全自动凯氏定氮仪 丹麦福斯 Foss公司;索式脂肪抽提装置 上海华瑞仪器有限公司;SX2-4-13数显控温马弗炉 上海苏净实业有限公司;酶标仪 美国Bio-Tek公司;722型分光光度计 上海菁华科技仪器有限公司。
1.2 实验方法
1.2.1 菌种活化 将蛹虫草CM-1从斜面培养基接种到PDA固体培养基平板,倒置在22 ℃培养箱培养7 d,活化2次,使用前放于4 ℃冰箱保存。
1.2.2 豆渣制备 称取大豆1000 g,加入3000 mL水,在室温下浸泡12 h。以1∶7豆水比进行磨浆,制得水分含量约82%的新鲜豆渣。
1.2.3 发酵豆渣制备 取培养7 d蛹虫草CM-1的PDA平板,用生理盐水(0.85% NaCl)洗下菌丝和孢子,置于装有无菌水和玻璃珠的锥形瓶。将孢子打散后用四层纱布过滤,得到孢子悬浮液,用血球计数板对孢子镜检计数,调节孢子数约为107~108个/mL。孢子悬浮液接种量为10%(v/m),接种至灭菌的豆渣,置于22 ℃培养箱,避光发酵7 d。发酵样品用冻干机-20 ℃冷冻干燥48 h,打粉,过80目筛。
1.2.4 豆渣水溶性提取物的制备 分别取未发酵豆渣、发酵豆渣的冻干样品1 g,加入30 mL蒸馏水,50 ℃水浴锅提取4 h,8000×g离心10 min,提取2次。控制旋转蒸发仪水浴温度为50 ℃,转速为108 r/min,将60 mL提取液减压浓缩至15 mL,冻干。冻干提取物用去离子水溶解,配成浓度为0.25、0.5、1、2、4、6、8、10、12 mg/mL的溶液。
1.3 检测方法
1.3.1 多糖含量测定 采用文献[9]的方法测定提取物中多糖含量,稍作修改。用Sevage法沉淀提取液中的蛋白质,加入4倍体积的无水乙醇,4 ℃沉淀。离心,得到沉淀,用无水乙醇清洗2次,冻干,得到粗多糖。
用硫酸苯酚法测定粗多糖中总糖含量。将葡萄糖分别配成浓度为0、0.02、0.04、0.06、0.08、0.1 mg/mL。1 mL标准液分别加入现配的5%苯酚溶液1 mL,浓硫酸5 mL,摇匀,30 ℃放置30 min,于490 nm处测定吸光值。以葡萄糖含量为横坐标,吸光值为纵坐标,制作标准曲线,得到其线性回归方程。
吸取1.0 mL样品液,按照上述步骤测定吸光值,并代入标准曲线y=8.1071x+0.0638(R2=0.9982),计算反应体系中的葡萄糖浓度(mg/mL)。总糖含量(μg/mg)=葡萄糖浓度/1000×稀释倍数×提取液体积/提取物质量。
用3,5-二硝基水杨酸比色法测定粗多糖中还原糖含量。在6支试管中分别加入1 mg/mL葡萄糖标准溶液0.00、0.10、0.20、0.30、0.40、0.50 mL,补蒸馏水至0.5 mL,然后加入DNS试剂1.5 mL,充分混匀。置于沸水浴中煮沸5 min,然后迅速流水冷却,并分别向试管中加入4 mL蒸馏水,混匀。在540 nm处测定吸光值。以葡萄糖浓度为横坐标,以吸光值为纵坐标制作标准曲线,得到其线性回归方程。
取1 mL样品溶液,按上述步骤测定吸光值,代入标准曲线y=1.2719x-0.0394(R2=0.9965),计算反应体系中的葡萄糖浓度(mg/mL)。还原糖含量(μg/mg)=葡萄糖浓度/1000×稀释倍数×提取液体积/提取物质量。
多糖含量(μg/mg)=总糖含量-还原糖含量
1.3.2 总酚含量测定 采用文献[10]的方法测定提取物总酚含量。200 μL样品依次加入2.5 mL水,0.5 mL福林酚试剂,混匀,反应1 min,再加入2 mL碳酸钠,25 ℃暗反应2 h,在760 nm处测定吸光值。以浓度为40、60、80、100、120、160 μg/mL的没食子酸标准品为横坐标,相应的吸光值为纵坐标,制作标准曲线。根据标准曲线拟合回归方程y=0.0032x+0.0471(R2=0.9983),计算样品中没食子酸当量的浓度,总酚含量(μg/mg)=总酚浓度×提取液体积/提取物质量,结果表示为μg GAE/mg提取物。
1.3.3 虫草素含量测定 用高效液相色谱法(high performance liquid chromatography,HPLC)测定虫草素含量[11]。进液相前,过0.22 μm有机滤膜,进样量20 μL。
色谱条件:色谱柱:ZORBAX Eclipse Plus C18反相分析柱(4.60 mm×250 mm,5 μm,Agilent);检测器:PAD检测器;流动相A:甲醇,流动相B:水,梯度洗脱:0~30 min,5%~60% A,30~40 min,60%~100% A。检测波长:260 nm。流速:0.8 mL/min;柱温:25 ℃;进样量:20 μL。
标准曲线配制:准确称取虫草素标准品30 mg,溶解于甲醇中,得到浓度为30 μg/mL的标准品母液。母液分别稀释至5、10、15、20、25、30 μg/mL,过0.22 μm滤膜,上样20 μL。以虫草素色谱峰面积为纵坐标,以浓度为横坐标,绘制虫草素标准曲线。根据标准曲线拟合的线性回归方程y=91882x+15080(R2=0.9997)计算提取物中虫草素浓度,再根据公式计算虫草素含量。
虫草素含量(μg/mg)=虫草素浓度×提取液体积/提取物质量
1.3.4 DPPH自由基清除力测定 测定DPPH自由基清除力采用文献[10]的方法,0.5 mL样品溶液和0.5 mL DPPH甲醇溶液混合均匀,37 ℃暗反应30 min,在517 nm处测定吸光值。DPPH自由基清除能力的计算采用公式:
其中,A样品是样品反应液的吸光度,A空白是以去离子水代替样品的溶液的吸光度。
1.3.5 还原能力测定 采用文献[12]的方法,0.2 mL样品溶液中依次加入1 mL 0.2 mol/L pH6.6的磷酸盐缓冲溶液,1 mL 1 g/100 mL铁氰化钾溶液,混匀,50 ℃水浴20 min,取出冷却,再加入1 mL 0.1 g/mL三氯乙酸。取1 mL上清液,加入0.2 mL 1 mg/mL的氯化铁溶液。10 min后在700 nm处测吸光度。测得的吸光值代表样品的还原能力,吸光值越大,代表还原能力越强。还原能力计算采用公式:
还原力=A样品-A空白
其中,A样品是样品反应液的吸光度,A空白是以去离子水代替样品的溶液的吸光度。
1.3.6 ABTS+·清除活性测定 采用文献[10]的方法,7 mmol/L ABTS和2.45 mmol/L K2S2O8以1∶2的体积比混合,室温下暗反应16 h,形成ABTS+·,使用前用无水乙醇稀释至吸光值在734 nm波长处为0.70±0.02,作为实验用的ABTS工作液。取0.5 mL样品溶液与2 mL ABTS+·溶液混合,室温下静置反应6 min,测定在723 nm处的吸光度。ABTS+·清除能力计算采用公式:

其中,A样品是样品反应液的吸光度,A空白是以去离子水代替样品的溶液的吸光度。
1.3.7 铁离子还原力(FRAP)测定 铁离子还原力代表样品的抗氧化能力。铁离子还原力测定方法采用文献[10]的方法,将250 mL 0.3 mol/L的醋酸盐缓冲液(pH=3.6),25 mL 10 mmol/L的TPTZ溶液(40 mmol/L盐酸溶解)和25 mL 20 mmol/L的氯化铁溶液混合,配成铁离子还原力试剂,反应时,将0.4 mL样品和1 mL FRAP混合,置于37 ℃水浴20 min,在593 nm处测定吸光值。配制0~1000 μmol/L的FeSO4溶液,以FeSO4代替样品,制作标准曲线,其中,横坐标为FeSO4的浓度,纵坐标为相应的吸光值。根据标准曲线y=0.0021x+0.2106(R2=0.9943),计算出被测定样品的硫酸亚铁当量浓度,结果表示为μmol/L FeSO4。
1.3.8 抗氧化指标的半最大效应浓度(EC50)值的计算 根据拟合方程,计算当DPPH自由基清除率、ABTS+·清除率达到50%以及还原力吸光值达到0.5时的有效浓度(EC50),以比较豆渣发酵前后水提物的抗氧化能力。
1.4 数据处理
实验数据均为3次重复实验所得的平均值,结果表示为平均值±标准偏差,采用SPSS 16.0进行ANOVA单因素方差分析及Duncan多重比较,p<0.05为显著水平。用Origin 8.0软件作图,并通过SPSS 16.0软件进行皮尔森相关性分析,通过SIMCA-P11.5软件进行主成分分析。
2 结果与分析
2.1 发酵前后多糖、总酚和虫草素含量变化
表1为豆渣发酵前后豆渣水提物中功能性成分的变化。

表1 发酵前后多糖、总酚和虫草素含量变化Table 1 Chang in polysaccharide,total polyphenols and cordycepin of unfermented and fermented okara
注:“Nd”表示未检测到;同列数据不同小写字母表示差异显著(p<0.05)。
未发酵豆渣提取物中多糖含量为(166.31±7.11) μg/mg,经过蛹虫草CM-1发酵,发酵豆渣多糖含量提高为(236.16±39.91) μg/mg,是发酵前的1.42倍。发酵过程中,一方面CM-1分泌的少量纤维素酶将豆渣中的纤维素降解为可溶性多糖;另一方面,随着CM-1的生长,菌丝增多,发酵豆渣多糖也增加[13]。
未发酵豆渣提取物中总酚含量为(5.55±0.1) μg GAE/mg,经蛹虫草CM-1发酵后豆渣总酚含量提高至(11.94±0.33) μg GAE/mg,是未发酵豆渣的2.15倍。Singh[14]等用哈茨木霉NBRI-1055发酵大豆,大豆的总酚含量显著增加。Chandrasekara[15]等认为发酵前酚类化合物与不溶性纤维结合,在微生物发酵过程中,酚类被释放,使水提物中总酚含量增加。发酵后豆渣表面结构变化,豆渣的比表面积增加,也能促进多酚溶出[16]。
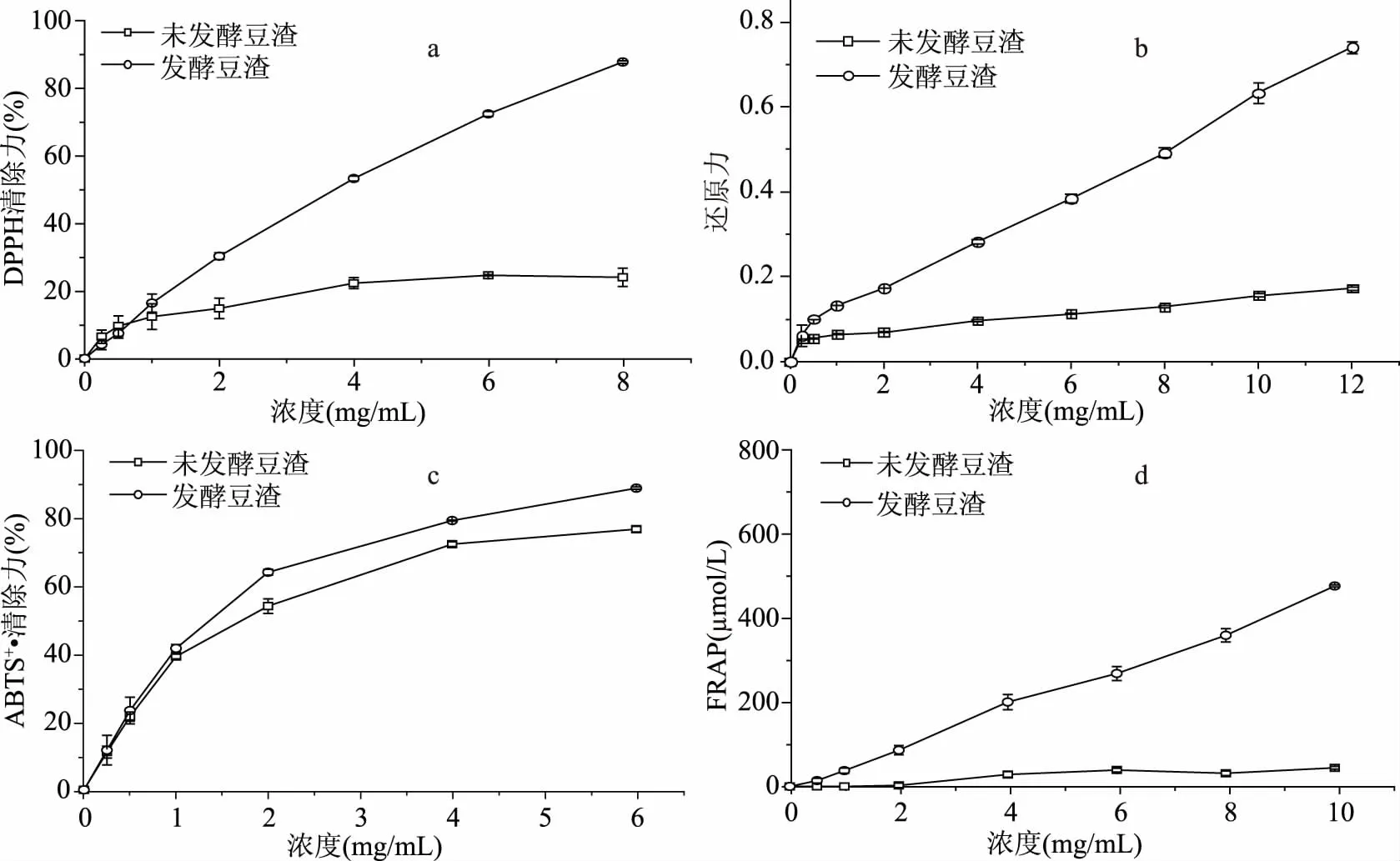
图1 豆渣发酵前后抗氧化能力变化Fig.1 Changes in antioxidant activity of fermented and unfermented okara
虫草素是蛹虫草的重要代谢成分之一,豆渣中不含虫草素,发酵过程中CM-1分泌虫草素使发酵豆渣虫草素含量增加。发酵7 d后,豆渣提取物中虫草素的含量为(1.88±0.04) μg/mg。
2.2 发酵前后抗氧化能力变化
2.2.1 未发酵豆渣和发酵豆渣抗氧化指标变化 本研究以DPPH自由基清除能力、还原力、ABTS+·清除能力及FRAP这4种不同的抗氧化能力评价为指标,测定了未发酵豆渣、发酵豆渣抗氧化能力随提取物浓度的变化情况,结果如图1(a~d)所示。
由图1(a)可知,随着浓度的增加,发酵后豆渣提取物DPPH自由基清除力明显提高,而未发酵豆渣的提高不明显。当提取物浓度为6 mg/mL时,未发酵豆渣DPPH自由基清除力为24.62%,发酵豆渣为72.40%。Juan等[17]报道,经枯草芽孢杆菌发酵的黑豆DPPH自由基清除力有所提高,是由于发酵后黑豆中总酚含量提高引起的。因此,发酵豆渣总酚含量增加可能使发酵后豆渣提取物DPPH自由基清除力提高。另外,DPPH清除能力提高可能与发酵豆渣多糖变化有关。Shi[18]用金针菇发酵豆渣提取多糖有较强的DPPH自由基清除力。除此之外,张琳[19]发现虫草素具有一定的抗氧化能力,DPPH清除率随着虫草素浓度的升高而上升。发酵豆渣提取物含有1.88 μg/mg虫草素,能提高豆渣的抗氧化性。
还原潜力反应抗氧化物质通过自身的还原作用提供电子的能力,还原潜力越大,样品的抗氧化能力越强。由图1(b)可知发酵豆渣的还原能力高于未发酵豆渣,说明发酵豆渣具有更强的抗氧化能力。提取物浓度为6 mg/mL,还原力由0.11提高到0.38。有研究认为,发酵过程中会产生一些还原酮物质,这些物质通过提供电子使自由基变成稳定的物质,以中断自由基链式反应,从而使发酵后的样品具有更强的还原潜力[20]。因此蛹虫草CM-1发酵豆渣的过程中可能产生了含有还原酮的物质,从而提高了发酵豆渣的还原力,但有待进一步的实验确认。
如图1(c)所示,发酵前后豆渣的提取物都有ABTS自由基清除能力,而且随着提取物浓度增加,ABTS自由基清除能力增强,与浓度成量效关系。发酵后豆渣提取物ABTS自由基清除能力增强,当提取物浓度为6 mg/mL时,未发酵豆渣为76.76%,发酵豆渣为88.71%。Kim[21]认为ABTS自由基清除力的提高和总酚增加有关。Chan[22]等认为,多酚在电子传递链中有很重要的作用,多酚提供电子与自由基配对,将自由基转化为相对稳定的终产物,打断自氧化途径。
FRAP主要体现样品的总还原力。由图1(d)可知,未发酵豆渣随着提取物浓度增加,总还原力几乎没有变化,而发酵豆渣总还原力随浓度增加而上升,且与提取液浓度呈正相关。当提取物浓度为6 mg/mL时,未发酵豆渣的FRAP值为39.08,发酵豆渣为269.55。Qin[23]发现枯草芽孢杆菌发酵黑豆后,总还原力提高,这可能与发酵过程中铁离子螯合物的释放有关。Vadivel[24]等认为,提取物中的多酚将Fe3+-TPTZ还原成Fe2+-TPTZ。因此,发酵豆渣总还原力的提高可能与总酚含量提高有关,多酚与自由基反应使其转化为更稳定的化合物,终止自由基链反应[25-26]。
2.2.2 未发酵豆渣和发酵豆渣的EC50值 EC50值代表清除率达到50%时样品的浓度[27]。样品的抗氧化能力与EC50值密切相关。EC50值越小,说明抗氧化能力越强。用EC50值比较样品的抗氧化能力,结果如表2所示。ABTS自由基清除力,未发酵豆渣的EC50值是1.70 mg/mL,而发酵豆渣的EC50值为1.34 mg/mL,说明发酵豆渣的ABTS自由基清除力较高。因此,蛹虫草CM固态发酵豆渣能显著提高豆渣水提物的抗氧化能力。

表2 豆渣发酵前后水提物抗氧化指标的EC50值Table 2 EC50values in antioxidant properties of water extracts from unfermented okara and fermented okara
注:同行小写字母不同表示差异显著(p<0.05)。Nd:表示未检测到。
2.3 多糖、总酚、虫草素含量与抗氧化活性的关系
许多研究表明,多糖、总酚、虫草素含量变化可以改善其抗氧化能力[14-23],因此,通过SPSS 16.0软件对豆渣水提物中多糖、总酚、虫草素含量与不同抗氧化能力进行皮尔森相关性分析,结果如表3所示。可以看出,多糖含量与不同抗氧化能力的相关性依次为:ABTS自由基清除率>DPPH自由基清除率>FRAP>还原力;总酚含量与不同抗氧化能力的相关性依次为:DPPH自由基清除率>FRAP>还原力>ABTS自由基清除率;虫草素含量与不同抗氧化能力的相关性依次为:还原力>FRAP>DPPH自由基清除率>ABTS自由基清除率。
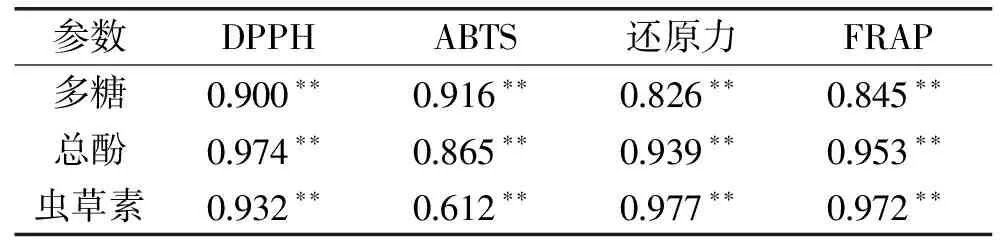
表3 多糖、总酚、虫草素含量和抗氧化能力的皮尔森相关性分析Table 3 Pearson’s correlation coefficients between polysaccharide,total phenolic, cordycepin content and antioxidant capacity
注:“**”表示在 0.01 水平(双侧)上显著相关。
2.4 抗氧化性能主成分分析
为了能得到所有参数相关性的宏观表达,采用SIMCA-P软件对多糖、总酚、虫草素和抗氧化能力指标进行主成分分析,结果如图2所示。PC1解释了总数据量的90.01%,PC2解释了总数据量的8.28%,主要反映不同样本重复间差异,表明样本重复性较好。PC1、PC2累计贡献率为98.29%,因此这2个主成分能够代表整体数据的信息特征。ABTS自由基清除力、多糖、总酚和PC1、PC2呈正相关性,DPPH自由基清除率、FRAP、还原力、虫草素和PC1、PC2呈负相关性。多糖、总酚、虫草素和抗氧化能力指标之间的相关性与皮尔森相关性分析所得结论相似。
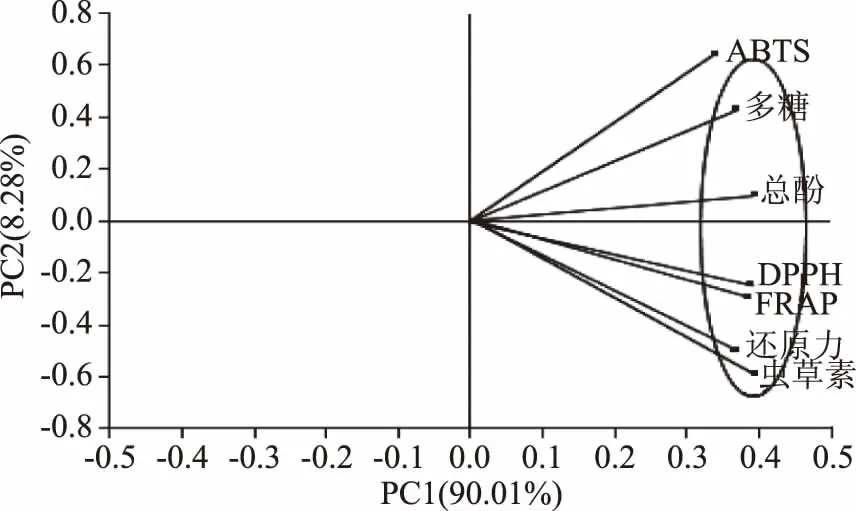
图2 抗氧化性能主成分分析Fig.2 Principal component analysis of antioxidant properties
3 结论
本文用冷冻干燥法获得冻干粉,测定了豆渣发酵前后水提物功能性成分以及抗氧化能力变化。豆渣经过蛹虫草CM-1发酵,发酵豆渣中含有虫草素,提取物中的总酚、多糖含量显著提高。发酵豆渣水提物DPPH自由基清除能力、还原力、FRAP、ABTS+·清除能力均比未发酵豆渣高,说明发酵豆渣具有更强的抗氧化活性。彭志妮等[8]用蛹虫草发酵大豆,发酵终点水提物抗氧化能力降低,可能是发酵前大豆水提物的功能活性物质较多,发酵后部分水溶性的功能活性物质被分解,水提物抗氧化能力降低;而本文中发酵后豆渣水提物抗氧化能力增强,是因为豆渣是大豆加工过程中水不溶性的物质,具有抗氧化能力的物质含量本来很少,因此豆渣发酵前抗氧化能力差,而发酵后豆渣中功能性成分(多糖、虫草素、总酚)含量增加,水提物抗氧化能力提高。
皮尔森相关性和主成分分析表明,总酚、多糖、虫草素含量增加与抗氧化活性的提高有关。本研究表明,灭菌后的豆渣可以直接用作蛹虫草的发酵基质。豆渣经过蛹虫草CM-1发酵,功能性成分含量提高,抗氧化能力增强,为豆渣开发成为含虫草素的食品基料及抗氧化食品提供可能。发酵后豆渣可以加工为食品直接食用;作为抗氧化食品辅料,添加到饼干、面包等食品中;也可开发发酵豆渣提取液作为功能性饮料等。发酵豆渣含有多种功能性成分,具有抗氧化能力,对实现豆渣资源精深加工和高值化利用具有一定的促进意义。
本文研究了发酵豆渣的体外抗氧化能力,可进一步测定并研究抗氧化能力指数、总抗氧化能力等指标与功能性成分之间关系,并进一步研究发酵豆渣水提物体内抗氧化能力,为未来抗氧化功能性食品开发提供更深入的理论和技术支撑。
[1]Vong W C,Liu S Q. Biovalorisation of okara(soybean residue)for food and nutrition[J]. Trends in Food Science and Technology,2015,52:139-147.
[2]伍时彬,王淼,张薇. 米曲霉豆渣曲抗氧化活性物的制备研究[J]. 食品工业科技,2010(9):201-203.
[3]江成英,孙艳玲,张文学,等. 富含β-胡萝卜素的发酵豆渣功能食品的研制[J]. 食品工业,2016(1):174-176.
[4]谢婧. 豆渣发酵过程中主要营养保健成分变化规律的研究[D]. 长沙:湖南农业大学,2008.
[5]管瑛,汪瑨芃,李文,等. 豆渣固态发酵过程中主要营养成分及抗氧化特性变化[J]. 食品科学,2016,37(21):189-194.
[6]李晨曦. 蛹虫草有效成分的提取及保健食品的开发[D]. 南昌:南昌大学,2013.
[7]朱振元,贾长英,孙会轻. 蛹虫草发酵大米的成分分析及体外抗氧化活性研究[J]. 食品工业科技,2016,37(20):235-248.
[8]彭志妮,郭丽琼,张新超,等. 蛹虫草固体发酵大豆基质的成分及抗氧化活性变化研究[J]. 菌物学报,2011,30(2):338-342.
[9]Li S,S Y,Z D,et al. Optimization of fermentation conditions for crude polysaccharides by Morchella esculenta using soybean curd residue[J]. Industrial Crops and Products,2013,50(10):666-672.
[10]Xiao Y,Xing G L,Rui X,et al. Enhancement of the antioxidant capacity of chickpeas by solid state fermentation with Cordyceps militaris SN-18[J]. Journal of Functional Foods,2014,10:210-222.
[11]Yu R,Ye B,Yan C,et al. Fingerprint analysis of fruiting bodies of cultured Cordyceps militaris by high-performance liquid chromatography-photodiode array detection[J]. Journal of Pharmaceutical & Biomedical Analysis,2007,44(3):818-823.
[12]Samurailatpam S,Amit K R,Ali M,et al. Enhancement of antioxidant properties of two soybean varieties of Sikkim Himalayan region by proteolytic Bacillus subtilis fermentation[J].Journal of Functional Foods,2015,14:650-658.
[13]贺晓玉,罗杰,李英伦. 响应面法优化蛹虫草菌固体发酵五味子药渣发酵条件[J]. 食品工业科技,2014,35(15):166-170.
[14]Singh H B,Singh B N,Singh S P,et al. Solid-state cultivation of Trichoderma harzianumNBRI-1055 for modulating natural antioxidants in soybean seed matrix[J]. Bioresource Technology,2010,101:6444-6453.
[15]Chandrasekara A,Shahidi F. Bioaccessibility and antioxidant potential of millet grain phenolics as affected by simulatedinvitro,digestion and microbial fermentation[J]. Journal of Functional Foods,2012,4(1):226-237.
[16]Li S,Chen Y,Li K,et al. Characterization of physicochemical properties of fermented soybean curd residue by Morchella esculenta[J]. International Biodeterioration and Biodegradation,2016,109:113-118.
[17]Juan M Y,Chou C C. Enhancement of antioxidant activity,total phenolic and flavonoid content of black soybeans by solid state fermentation with Bacillus subtilis BCRC 14715[J]. Food Microbiology,2010,27(5):586-591.
[18]Shi M,Yang Y,Guan D,et al. Bioactivity of the crude polysaccharides from fermented soybean curd residue by Flammulinavelutipes[J]. Carbohydrate Polymers,2012,89(4):1268-1276.
[19]张琳. 虫草素的分离鉴定及其生物活性研究[D]. 天津:南开大学,2015.
[20]Lee I,Hung Y H,Chou C C. Solid-state fermentation with fungi to enhance the antioxidative activity,total phenolic and anthocyanin contents of black bean[J]. International Journal of Food Microbiology,2008,121(2):150-156.
[21]Kim J,Choi J N,Kang D,et al. Correlation between antioxidative activities and metabolite changes during Cheonggukjang fermentation[J]. Bioscience,Biotechnology,and Biochemistry,2011,75(4):732-739.
[22]Chan K W,Khong N M,Iqbal S,et al. Isolation and antioxidative properties of phenolics-saponins rich fraction from defatted rice bran[J]. Journal of Cereal Science,2013,57(3):480-485.
[23]Qin Y,Jin X N,Park H D. Comparison of antioxidant activities in black soybean preparations fermented with various microorganisms[J]. Agricultural Sciences in China,2010,9(7):1065-1071.
[24]Vadivel V,Stuetz W,Scherbaum V,et al. Total free phenolic content and health relevant functionality of Indian wild legume grains:Effect of indigenous processing methods[J]. Journal of Food Composition and Analysis,2011,24(7):935-943.
[25]Luthria D L,Liu K. Localization of phenolic acids and antioxidant activity in sorghum kernels[J]. Journal of Functional Foods,2013,5:1751-1760.
[26]Chan K W,Khong N M,Iqbal S,et al. Isolation and antioxidative properties of phenolics-saponins rich fraction from defatted rice bran[J]. Journal of Cereal Science,2013,5:480-485.
[27]Lee Y L,Yang J H,Mau J L. Antioxidant properties of water extracts from Monascus fermented soybeans[J]. Food Chemistry,2008,106(3):1128-1137.

