表儿茶素在模拟生理条件下对人血清蛋白糖基化反应的影响
,,,,,,,*
(1.江西省农业科学院,江西南昌 330200; 2.江西师范大学,江西南昌 330022)
蛋白质与糖之间的反应称为美拉德反应或非酶褐变反应,在食品加工贮藏及人体内广泛存在[1]。该反应一方面可赋予食品诱人的颜色、增加消费者食欲,还可以掩盖食物的过敏原表位、降低蛋白质的致敏性[2-3];另一方面,糖基化反应会产生丙烯酰胺、5-羟甲基糠醛、糖基化终产物(AGEs)等有害物质[1,4-5],这些物质可直接或者间接导致心脑血管疾病、肾脏疾病、糖尿病等发生,危害极大[1,6]。由此可见,蛋白质糖基化反应具有双面性,这与蛋白质的种类、糖的种类、反应时间、反应环境等因素有关。因此,如何有效调控糖基化反应进程,不产生危害物,是当前蛋白质糖基化反应研究中需要解决的问题之一。一些研究者采用天然抗氧化剂抑制糖基化反应过程,实现对危害物的抑制,由于各种抗氧化剂的植物来源及纯度不同,同时,这些抗氧化剂对不同处理温度、时间、湿度、pH等因素敏感性各异,在抑制效果方面差异较大[7-10]。
表儿茶素是一种良好的天然抗氧化剂[11],可作为蛋白质糖基化反应的潜在抑制剂。目前对表儿茶素的研究主要集中于提取、纯化及其与其它天然抗氧化剂活性比较等方面[12-14],而对模拟人体生理条件下蛋白质糖基化抑制效果评价、糖基化产物理化性质分析等方面的研究较少。为此,本研究构建人血清蛋白-核糖美拉德反应模型,模拟人体生理条件,探究表儿茶素对蛋白质糖基化反应的抑制及糖基化产物的性质影响,从而为人体生理条件下抑制糖基化危害物的产生提供理论依据。
1 材料与方法
1.1 材料与仪器
表儿茶素 ≥98%,上海阿拉丁生化科技股份有限公司;D-核糖 ≥99%,上海阿拉丁生化科技股份有限公司;人血清蛋白 ≥96%,美国Sigma公司;磷酸氢二钠、三氯乙酸、叠氮化钠、邻苯二甲醛、十二烷基硫酸钠等 分析纯,国药集团化学试剂有限公司。
AB104-N电子天平 上海第二天平仪器厂;F-7000荧光分光光度计 日本日立公司;T6紫外可见分光光度计 北京普析通用仪器有限责任公司;DV-III流变仪 美国Brookfield公司;4800 Plus MALDI-TOF-MS质谱 ABI Science公司;Mini Protean 3 Cell小型垂直电泳仪 美国Bio-Rad伯乐公司;HH-4数显恒温水浴锅 常州国华电器有限公司;DNP-9082电热恒温培养箱 上海精宏实验设备有限公司;PHS-3G型pH计 上海雷磁仪器厂。
1.2 实验方法
1.2.1 糖基化反应模型建立及糖基化产物制备 采用0.2 mol/L的PBS缓冲溶液(pH7.4)配制50 mg/mL的人血清蛋白(HSA)溶液,按照1∶1比例添加等质量的D-核糖,并在混合溶液中添加0.05%的叠氮化钠,混匀;取2 mL混合液于离心管中,分别加入0.5 mL含有0.01、0.02、0.03、0.04 mol/L表儿茶素的PBS缓冲溶液,以未加表儿茶素的PBS缓冲液为对照。然后将离心管放入37 ℃恒温恒湿培养箱中孵化5 d。反应结束后,分析不同表儿茶素添加量对糖基化的抑制率及糖基化产物的分子量、热集聚程度、pH、粘度、自由氨基、表面疏水性的影响。
1.2.2 糖基化反应抑制率的测定 参照文献[15]方法,略有修改,用0.2 mol/L的PBS缓冲溶液(pH7.4)将样品稀释至1 mg/mL,按1∶1体积比加入20%的三氯乙酸溶液,10000 r/min离心10 min,弃去上清液,沉淀用1.6 mL的磷酸盐缓冲溶液(0.2 mol/L,pH7.4)复溶,然后进行荧光测定,设定激发波长为350 nm,发射波长为420 nm,狭缝宽度为5 nm,磷酸盐缓冲溶液为空白,抑制率的计算公式如下:
抑制率(%)=(1-F实验组/F对照组)×100
1.2.3 分子量的测定 采用聚丙烯酰胺凝胶电泳(SDS-PAGE)及基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)法测定分子量,具体操作参照钟比真[16]和Totlani V M[17]等方法。
1.2.4 热聚集度的测定 参照文献[18]报道的方法,略微修改,用0.2 mol/L的PBS缓冲溶液(pH7.4)将样品稀释至1 mg/mL,将稀释后的样品分别加热至30、40、50、60 ℃,采用紫外可见分光光度计测定各温度下样品在600 nm处的吸光值,以磷酸盐缓冲溶液为空白。
1.2.5 pH测定 采用pH计测定样品的pH。
1.2.6 自由氨基测定 采用邻苯二甲醛(OPA)方法[10]测定自由氨基的含量。OPA试剂的配制:称40.0 mg OPA溶于1.0 mL甲醇,再加入2.5 mL 20%(w/w)SDS,25.0 mL 0.1 mol/L硼砂,100 μLβ-巯基乙醇,最后用蒸馏水定容到50 mL。取200 μL处理样品,加入配置好的OPA溶液4.0 mL,混匀,于35 ℃条件下反应2 min,以蒸馏水为对照,在340 nm处测定吸光值。以赖氨酸为标准物质,以浓度为横坐标,340 nm下的吸光值为纵坐标制作标准曲线,标准曲线方程为:y=2.207x+0.04(R2=0.999),根据方程计算样品中自由氨基的含量。
1.2.7 表面疏水性测定 采用ANS荧光探针法[19]测定样品的表面疏水性,将反应后的样品用PBS(0.05 mol/L,pH7.4)稀释成1、0.5、0.1、0.05、0.02 mg/mL溶液。取2 mL不同浓度的样品与20 μL 8 mmol/L ANS(0.02 mol/L,pH7.4)溶液混合后,测定其荧光强度。设定激发波长和发射波长分别为385 nm和400~600 nm,扫描速度为240 nm/min,激发狭缝宽度为10 nm,发射的狭缝宽度为10 nm,电压为400 V。以横坐标为样品浓度(mg/mL),纵坐标为荧光强度作图,采用线性回归分析进行曲线拟合,曲线的斜率即为样品的表面疏水性(H0)。
1.3 数据分析
所有实验重复3次,实验数据采用Origin 8.0绘图,用SPSS 11.5软件进行显著性分析(p<0.05)。
2 结果与讨论
2.1 表儿茶素对HSA糖基化反应的抑制率
从图1可以看出,与未添加表儿茶素的反应体系相比,添加了表儿茶素的反应体系的糖基化反应抑制率在19%~80%之间,随着表儿茶素加入量的增加,抑制率显著提高(p<0.05),当达到0.04 mol/L时,抑制率达到最大值。实验结果显示在模拟人体环境下,表儿茶素能够显著性的抑制HSA-核糖体系糖基化程度(p<0.05)。
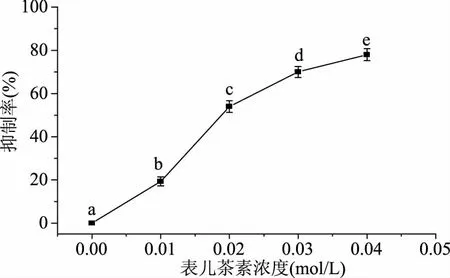
图1 表儿茶素对HSA糖基化反应的抑制率Fig.1 Inhibition rate of epicatechin on glycosylation of HAS注:不同字母表示在0.05水平差异显著,图4~图6同。
2.2 表儿茶素对HSA糖基化产物分子量的影响
由图2中的SDS-PAGE图谱可以看出,与未添加表儿茶素的反应体系相比,添加不同浓度表儿茶素的HSA的分子量略有减少,且添加0.04 mol/L表儿茶素的体系中未产生聚合物。

图2 不同浓度的表儿茶素对HSA糖基化产物分子量的影响Fig.2 Effects of different concentration epicatechin on the molecular weight of HSA glycosylation products 注:1、2、3、4、5分别为添加0、0.01、0.02、0.03、0.04 mol/L表儿茶素的HSA糖基化产物的电泳条带。
通过MALDI TOF MS质谱图(图3)可以看出:天然HSA的分子量为66.4 kDa,未添加表儿茶素HSA糖基化反应后分子量提高到70.0 kDa,添加0.04 mol/L表儿茶素的体系中,产物的分子量为67.8 kDa,添加表儿茶素后,糖基化产物的分子量减少了,可见,表儿茶素可以有效地抑制HSA糖基化反应。

图3 不同浓度的表儿茶素对HSA糖基化产物MALDI TOF MS图谱的影响Fig.3 MALDI TOF MS of HSA glycosylation products with different concentration epicatechin注:A、B、C分别为天然HSA、添加0.04 mol/L表儿茶素的HSA糖基化产物和未添加表儿茶素的HSA糖基化产物的MALDI TOF MS图谱。
2.3 表儿茶素对HSA糖基化产物热聚集度的影响
从图4可以看出,天然HSA对热非常敏感,当温度不断升高至60 ℃时,蛋白发生明显变性和聚集;未添加表儿茶素的HSA糖基化产物的热变性程度最低。随着表儿茶素浓度的增加,HSA糖基化产物的热集聚程度随温度升高而呈上升的趋势。当表儿茶素添加量达到0.04 mol/L时,其吸光值随着温度的增加而显著提高(p<0.05),热聚集度增加较大,说明HSA发生了聚集变性,稳定性差。一般情况下,糖基化反应程度与蛋白质的热聚集程度具有相关性,糖基化可以提高蛋白质的热稳定性[20]。但从图4可知,体系的热稳定性变差,说明糖基化程度不高,表儿茶素的添加能够显著地抑制糖基化反应。

图4 不同表儿茶素浓度对HSA糖基化产物热集聚度的影响Fig.4 Effects of different concentration epicatechin on the thermal aggregation of HSA glycosylation products
2.4 表儿茶素对HSA糖基化产物pH的影响
由图5可知,与HAS的PBS溶液pH为7.4以及未添加表儿茶素的糖基化产物pH为6.5相比,随着表儿茶素浓度的增加,HSA糖基化产物的pH显著升高(p<0.05),在0.04 mol/L时,pH达到最大(<7.4),与浓度为0.03 mol/L时的pH无显著差异(p>0.05)。一般来说,蛋白质糖基化程度越高,pH降低越显著[21],添加表儿茶素后pH的增加,说明糖基化进程受阻,糖基化反应被抑制,相对于起初HAS的PBS溶液pH为7.4,pH的下降主要是由于美拉德反应产物中有机酸(甲酸、乙酸)的生成以及氨基的消耗造成的。

图5 不同浓度表儿茶素对HSA糖基化产物pH的影响Fig.5 Effects of different concentration epicatechin on pH of HSA glycosylation products
2.5 表儿茶素对HSA糖基化产物自由氨基、表面疏水性的影响
从图6可以看出随着表儿茶素浓度的增加,HSA糖基化产物的自由氨基、表面疏水性也随之显著性增加(p<0.05),说明表儿茶素在一定程度上抑制了糖基化反应(p<0.05),其原因可能是抑制剂阻止了蛋白质氨基与糖羰基的结合,使得蛋白分子结构部分展开,自由氨基增加,包埋在分子内部的疏水性残基更多的暴露出来,表面疏水性增加[22-23]。

图6 表儿茶素对糖基化产物自由氨基、表面疏水性的影响Fig.6 Effects of different concentration epicatechin on the free amino group content and surface hydrophobicity of HSA glycosylation products
3 结论
研究显示,在模拟生理条件下以人血清蛋白与核糖构建的美拉德反应体系中,添加表儿茶素对蛋白质糖基化反应具有抑制作用,抑制效果随着表儿茶素添加量的增加而增加,当添加量为0.04 mol/L时,对HSA糖基化的抑制率近80%,添加表儿茶素后糖基化产物的分子量变小;通过分析糖基化产物的性质可以看出随着表儿茶素添加量的增加,产物的pH、热集聚程度、自由氨基、表面疏水性增加,这些性质变化说明表儿茶素对糖基化反应具有抑制效果。该研究结果可以为生理条件下糖基化反应危害物的控制提供理论依据。同时,为了使表儿茶素抑制糖基化反应的研究理论体系趋于完整,其抑制反应的内在机制及糖基化产物的其它理化性质还需要进一步研究。
[1]袁媛,侯雪峰,封亮,等. 葛根素对体内外晚期糖基化终末产物形成的抑制作用[J]. 中草药,2017,48(7):1386-1390.
[2]Zhao Y,Cai Q,Jin T,et al. Effect of Maillard reaction on the structural and immunological properties of recombinant silver carp parvalbumin[J]. LWT-Food Science and Technology,2017,75:25-33.
[3]Iwan M,Vissers Y M,Fiedorowicz E,et al. Impact of Maillard Reaction on Immunoreactivity and Allergenicity of the Hazelnut Allergen Cor a 11[J]. Journal of Agricultural and Food Chemistry,2011,59(13):7163-7171.
[4]Hou L,Xie J,Zhao J,et al. Roles of different initial Maillard intermediates and pathways in meat flavor formation for cysteine-xylose-glycine model reaction systems[J]. Food Chemistry,2017,232:135-144.
[5]Abdelhedi O,Mora L,Jemil I,et al. Effect of ultrasound pretreatment and Maillard reaction on structure and antioxidant properties of ultrafiltrated smooth-hound viscera proteins-sucrose conjugates[J]. Food Chemistry,2017,230:507-515.
[6]刘玲,闫凤娇,石飞,等. 食品加工中晚期糖基化终产物的变化趋势及茶多酚对其抑制作用[J]. 中国食品学报,2016(5):95-102.
[7]朱晓琳,刘跃钧,陆敏,等. 不同品种马兰的活性组分及抑制蛋白糖基化功能[J]. 食品科学,2014(9):90-95.
[8]陈绍红,刘少彬,赵云涛. 苦瓜提取物抑制蛋白质的非酶糖基化[J]. 中国实验方剂学杂志,2012(15):211-214.
[9]杨立军,冯翠霞,武召珍,等. 儿茶素对甘油醛白蛋白非酶糖基化的抑制作用[J]. 中国兽医杂志,2015(1):25-27.
[10]包怡红,王文琼,陈颖. pH对乳清蛋白糖基化产物体外抗氧化特性的影响[J]. 食品与发酵工业,2011(11):134-140.
[11]Cuevas E,Limón D,Pérez-Severiano F,et al. Antioxidant effects of Epicatechin on the hippocampal toxicity caused by Amyloid-beta 25-35 in rats[J]. European Journal of Pharmacology,2009,616(1-3):122-127.
[12]孙黎,周娟,徐自奥,等. 儿茶中表儿茶素提取工艺研究[J]. 安徽中医药大学学报,2016(2):80-83.
[13]Mendoza-Wilson A M,Glossman-Mitnik D. Theoretical study of the molecular properties and chemical reactivity of(+)-catechin and(-)-epicatechin related to their antioxidant ability[J]. Journal of Molecular Structure Theochem,2006,761(1-3):97-106.
[15]李晓明,邓荣华,孔阳辉,等. 芦丁抑制牛血清白蛋白糖基化[J]. 食品科学,2014(3):85-89.
[16]钟比真,涂宗财,王辉. 微波场中卵清蛋白糖基化产物不均匀性的光谱分析[J]. 光谱学与光谱分析,2017(6):1896-1901.
[17]Totlani V M,Peterson D G. Reactivity of epicatechin in aqueous glycine and glucose Maillard reaction models:quenching of C2,C3,and C4 sugar fragments[J]. Journal of Agricultural and Food Chemistry,2005,53(10):4130-4135.
[18]常海霞,石燕,王辉,等. 超声波对草鱼肌肉肌原纤维蛋
白溶液理化特性的影响[J]. 食品科学,2015(5):56-60.
[19]Zhang Q,Tu Z,Xiao H,et al. Influence of ultrasonic treatment on the structure and emulsifying properties of peanut protein isolate[J]. Food and Bioproducts Processing,2014,92(1):30-37.
[20]Sevo M,Degrassi G,Skoko N,et al. Production of glycosylated thermostable Providencia rettgeri penicillin G amidase in Pichia pastoris[J]. FEMS Yeast Res,2002,1(4):271-277.
[21]王松,夏秀芳,黄莉,等. 湿法糖基化改性对大豆分离蛋白功能性质的影响[J]. 食品科学,2014,35(9):38-42.
[22]Xiong W,Wang Y,Zhang C,et al. High intensity ultrasound modified ovalbumin:Structure,interface and gelation properties[J]. Ultrasonics Sonochemistry,2016,31:302-309.
[23]许晶,齐宝坤,赵青山,等. 大豆分离蛋白结构特性与表面疏水性的关系[J]. 中国粮油学报,2015(8):32-36.

