miR-432对骨肉瘤细胞增殖、迁移、侵袭的影响及机制
荣辉,王志臣,于兴胜,韩康
(济南军区总医院,济南250031)
miR-432对骨肉瘤细胞增殖、迁移、侵袭的影响及机制
荣辉,王志臣,于兴胜,韩康
(济南军区总医院,济南250031)
目的探讨微小RNA-432(miR-432)对骨肉瘤细胞增殖、迁移和侵袭的影响及其作用机制。方法采用qRT-PCR技术检测人骨肉瘤细胞MG-63、人成骨细胞hFOB1.19中miR-432表达。将对数生长期MG-63细胞随机分为三组,分别转染miRNA对照质粒(miR-NC组)、miR-432抑制质粒(miR-432 inhibitor组)及miR-432过表达质粒(miR-432组),转染48 h时进行接种培养,分别检测细胞增殖(吸光度值)、迁移和侵袭情况。利用miRWalk和miRanda生物信息学软件预测miR-432靶基因可能为致癌基因CX3CL1,分别构建含有miR-432结合位点的CX3CL1基因3′-UTR区野生型(CX3CL1-wt)和突变型(CX3CL1-mut)荧光素酶报告载体。将MG-63细胞分别共转染CX3CL1-wt或CX3CL1-mut报告载体和miR-432载体(观察组),并设置共转染miR-NC载体作为对照组。转染48 h时,采用双荧光素酶试剂盒检测相对荧光素酶活性。结果MG-63细胞中miR-432相对表达量低于hFOB1.19细胞(P<0.01)。miR-NC组、miR-432 inhibitor组、miR-432组细胞中miR-432相对表达量分别为1.00±0.01、0.47±0.03、3.62±0.03,组间比较P均<0.01。miR-432组培养24、36、48 h的细胞吸光度值均明显低于miR-NC组、miR-432 inhibitor组,miR-432 inhibitor组均明显高于miR-NC组。miR-432 inhibitor组及miR-432组细胞相对迁移率分别为(122±7)%、(65±4)%,相对侵袭率分别为(189±25)%、(49±11)%;上述指标组间比较P均<0.05。CX3CL1-wt和miR-432共转染MG-63细胞后,观察组相对荧光素酶活性低于对照组(P<0.05);CX3CL1-mut和miR-432共转染细胞后,对照组和观察组相对荧光素酶活性分别为1.00±0.11、0.93±0.13,两组比较P>0.05。结论miR-432过表达可抑制骨肉瘤细胞增殖、迁移和侵袭,靶向调控致癌基因CX3CL1可能是其作用机制。
骨肉瘤;微小RNA-432;细胞增殖;细胞迁移;细胞侵袭;CX3CL1
骨肉瘤是最常见的原发性恶性骨肿瘤,好发于20岁以下人群[1],骨肉瘤约占原发性恶性骨肿瘤的30%,常在发病早期就发生侵袭和转移,其中肺转移约占所有转移的90%,亦可见肝、脑、肾等部位转移[2]。由于其发生远处转移早,对放化疗反应不敏感,患者5年生存率为50%~60%[1]。研究表明,微小RNA(miRNA)通过参与肿瘤相关基因转录后水平调控,对骨肉瘤细胞增殖、迁移、侵袭等发挥重要作用[3,4]。miR-432作为新发现的与肿瘤相关的miRNA,在胃癌、肺癌、宫颈癌等组织或细胞中表达下调,且参与调控肿瘤生长、侵袭,但其与骨肉瘤发生、发展的关系报道较少[5]。前期研究发现,骨肉瘤组织中miR-432表达低于癌旁正常组织,提示miR-432表达下调可能参与了骨肉瘤的发生,但具体作用机制尚未明确[6]。2010年9月~2015年9月,我们观察了miR-432对骨肉瘤细胞增殖、迁移和侵袭的影响,现分析结果并探讨其作用机制。
1 材料与方法
1.1 材料 人骨肉瘤细胞株MG-63及人成骨细胞系hFOB1.19均购自中国科学院上海细胞库。FBS、DMEM培养基、青霉素、链霉素均购自美国Gibco公司。LipofectamineTM2000转染试剂、TRIzol、M-MLV逆转录酶购自美国Invitrogen公司。SsoAdvancedTMSYBR®Green Supermix试剂盒购自美国Bio-Rad公司。细胞增殖CCK-8试剂盒、双萤光素酶报告基因检测试剂盒购自上海碧云天生物技术有限公司。
1.2 细胞培养及分组处理 人骨肉瘤细胞MG-63及人成骨细胞系hFOB1.19均常规培养于含10% FBS的DMEM培养基(含100 U/mL青霉素、100 μg/mL链霉素),置于37 ℃、5% CO2培养箱中培养。取对数生长期MG-63细胞以密度为5×105个/孔接种于6孔板。当细胞融合度达70%左右时随机分为三组,采用LipofectamineTM2000转染试剂分别转染miRNA对照质粒(miR-NC组)、miR-432抑制质粒(miR-432 inhibitor组)及miR-432过表达质粒(miR-432组)。转染48 h时,收集各组细胞用于后续实验。
1.3 相关指标观察
1.3.1 细胞miR-432表达 取对数生长期MG-63、hFOB1.19细胞以及转染48 h的三组细胞,采用qRT-PCR法检测miR-432相对表达量。具体步骤:TRIzol法提取组织和细胞总RNA;采用miR-432特异性逆转录引物,以M-MLV逆转录酶逆转录合成cDNA;以U6作为内参,使用SsoAdvancedTMSYBR®Green Supermix试剂盒进行qRT-PCR。反应条件:95 ℃ 10 min、95 ℃ 15 s、62 ℃ 30 s、72 ℃ 30 s,共40个循环;72 ℃延伸10 min。采用2-ΔΔCt法计算miR-432相对表达量。
1.3.2 细胞增殖情况 采用CCK-8法检测。将转染48 h的三组细胞接种于96孔板(2×103个/孔),分别在培养0、12、24、36、48 h时每孔加入10 μL CCK-8溶液,37 ℃孵育2 h,检测450 nm波长处的吸光度(A)值。每组设置3个复孔,实验重复3次,结果取平均值。
1.3.3 细胞迁移情况 采用细胞划痕实验。将转染48 h的三组细胞接种于24孔板中(1×105个/孔),培养24 h时采用200 μL无菌移液器枪头在培养板底部进行“1”字形划痕,倒置显微镜下观察36 h时划痕中细胞的迁移情况,计算细胞相对迁移率(相对于miR-NC组)。每组设置3个复孔,实验重复3次,结果取平均值。
1.3.4 细胞侵袭情况 采用Transwell侵袭实验。采用预铺Matrigel基质胶的8 μm聚碳酸酯滤膜培养小室进行Transwell实验。将转染48 h的三组细胞以2.0×105个/孔接种于100 μL无血清培养基中,下室加入500 μL含10% FBS的DMEM培养液,每组设3个复孔。在37 ℃、5% CO2条件下培养36 h,用棉签轻轻擦掉上层未迁移细胞,PBS洗涤2次,4%多聚甲醛固定细胞10 min,0.1%结晶紫染色5 min。100倍显微镜下随机计数5个视野的细胞数,取平均数作为每组穿过小室细胞数,计算细胞相对(相对于miR-NC组)侵袭率。
1.3.5 miR-432下游靶基因确定 利用miRWalk和miRanda生物信息学软件对miR-432靶基因进行预测,结果显示miR-432与致癌基因CX3CL1的3′-UTR存在7个碱基结合位点。分别构建含有miR-432结合位点的CX3CL1基因3′-UTR区野生型(CX3CL1-wt)和突变型(CX3CL1-mut)荧光素酶报告载体。将处于对数生长期的MG-63细胞以密度为5×105个/孔接种于6孔板。当细胞融合度达70%左右时采用LipofectamineTM2000分别共转染CX3CL1-wt或CX3CL1-mut报告载体和miR-432载体(观察组),并设置共转染miR-NC载体作为对照组。转染48 h时,采用双荧光素酶试剂盒检测相对荧光素酶活性。以萤火虫荧光素酶活性/海肾荧光素酶活性的比值表示相对荧光素酶活性。
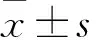
2 结果
2.1 各组miR-432表达比较 MG-63细胞及hFOB1.19细胞miR-432相对表达量分别为0.53±0.02、1.00±0.04,两者比较P<0.01。miR-NC组、miR-432 inhibitor组、miR-432组细胞miR-432相对表达量分别为1.00±0.01、0.47±0.03、3.62±0.03,组间比较P均<0.01。
2.2 各组细胞增殖情况比较 miR-432组培养24、36、48 h的A值均低于miR-NC组、miR-432 inhibitor组,miR-432 inhibitor组均高于miR-NC组(P均<0.05)。见表1。

表1 三组细胞增殖情况比较
注:与miR-NC组同时间点比较,*P<0.05;与miR-432 inhibitor组同时间点比较,△P<0.05。
2.3 各组细胞迁移能力比较 miR-432 inhibitor组及miR-432组细胞相对迁移率分别为(122±7)%、(65±4)%,组间比较P均<0.05。
2.4 各组细胞侵袭能力比较 miR-432 inhibitor组及miR-432组细胞相对侵袭率分别为(189±25)%、(49±11)%,组间比较P均<0.05。
2.5 miR-432下游靶基因 CX3CL1-wt和miR-432共转染MG-63细胞后,对照组和观察组相对荧光素酶活性分别为1.00±0.13、0.52±0.18,两组比较P<0.05;CX3CL1-mut和miR-432共转染细胞后,对照组和观察组相对荧光素酶活性分别为1.00±0.11、0.93±0.13,两组比较P>0.05。
3 讨论
随着新的辅助化疗技术的应用,骨肉瘤患者生存率明显提高,但远处转移仍是骨肉瘤治疗失败的主要原因[6]。明确与骨肉瘤转移密切相关的分子,对于探讨骨肉瘤转移的启动机制、预防骨肉瘤转移的发生、选择合适的靶点进行干预和治疗具有重要意义。
miRNA已被证明通过靶向调控肿瘤相关基因mRNA表达,从而抑制或促进肿瘤细胞增殖、分化、侵袭及转移等过程[7,8]。研究发现,miR-432在卵巢癌、宫颈癌、垂体腺瘤等多种肿瘤组织中低表达,并对肿瘤的发生、发展发挥负性调控作用[9,10]。miR-432过表达可阻滞神经母细胞瘤细胞于G0/G1期,抑制细胞增殖,参与神经母细胞瘤的神经元分化过程[11];miR-432在肝癌组织及细胞系中表达明显下调; miR-432过表达可抑制肝癌细胞增殖及其成瘤性,其作用机制可能为miR-432靶向调控Wnt/β-catenin信号通路[4];但在黑色素瘤细胞中miR-432异常高表达[12]。目前仍无法明确miR-432是发挥抑癌基因还是癌基因的作用,推测miR-432的表达和功能可能具有肿瘤类别依赖性。本研究结果显示,骨肉瘤细胞中miR-432高表达;转染miR-432或miR-432 inhibitor来提高或降低MG-63细胞中miR-432表达后发现,过表达miR-432可抑制MG-63细胞增殖、迁移和侵袭,下调miR-432表达则促进MG-63细胞增殖和转移,表明miR-432在骨肉瘤细胞中可能发挥抑癌基因作用。
CX3CL1蛋白属于CX3C趋化因子家族成员,不仅具有趋化功能,还具有细胞黏附功能。研究发现,CX3CL1在卵巢癌、乳腺癌细胞中高表达,且其表达水平与肿瘤细胞增殖及转移密切相关[13]。在恶性程度较高的少突胶质细胞瘤中,CX3CL1表达水平与患者总体生存率呈负相关[14]。CX3CL1表达水平亦与前列腺癌转移及患者预后相关,当用中和性抗体阻滞CX3CL1表达后,前列腺癌细胞的骨转移明显减少[15]。在骨肉瘤细胞中CX3CL1表达较正常成骨细胞明显升高,其通过PI3K/Akt/NF-κB信号通路上调细胞间黏附分子1表达,从而介导骨肉瘤细胞转移[16,17]。本研究我们利用靶基因预测软件发现miR-432与CX3CL1基因3′-UTR区的结合位点,提示CX3CL1可能是miR-432的下游靶基因,并进一步通过双荧光素酶报告基因检测实验验证预测的可靠性。
综上所述,miR-432可能通过靶向调控CX3CL1而抑制骨肉瘤细胞增殖、迁移和侵袭;miR-432可作为骨肉瘤治疗的一个新靶点。
[1] Durfee RA, Mohammed M, Luu HH. Review of osteosarcoma and current management[J]. Rheumatol Ther, 2016,3(2):221-243.
[2] He JP, Hao Y, Wang XL, et al. Review of the molecular pathogenesis of osteosarcoma[J]. Asian Pac J Cancer Pre, 2014,15(15):5967-5976.
[3] Kumar RMR, Boro A, Fuchs B. Involvement and clinical aspects of microRNA in osteosarcoma[J]. Int J Mol Sci, 2016,17(6):877-885.
[4] Sampson VB, Yoo S, Kumar A, et al. MicroRNAs and potential targets in osteosarcoma: review[J]. Front Pediatr, 2015(3):69-82.
[5] Jiang N, Chen WJ, Zhang JW, et al. Downregulation of miR-432 activates Wnt/β-catenin signaling and promotes human hepatocellular carcinoma proliferation[J]. Oncotarget, 2015,6(10):7866-7879.
[6] 林琰杰,于嘉智,魏传银.miR-133b对骨肉瘤细胞MG-63增殖的抑制作用及其机制[J].山东医药,2016,56(45):40-42.
[7] Reddy KB. MicroRNA (miRNA) in cancer[J]. Cancer Cell Int, 2015,15(1):38-42.
[8] Lin S, Gregory RI. MicroRNA biogenesis pathways in cancer[J]. Nat Rev Cancer, 2015,15(6):321-333.
[9] Kim YW, Kim EY, Jeon D, et al. Differential microRNA expression signatures and cell type-specific association with Taxol resistance in ovarian cancer cells[J]. Drug Des Devel Ther, 2014,8(1):293-314.
[10] Yao T, Rao Q, Liu L, et al. Exploration of tumor-suppressive microRNAs silenced by DNA hypermethylation in cervical cancer[J]. Virol J, 2013,10(1):175-182.
[11] Das E, Bhattacharyya NP. MicroRNA-432 contributes to dopamine cocktail and retinoic acid induced differentiation of human neuroblastoma cells by targeting NESTIN and RCOR1 genes[J]. Febs Letters, 2014,588(9):1706-1714.
[12] Nemlich Y, Greenberg E, Ortenberg R, et al. MicroRNA-mediated loss of ADAR1 in metastatic melanoma promotes tumor growth[J]. J Clin Invest, 2013,123(6):2703-2718.
[13] Gaudin F, Nasreddine S, Donnadieu AC, et al. Identification of the chemokine CX3CL1 as a new regulator of malignant cell proliferation in epithelial ovarian cancer[J]. PLoS One, 2011,6(7):e21546.
[14] Erreni M, Solinas G, Brescia P, et al. Human glioblastoma tumours and neural cancer stem cells express the chemokine CX3CL1 and its receptor CX3CR1[J]. Eur J Cancer, 2010,46(18):3383-3392.
[15] Shulby SA, Dolloff NG, Stearns ME, et al. CX3CR1-fractalkine expression regulates cellular mechanisms involved in adhesion, migration, and survival of human prostate cancer cells[J]. Cancer Res, 2004,64(14):4693-4698.
[16] Liu JF, Tsao YT, Hou CH. Fractalkine/CX3CL1 induced intercellular adhesion molecule-1-dependent tumor metastasis through the CX3CR1/PI3K/Akt/NF-κB pathway in human osteosarcoma[J]. Oncotarget, 2016,8(33):54136-54148.
[17] Jamiesongladney WL, Zhang Y, Fong AM, et al. The chemokine receptor CX3CR1 is directly involved in the arrest of breast cancer cells to the skeleton[J]. Breast Cancer Res, 2011,13(5):R91-102.
韩康(E-mail: 2160952686@qq.com)
10.3969/j.issn.1002-266X.2017.48.011
R738.1
A
1002-266X(2017)48-0037-03
2017-04-30)

