杜仲配伍黄芪对雌性大鼠去势后骨质疏松的影响
王吉博,王兆杰,安荣泽,彭浩,曾旋,王敏
(1遵义医学院珠海校区,广东珠海519041;2遵义医学院第五附属医院)
杜仲配伍黄芪对雌性大鼠去势后骨质疏松的影响
王吉博1,王兆杰2,安荣泽2,彭浩1,曾旋2,王敏1
(1遵义医学院珠海校区,广东珠海519041;2遵义医学院第五附属医院)
目的探讨杜仲配伍黄芪对雌性大鼠去势后骨质疏松的治疗效果。方法将雌性SD大鼠50只去势处理后随机分为杜仲组、黄芪组、杜仲与黄芪配伍组(配伍组)、雌激素组及模型组,并设假手术组,每组10只;前三组分别灌胃给予杜仲水煎液、黄芪水煎液及杜仲联合黄芪水煎液,雌激素组给予尼尔雌醇,其余组给予等量生理盐水,连续给药12周。除假手术组外,其余各组在给药期间肌注地塞米松磷酸钠注射液,每周2次。给药结束后检测血清钙、磷、碱性磷酸酶(ALP)、雌二醇(E2)、骨钙素(BGP)及股骨扭力;收集残骨进行灰化处理,检测骨钙、磷、氯含量。结果①与假手术组比较,其他组血清E2水平均降低,ALP水平均升高;模型组血清钙、磷水平降低,BGP水平升高。与模型组比较,杜仲组、黄芪组、配伍组、雌激素组血清钙、磷、E2水平升高,ALP、BGP水平降低。与配伍组比较,杜仲组、黄芪组血清钙、磷、E2水平降低,ALP、BGP水平升高;雌激素组血清ALP水平降低,E2水平升高。上述指标组间比较P均<0.05。②杜仲组、黄芪组、配伍组、雌激素组、模型组、假手术组股骨扭力分别为(9.70±2.10)、(9.67±1.30)、(10.32±2.37)、(10.69±2.40)、(8.54±1.23)、(12.63±4.95)N/g,假手术组、配伍组、雌激素组均高于模型组(P均<0.05)。③与假手术组比较,模型组骨钙、骨磷含量降低,骨氯含量升高;雌激素组骨钙含量降低,骨磷、骨氯含量升高;杜仲组、黄芪组、配伍组骨氯含量升高。与模型组比较,杜仲组、黄芪组、配伍组骨钙、骨磷含量升高,骨氯含量降低;雌激素组骨磷含量升高,骨氯含量降低。与配伍组比较,杜仲组、黄芪组骨钙、骨磷含量降低,骨氯含量升高;雌激素组骨钙含量降低,骨氯含量升高。上述指标组间比较P均<0.05。结论杜仲配伍黄芪对雌性去势大鼠骨质疏松具有正向调节作用,提高股骨抗外力,抑制骨钙、骨磷丢失,且效果优于杜仲和黄芪单药。
骨质疏松;杜仲;黄芪;去势;糖皮质激素;大鼠
绝经后骨质疏松(PMO)是原发性骨质疏松症的一种[1]。随着我国人口老龄化程度逐渐严重,PMO发病率逐年升高[2]。目前临床治疗骨质疏松主要以单一靶点化学药物为主,但效果均不理想[3,4]。临床实践证实,中药可对骨质疏松发挥整体治疗作用,且不良反应相对轻微,临床疗效确切[5],但关于杜仲配伍黄芪治疗PMO的研究较少。2015年1月~2016年12月,我们观察了杜仲配伍黄芪对雌性大鼠去势后骨质疏松的影响。现报告如下。
1 材料与方法
1.1 材料 动物:8月龄雌性SD大鼠100只,体质量250~280 g,购自长沙市天勤生物技术有限公司[动物合格证号:scxk(湘)2014-0010,清洁级]。大鼠标准饲料喂养于遵义医学院实验室,自由进食及饮水。实验室生物安全防护水平BSL-1级,自然光照,温度18~22 ℃,相对湿度50%~70%。主要药物:杜仲,珠海万宝中药饮片有限公司,批号161001;黄芪,广东汇群中药饮片股份有限公司,批号20160901;地塞米松磷酸钠注射液,贵州天地药业有限责任公司,国药准字号H52020477,批号140328,规格:1 mL/5 mg;尼尔雌醇片,湖南正清制药集团股份有限公司,国药准字号H19983206,批号131216,规格:5 mg。主要试剂盒:钙、磷、碱性磷酸酶(ALP)试剂盒,南京建成生物技术公司;雌二醇(E2)、骨钙素(BGP)放射免疫试剂盒,北京原子高科股份有限公司。主要仪器:小动物骨骼强度测定仪,上海软隆科技发展有限公司,型号:BW-YLS-16A;X-射线能谱仪,美国伊达克斯有限公司。
1.2 实验方法
1.2.1 去势雌性大鼠制备 将90只大鼠适应性喂养7天,给予水合氯醛(220 mg/kg)麻醉。麻醉后趴位固定,在大鼠腰部肾区偏下中间位置皮肤剪口2~3 cm,钝性剥离至腹腔,用镊子夹出子宫后结扎,摘除卵巢,再将子宫送回腹腔,缝合。术后肌注青霉素40万U/(kg·d),连续给药3天。自术后7天开始连续5天行阴道脱落细胞涂片检查,若涂片未发现角化上皮细胞,提示去势大鼠造模成功。将未成功去势或造模过程中死亡大鼠剔除本实验。优选50只造模成功大鼠进行后续研究。
1.2.2 动物分组处理 将50只去势大鼠随机分为五组,分别为杜仲组、黄芪组、杜仲与黄芪配伍组(配伍组)、雌激素组及模型组,每组10只。另取10只大鼠同法手术但不去势(即不摘除卵巢)作为假手术组。杜仲组、黄芪组、配伍组分别灌胃给予杜仲水煎液(杜仲5.4 g/kg)、黄芪水煎液(黄芪5.4 g/kg)及杜仲联合黄芪水煎液(杜仲2.7 g/kg、黄芪2.7 g/kg);雌激素组给予尼尔雌醇(0.18 mg/kg)灌胃;模型组、假手术组给予等量蒸馏水灌胃。各组均于术后第7天开始给药,1次/d,连续给药12周。除假手术组外,其余各组在给药期间肌注地塞米松磷酸钠注射液,每周2次(周一、四);假手术组注射等量生理盐水。
1.3 相关指标观察 ①血清钙、磷、ALP、E2与BGP:给药结束后以腹腔注射水合氯醛(3.5%,10 mL/kg)麻醉大鼠,颈外静脉采血,3 000 r/min离心15 min,获得血清。采用全自动生化仪检测血清钙、磷、ALP,采用放射免疫法检测血清E2、BGP,所有检测严格参照试剂盒说明进行操作。②股骨扭力:将完成采血的大鼠脱颈处死,解剖获得左右两侧股骨(将股骨上附着的肌肉与结缔组织完全剔除),采用小动物骨骼强度测定仪检测股骨扭力[6]。③骨灰钙、磷、氯:完成扭力检测后收集残骨,以800 ℃进行灰化处理,采用X-射线能谱仪检测骨钙、磷、氯含量。
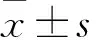
2 结果
2.1 各组血清钙、磷、ALP、E2与BGP水平比较 与假手术组比较,其他组血清E2水平均降低,ALP水平均升高;模型组血清钙、磷水平降低,BGP水平升高(P均<0.05)。与模型组比较,杜仲组、黄芪组、配伍组、雌激素组血清钙、磷、E2水平升高,ALP、BGP水平降低(P均<0.05)。与配伍组比较,杜仲组、黄芪组血清钙、磷、E2水平降低,ALP、BGP水平升高;雌激素组血清ALP水平降低,E2水平升高(P<0.05)。见表1。
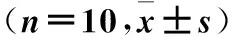
表1 各组血清钙、磷、ALP、E2与BGP水平比较
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与配伍组比较,▲P<0.05。
2.2 各组股骨扭力比较 杜仲组、黄芪组、配伍组、雌激素组、模型组、假手术组股骨扭力分别为(9.70±2.10)、(9.67±1.30)、(10.32±2.37)、(10.69±2.40)、(8.54±1.23)、(12.63±4.95)N/g,假手术组、配伍组、雌激素组均高于模型组(P均<0.05)。
2.3 各组骨钙、磷、氯含量比较 与假手术组比较,模型组骨钙、骨磷含量降低,骨氯含量升高;雌激素组骨钙含量降低,骨磷、骨氯含量升高;杜仲组、黄芪组、配伍组骨氯含量升高。与模型组比较,杜仲组、黄芪组、配伍组骨钙、骨磷含量升高,骨氯含量降低;雌激素组骨磷含量升高,骨氯含量降低。与配伍组比较,杜仲组、黄芪组骨钙、骨磷含量降低,骨氯含量升高;雌激素组骨钙含量降低,骨氯含量升高。上述指标组间比较P均<0.05。见表2。
3 讨论
现代中医理论根据PMO的某些临床症状,如易发骨折、腰背或全身多处疼痛、驼背等,将其归属于“骨痿”“骨枯”“骨极”“骨痹”等范畴[7]。祖国医学认为,肾与骨的关系非常密切,早在《皇帝内经》中已有大量而明确的论述。肾是先天之本,主骨生髓,骨的生长、发育、衰弱与肾精盛衰密切相关。女性在绝经之后,肾精亏虚,骨髓生化乏源,致骨骼脆弱。脾为后天之本,主百骸。先天之精有赖于后天脾胃运化水谷精微的不断充养,若脾胃虚弱,运化乏力,先天之精无以充养,则精亏髓空,百骸痿废。因此,本病的病因当首责于肾亏,其次为脾虚。杜仲性味甘温,入肝肾二经,有补肝肾、强筋骨之功,可用于治疗各种腰痛,是防治骨质疏松症的一味良药[8]。黄芪味甘,性微温,归肝、脾、肺、肾经,是临床上常用的补益药,在治疗骨质疏松的方药中频繁应用。由此可见,杜仲与黄芪的中药药理切中PMO病机。当代医学证实,杜仲在促进成骨样细胞以及成骨细胞增殖方面均具有明确作用[9~12]。近年研究发现,黄芪在体外试验中可抑制破骨细胞的骨吸收,并通过有效防止大鼠去势后骨量丢失而发挥防治PMO作用[13]。
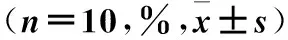
表2 各组骨钙、磷、氯含量比较
注:与假手术组比较,*P<0.01;与模型组比较,#P<0.05;与配伍组比较,▲P<0.05。
将去卵巢大鼠作为临床研究骨质疏松症的首推动物模型同时获得了WHO与美国食品药品管理局的认可[14]。大鼠在去除卵巢后其体内雌激素水平快速降低,与此同时对破骨细胞的抑制作用相应减弱,骨吸收呈亢进状态。在此种情况下,代偿性骨形成将会增强,继而表现为高转换状态;但实际情况却是骨形成仍不及骨吸收,整个骨代谢处于失衡状态,总体骨量及骨强度较正常水平减少或下降,这与妇女绝经后的骨丢失状态大体上一致。外源性糖皮质激素所致骨质疏松是一种发病率仅次于PMO的骨质疏松类型,主要发生于长期使用糖皮质激素治疗患者,长期使用糖皮质激素能抑制成骨细胞活性,并促进破骨细胞活化,进而导致骨质疏松。外源性糖皮质激素所致的骨质疏松是当前最常见的药源性骨质疏松造模方法[15]。本研究通过去势及糖皮质激素诱导建立的骨质疏松雌性大鼠模型既符合国际骨质疏松建模习惯,也接近临床PMO患者的实际情况。
PMO的形成是一个相对漫长的过程,有效的骨活性药物临床应用3~4年也未必能显示出显著的治疗效果,在短时间内很难看到直观作用[16]。因某些血清生化指标可在一定程度上反映骨代谢的实际水平,故可将其作为评价药物治疗效果的主要参考依据。机体正常的骨代谢调节主要包括三个方面,分别为肠道的吸收与排泌、肾脏的滤过与重吸收以及骨骼的矿化与再吸收。在上述过程中,血液中钙、磷含量将直接影响骨的钙化及溶解[17]。本研究结果显示,与模型组比较,各组血钙与血磷均有不同程度升高,且配伍组效果强于单药,提示杜仲配伍黄芪可提高血钙、磷浓度,促进钙、磷沉积,进而增强机体内成骨细胞增殖活动。动物实验与临床研究均表明,女性在绝经后其机体雌激素水平降低是导致骨质疏松的主要原因。E2作为调节骨代谢的重要雌激素,在绝经后其水平迅速降低,引起骨转换加快。BGP又称骨Gla蛋白,是由49个氨基酸残基组成的直链多肽,属非骨胶原蛋白的一种。血BGP来源于成骨性细胞谱系,主要由非增殖期成骨细胞分泌入血,BGP含有维生素K依赖性γ-轻基骨氨酸,具有结合钙的特性。因此认为BGP可能参与了骨矿化调节。骨转换率增加时血BGP升高,BGP是反映骨形成的特异指标。本研究结果显示,模型组血清E2水平降低,BGP水平升高。当卵巢被摘除后,雌性大鼠体内的雌激素严重不足,继而导致对破骨细胞的抑制作用显著减弱,骨吸收亢进导致代偿性骨形成增强,最终呈现出骨的高转换状态。在骨吸收大于骨形成的情况下,骨代谢平衡遭到破坏,继而导致骨丢失,诱导骨高转换型骨质疏松的发生。本研究结果显示,去势大鼠在接受杜仲配伍黄芪的药物处理后,其体内E2含量明显增加,BGP含量降低,提示杜仲与黄芪配伍对骨质疏松有明显的正向调节作用,其具体作用机制可能是两药可直接提高去势大鼠的雌激素水平或发挥类雌激素作用。ALP由成骨细胞产生,其活性水平直接反映成骨细胞活性。成骨活跃时ALP水平升高,一部分直接参与骨钙化;另一部分释放入血,使血中酶活性增强。因此,ALP被认为是评价机体成骨活性和骨组织钙化能力的具有较高特异性的指标[18]。本实验中去势大鼠由于雌激素减少或缺乏使其对破骨细胞的抑制作用解除,骨吸收显著增加,随之骨形成增加,ALP活性增加,提示去势大鼠成骨细胞活跃、骨转换增强。在药物干预后代偿性反应相应减弱,ALP水平降低。
骨力学强度下降是PMO的本质特征,骨生物力学和骨钙、磷含量是衡量骨质量的重要指标,可以反映骨质疏松的程度,亦是预测骨折危险性的重要指标。另有研究表明,病骨中氯含量一般较正常骨高出两倍以上。本研究对实验大鼠的股骨生物力学扭力进行检测,同时检测骨灰中钙、磷、氯含量。结果显示,与假手术组比较,模型组骨钙、骨磷含量降低,骨氯含量升高;与模型组比较,杜仲组、黄芪组、配伍组骨钙、骨磷含量升高,骨氯含量降低。提示杜仲配伍黄芪可明显提高去势雌性大鼠股骨的抗外力性能,且能抑制骨钙、骨磷丢失。
综上所述,杜仲配伍黄芪对去势雌性大鼠骨质疏松可发挥明显的正向调节作用,提高股骨的抗外力性能,抑制骨钙、骨磷丢失,且效果优于杜仲和黄芪单药。
[1] 黎宗保.激素替代疗法联合阿仑膦酸钠治疗对绝经后骨质疏松症患者子宫内膜及骨代谢的影响[J].山东医药,2016,56(25):90-92.
[2] 钟秋生,韩临晓,陆向然,等.绝经后骨质疏松症证候规律研究[J].世界中西医结合杂志,2013,8(s1):30-32.
[3] 中华医学会骨质疏松和骨矿盐疾病分会.原发性骨质疏松症诊治指南(2011)[J].中华骨质疏松和骨矿盐疾病杂志,2011,4(1):2-17.
[4] 欧莉,张素宁,曾小红,等.黄芪配伍熟地对去卵巢骨质疏松症大鼠骨组织形态的影响[J].时珍国医国药,2013,24(5):1097-1098.
[5] 戴鹏,邓鸣涛,张立超,等.杜仲叶对去势骨质疏松大鼠骨代谢的影响[J].中国骨质疏松杂志,2012,18(12):1127-1130.
[6] 张敏,孙付军,虞慧娟,等.葛藤提取物对糖皮质激素骨质疏松模型大鼠的影响[J].中国骨质疏松杂志,2011,17(7):589-592.
[7] 谢雁鸣,宇文亚,董福慧,等.原发性骨质疏松症中医临床实践指南(摘录)[J].中华中医药杂志,2012,27(7):1886-1890.
[8] 陆成龙,范鑫梅,郭艳幸.杜仲对骨形成作用的研究进展[J].中医药导报,2016,22(7):104-106.
[9] 王度,戴燚,范彦博,等.中药杜仲补骨脂对去势鼠成骨细胞增殖以及MMP3/OPM通路蛋白表达的作用[J].中国医院药学杂志,2016,36(8):620-624.
[10] 徐祥赫,刘钊,王虹,等.杜仲对MC3T3-E1成骨细胞及的影响值[J].天津医科大学学报,2013,19(3):203-205.
[11] 李三华,何志全,陈全利,等.杜仲总黄酮对成骨细胞增殖及Ⅰ型胶原蛋白表达的影响[J].西北药学杂志,2011,26(4):272-274.
[12] 张立超,邓呜涛,戴鹏,等.杜仲叶通过激活ERK及AKT磷酸化促进大鼠成骨细胞增殖的研究[J].中国骨质疏松杂志,2013,19(3):217-220.
[13] 潘静华,张海啸,李芳芳,等.黄芪对去卵巢大鼠骨组织的动态影响[J].中国中医基础医学杂志,2010,3(3):251-253.
[14] 朱克俭,黄敏,郭喜庚.藤黄健骨片对去势骨质疏松模型大鼠干预作用的实验研究[J].国医论坛,2015,30(6):57-60.
[15] 刘仁慧,康学,张伟华,等.女贞子配伍对GIOP大鼠骨代谢生化指标的影响研究[J].世界中医药,2013,8(12):1450-1453.
[16] 欧莉,曾小红,卫培峰.黄芪配伍熟地对去势大鼠骨矿含量及生物力学的影响[J].中国医院药学杂志,2013,33(16):1318-1321.
[17] 邓伟坤,李艳卿,李敏研.中药复骨方对糖皮质激素致骨质疏松骨折大鼠骨代谢及骨密度的影响[J].中国当代医药,2014,21(16):8-11.
[18] 姚荣成,谢宇,张悦,等.JGYS对大鼠去卵巢高转换型骨质疏松症的影响[J].昆明医科大学学报,2015,36(1):4-11.
贵州省科学技术基金资助项目(黔科合LH字[2014]7580号)。
10.3969/j.issn.1002-266X.2017.48.009
R681.1
A
1002-266X(2017)48-0031-04
2017-04-09)

