HELQ对骨肉瘤细胞增殖、侵袭、迁移的影响及机制
钟俊桥,周云飞,刘家明,刘东宁,周扬,刘志礼
(1井冈山大学附属医院,江西吉安343000;2南昌大学第一附属医院;3深圳市南山区人民医院)
HELQ对骨肉瘤细胞增殖、侵袭、迁移的影响及机制
钟俊桥1,周云飞2,刘家明2,刘东宁3,周扬2,刘志礼2
(1井冈山大学附属医院,江西吉安343000;2南昌大学第一附属医院;3深圳市南山区人民医院)
目的探讨POLQ样蛋白解旋酶(HELQ)对骨肉瘤细胞增殖、侵袭、迁移的影响及作用机制。方法将体外培养的人源骨肉瘤细胞系U2-OS、143B随机分为Lv-HELQ组、NC组、Lv-shHELQ组,分别转染Lv-HELQ、Lv-Negative、Lv-shHELQ慢病毒载体。转染48 h时,采用Western blotting法检测HELQ蛋白表达,结果显示两种细胞Lv-HELQ组HELQ蛋白相对表达量均高于NC组,Lv-shHELQ组均低于NC组,组间比较P均<0.05,提示HELQ转染成功。三组(两种细胞)转染48 h时,采用CCK8法检测细胞增殖情况(光密度值),采用Wound healing法检测细胞迁移率,采用Transwell invasion法检测细胞穿膜细胞数(侵袭能力),采用彗星实验检测彗星尾部DNA百分比。结果两种细胞Lv-HELQ组光密度值均高于NC组,Lv-shHELQ组光密度值均低于NC组,组间比较P<0.05或<0.01。两种细胞Lv-HELQ组细胞迁移率、穿膜细胞数及均彗星尾部DNA百分比均低于NC组,Lv-shHELQ组均高于NC组,组间比较P均<0.05。结论HELQ可抑制人骨肉瘤细胞增殖、侵袭、转移,修复DNA损伤可能是其作用机制。
骨肉瘤;POLQ样蛋白解旋酶;人骨肉瘤细胞;细胞增殖;细胞侵袭;细胞迁移;DNA损伤
骨肉瘤的发生、发展是一个多步骤、多基因参与的复杂序贯过程。DNA损伤修复基因失活是其发生的重要原因之一[1,2]。POLQ样蛋白解旋酶(HELQ)是近年发现的一种多功能DNA解螺旋酶,可催化双链DNA沿3′-5′方向解螺旋,在维持基因组稳定性、修复DNA损伤中发挥重要作用[3]。2014年3月~2015年9月,本研究观察HELQ对骨肉瘤细胞增殖、侵袭、迁移及DNA损伤的影响,旨在为进一步明确HELQ在骨肉瘤发生、发展中的作用及分子机制奠定基础。
1 材料与方法
1.1 材料 人源骨肉瘤细胞系U2-OS、143B购于上海中科院细胞库。慢病毒载体Lv-HELQ、Lv-Negative、Lv-shHELQ由武汉英琪公司设计并构建。RPMI 1640培养基、DMEM高糖培养基、FBS购于美国Gibco公司,Transwell侵袭小室(8.0 μm孔径PC膜)购于美国Corning公司,基质胶购于美国BD公司,Western blotting上样蛋白Marker和NC膜购于Millipore公司,鼠抗人HELQ一抗购于美国Santa Cruz公司,二抗购于北京天根生化有限公司。
1.2 细胞培养及转染 U2-OS、143B细胞分别以1×105个/孔密度接种于6孔板,用含10% FBS的DMEM 1640培养基于37 ℃、5% CO2、饱和湿度环境中培养,培养18~24 h使细胞密度达2×105个/孔。将两种细胞分别随机分为Lv-HELQ组、NC组、Lv-shHELQ组,将原培养基用含6 μg/mL polybrene的2 mL新鲜培养基替换,分别加入Lv-HELQ、Lv-Negative、Lv-shHELQ慢病毒载体,37 ℃孵育48 h。收集各组细胞,采用Western blotting法检测HELQ蛋白表达。具体方法:RIPA裂解细胞并提取总蛋白,BCA法蛋白定量;10% SDS-PAGE凝胶电泳分离蛋白,将分离的蛋白转移至PVDF膜,5%脱脂奶粉封闭1 h;加入HELQ一抗(1∶500),室温孵育过夜;TBST洗膜3次,加入羊抗鼠二抗(1∶3 000)室温孵育2 h。以GAPDH为内参。用Image J 软件对条带灰度值进行分析,重复6 次实验。结果显示,U2-OS细胞Lv-shHELQ组、NC组、Lv-HELQ组HELQ蛋白相对表达量分别为(0.040 0±0.007 3)、(0.084 7±0.002 9)、(0.180 4±0.011 7),143B细胞分别为(0.468 9±0.002 9)、(0.647 2±0.038 2)、(0.764 9±0.033 3);两种细胞Lv-HELQ组HELQ蛋白相对表达量均高于NC组,Lv-shHELQ组均低于NC组,组间比较P均<0.05,见图1。提示HELQ转染成功。
1.3 细胞增殖能力检测 采用CCK-8法。分别将转染48 h的各组U2-OS、143B细胞按4×103个/孔接种于96孔板,第2天贴壁后每孔加入10% CCK8溶液100 μL,37 ℃、5% CO2条件下培养2 h,空白孔调零,读取各孔光密度(OD)值。

图1 人骨肉瘤细胞系143B、U2-OS中HELQ蛋白表达电泳图
1.4 细胞迁移能力检测 采用Wound healing法。将转染48 h的各组U2-OS、143B细胞调整密度为5×105个/mL接种于6孔板,待形成单层贴壁细胞,用10 μL枪头在单层细胞表面划一直线,PBS漂洗2次去除划落细胞;分别加入无血清RPMI 1640及DMEM培养液继续培养24 h,倒置显微镜下观察划痕中细胞迁移情况并拍照。Image J软件测量迁徙距离,计算细胞迁移率。
1.5 细胞侵袭能力检测 采用Transwell invasion法。将转染48 h的各组U2-OS、143B细胞消化,用含10 g/L FBS的无血清培养基重悬,调整细胞密度为1×105个/mL,分别取150 μL细胞悬液接种于小室内;将小室放入含10% FBS的培养液(600 μL/孔)中继续培养 24 h。取出小室,吸弃上室液体,PBS漂洗2次,95%乙醇固定10 min,用棉签擦净小室膜上侧未迁移的细胞;4 g/L结晶紫染色20 min,PBS漂洗2次。倒置显微镜下随机读取10个视野,观察细胞穿膜情况并拍照,Image J软件计数穿膜细胞数。
1.6 细胞DNA损伤检测 采用彗星实验。将0.6%的正常熔点琼脂糖(NMPA,PBS配制)于微波炉中加热融化,浸泡磨砂玻片,用吸水纸将玻片滑面及四周吸干,自然晾干备用。取细胞悬液10 μL,向其中加入70 μL 37 ℃的0.7%低熔点琼脂糖(LMPA,PBS配制),混匀后迅速滴于37 ℃预热的玻片上,立即盖上盖玻片,4 ℃固化10 min。轻轻取下盖玻片,将玻片浸于新鲜配制并预冷的细胞裂解液中,4 ℃避光裂解1 h。从裂解液中取出载玻片,用PBS浸泡玻片。用纸巾吸去玻片上残留的液体,置于水平电泳槽中,加新鲜配制的碱性电泳缓冲液至高于玻片表面3 mm以上,避光解旋30 min。电压25 V,调整液面高度使电流达到300 mA,电泳25 min。电泳完毕取出玻片,PBS浸泡以中和强碱。用纸巾吸去玻片上残留的液体,滴加20 μg/mL溴化乙锭(EB)20 μL,盖上盖玻片,采用荧光显微镜在515~560 mm波长激发光下观察核DNA和迁移DNA(即彗星尾)。每个样本随机选择100个细胞,Cometscore Version1.5软件分析彗星尾部DNA百分比。
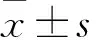
2 结果
2.1 各组细胞增殖能力比较 U2-OS细胞Lv-HELQ组、NC组、Lv-shHELQ组OD值分别为0.730±0.017、0.419±0.025、0.341±0.022,143B细胞分别为0.868±0.045、0.585±0.019、0.441±0.019,两种细胞Lv-HELQ组OD值均高于NC组、Lv-shHELQ组OD值均低于NC组,组间比较P<0.05或<0.01。
2.2 各组细胞迁移能力比较 U2-OS细胞Lv-HELQ组、NC组、Lv-shHELQ组迁移率分别为(51.2±10.6)%、(65.7±16.4)%、(81.4±14.3)%,143B细胞分别为(60.6±10.7)%、(70.5±16.3)%、(89.2±7.1)%;两种细胞Lv-HELQ组迁移率均低于NC组,Lv-shHELQ组均高于NC组,组间比较P均<0.05。
2.3 各组细胞侵袭能力比较 U2-OS细胞Lv-HELQ组、NC组、Lv-shHELQ组穿膜细胞数分别为(209.2±38.6)、(465.4±107.8)、(642.3±125.6)个,143B细胞分别为(185.3±40.4)、(185.3±40.4)、(185.3±40.4)个;两种细胞Lv-HELQ组穿膜细胞数均低于NC组,Lv-shHELQ组均高于NC组,组间比较P均<0.05。
2.4 各组细胞DNA损伤情况比较 U2-OS细胞Lv-HELQ组、NC组、Lv-shHELQ组彗星尾部DNA百分比分别为(45.809 8±15.709 6)%、(64.424 1±16.386 6)%、(86.163 2±11.385 6)%,143B细胞分别为(54.161 0±14.446 9)%、(71.098 9±17.496 7)%、(83.596 1±12.784 2)%;两种细胞Lv-HELQ组彗星尾部DNA百分比均低于NC组,Lv-shHELQ组均高于NC组,组间比较P均<0.05。
3 讨论
人体细胞每时每刻都在发生DNA损伤,这些损伤可来自内源性因素,如DNA复制过程中的失误和代谢副产品[4],亦可来自环境中的紫外照射、电离辐射、化学物质等众多外源性因素[5]。真核细胞中存在着一系列复杂的DNA损伤反应信号传导系统,具有保护基因组完整性的功能。DNA修复是机体对DNA损伤的主要生物学反应之一,可以促使DNA中已经损伤的、不合适的或错配的碱基恢复本来状态[6]。由此可见,DNA损伤修复和DNA信号传导系统之间形成了一个联系密切且相互影响的复杂网络,使细胞作为一个整体对DNA损伤做出反应。如果DNA损伤得到了正确修复,细胞功能就能得到恢复;如果修复过程中出现缺失、插入等,导致异常碱基累积,则可能使细胞无限制地进入细胞周期,从而引起癌症的发生。在许多人类肿瘤早期病变临床样本(如膀胱癌、乳腺癌、肺癌、结肠癌)中可以发现DNA损伤。
HELQ可帮助修复细胞增殖时DNA复制过程中所发生的DNA损伤。如果HELQ基因缺失或发生突变,DNA损伤不能得到及时正确的修复,DNA错误增加,则增加癌症发生的机会。研究发现,HELQ蛋白与卵巢肿瘤、垂体瘤中生殖细胞的缺失有关[7];HELQ家族成员与DNA股间交联(ICL)等DNA复制障碍的修复相关[8];敲除HELQ基因的小鼠表现出生殖能力低下、生殖细胞缺失、对ICL敏感以及致癌倾向[9];HELQ位点内或其位点附近的单核苷酸多样性可增加众多肿瘤的发病风险,如上消化道肿瘤、卵巢肿瘤及头颈部肿瘤等[10~13]。但HELQ与骨肉瘤发生、发展的关系尚不明确。
本研究结果显示,通过慢病毒转染上调骨肉瘤细胞中HELQ表达可以抑制骨肉瘤细胞增殖、侵袭、迁移,下调HELQ表达可促进骨肉瘤细胞增殖、侵袭、迁移。彗星实验结果显示,上调HELQ表达可降低骨肉瘤细胞中DNA损伤水平,下调HELQ表达水平可提高骨肉瘤细胞中DNA损伤水平。提示HELQ可能通过促进DNA损伤修复抑制骨肉瘤细胞的恶性表型。有研究报道,DNA解螺旋酶在肿瘤细胞和肿瘤组织中高表达有助于抵抗放疗及化疗所引起的DNA损伤[14,15]。但HELQ参与骨肉瘤发生、发展的具体作用及作用机制,还需进一步探讨。此外,人骨肉瘤的发病机制较为复杂,HELQ并不是惟一一个调控骨肉瘤恶性表型及其发生、发展的DNA修复因子[16]。HELQ与其他骨肉瘤恶性表型相关的DNA修复信号通路之间的相互作用还需要更多的实验进行验证。
综上所述,HELQ可抑制人骨肉瘤细胞增殖、侵袭、转移,修复DNA损伤可能是其作用机制。
[1] Broustas CG, Lieberman HB. DNA damage response genes and the development of cancer metastasis[J]. Radiat Res, 2014,181(2):111-130.
[2] Roos WP, Thomas AD, Kaina B. DNA damage and the balance between survival and death in cancer biology[J]. Nat Rev Cancer, 2016,16(1):20-33.
[3] Takata K, Reh S, Tomida J, et al. Human DNA helicase HELQ participates in DNA interstrand crosslink tolerance with ATR and RAD51 paralogs[J]. Nat Commun, 2013,4(4):2338.
[4] Jackson SP, Bartek J. The DNA-damage response in human biology and disease[J]. Nature, 2009,461(7267):1071-1078.
[5] Ciccia A, Elledge SJ. The DNA damage response: making it safe to play with knives[J]. Mol Cell, 2010,40(2):179-204.
[6] Friedberg EC. How nucleotide excision repair protects against cancer[J]. Nat Rev Cancer, 2001,1(1):22-33.
[7] Adelman CA, Lolo RL, Birkbak NJ, et al. HELQ promotes RAD51 paralogue-dependent repair to avert germ cell loss and tumorigenesis[J]. Nature, 2013,502(7471):381-384.
[8] Tafel AA, Wu L, McHugh PJ. Human HEL308 localizes to damaged replication forks and unwinds lagging strand structures[J]. J Biol Chem, 2011,286(18):15832-15840.
[9] Luebben SW, Kawabata T, Akre MK, et al. Helq acts in parallel to Fancc to suppress replication-associated genome instability[J]. Nucleic Acids Res, 2013,41(22):10283-10297.
[10] Li WQ, Hu N, Hyland PL, et al. Genetic variants in DNA repair pathway genes and risk of esophageal squamous cell carcinoma and gastric adenocarcinoma in a Chinese population[J]. Carcinogenesis, 2013,34(7):1536-1542.
[11] Gao Y, He Y, Xu J, et al. Genetic variants at 4q21, 4q23 and12q24 are associated with esophageal squamous cell carcinoma risk in a Chinese population[J]. Hum Genet, 2013,132(6):649-656.
[12] Liang C, Marsit CJ, Houseman EA, et al. Gene-environment interactions of novel variants associated with head and neck cancer[J]. Head Neck, 2012,34(8):1111-1118.
[13] McKay JD, Truong T, Gaborieau V, et al. A genome-wide association study of upper aerodigestive tract cancers conducted within the INHANCE consortium[J]. PLoS Genet, 2011,7(3):e1001333.
[14] Brosh RM. DNA helicases involved in DNA repair and their roles in cancer[J]. Nat Rev Cancer, 2013,13(8):542-558.
[15] Hong L, Li X, Jin H, et al. Up-regulation of tumor suppressor genes might promote the malignant phenotype of cancer cells[J]. Med Hypotheses, 2007,69(6):1379.
[16] Postel-Vinay S, Vanhecke E, Olaussen KA, et al. The potential of exploiting DNA-repair defects for optimizing lung cancer treatment[J]. Nat Rev Clin Oncol, 2012,9(3):144-155.
EffectsofHELQonproliferation,invasion,andmigrationofosteosarcomacells
ZHONGJunqiao1,ZHOUYunfei,LIUJiaming,LIUDongning,ZHOUYang,LIUZhili
(1TheAffiliatedHospitalofJinggangshanUniversity,Ji'an343000,China)
ObjectiveTo investigate the effects and mechanism of HELQ (helicase, POLQ-like) on the proliferation, invasion, and migration of osteosarcoma cells.MethodsThe human osteosarcoma cell lines (U2-OS and 143B) were transfected with Lv-HELQ, Lv-Negative, Lv-shHELQ, respectively, and were divided into three groups: Lv-HELQ group, NC group, and Lv-shHELQ group. The expression of HELQ protein at 48 h was detected by Western blotting. The results showed that the expression of HELQ in these two cell lines of the Lv-HELQ group was significantly higher, while the expression of HELQ in these two cell lines of the Lv-shHELQ group was significantly lower than that in the control group (allP<0.05), which indicated that the transfection was successful. At 48 h after transfection, the proliferation, migration, and invasion abilities of these two cell lines, and DNA damage levels were investigated by CCK8, Wound healing, Transwell invasion, and comet assay, respectively.ResultsThe OD values of these two cell lines were significantly higher in the Lv-HELQ group but significantly lower in the Lv-shHELQ group as compared with those of the NC group (P<0.05 orP<0.01). The migration rate, transmembrane cells, and percentage of DNA in tail DNA of these two cell lines were significantly lower in the Lv-HELQ group but significantly higher in the Lv-shHELQ group as compared with those of the NC group (allP<0.05).ConclusionHELQ can inhibit the proliferation, invasive, and migration of osteosarcoma cells by repairing the DNA damage.
osteosarcoma; helicase, POLQ-like (HELQ); human osteosarcoma cells; cell proliferation; cell invasion; cell migration; DNA damage
钟俊桥(1976-),男,副主任医师,研究方向为骨肿瘤转移及其机制。E-mail: 11363239@qq.com
刘志礼(1973-),男,主任医师,研究方向为骨肿瘤转移及其机制。E-mail: zgm7977@163.com
10.3969/j.issn.1002-266X.2017.48.005
R738.1
A
1002-266X(2017)48-0015-04
2017-08-02)

