口腔鳞状细胞癌组织miRNA-222表达及其意义
许云,高彤彤
(1南昌市中西医结合医院,南昌330003;2江苏开放大学)
口腔鳞状细胞癌组织miRNA-222表达及其意义
许云1,高彤彤2
(1南昌市中西医结合医院,南昌330003;2江苏开放大学)
目的探讨口腔鳞状细胞癌组织中微小RNA-222(miRNA-222)表达变化及其临床意义。方法收集86例口腔鳞状细胞癌患者的肿瘤组织标本为观察组,30例口腔良性肿瘤患者的正常口腔黏膜组织标本为对照组。采用实时荧光定量PCR法检测两组miRNA-222表达,分析口鳞状细胞癌组织miRNA-222表达与患者临床病理参数的关系。结果观察组、对照组miRNA-222相对表达量分别为2.854±0.172、0.765±0.113,两组比较P<0.05。观察组肿瘤直径>3 cm、TNM分期Ⅲ+Ⅳ期、低分化、有淋巴结转移的口腔鳞状细胞癌组织中miRNA-222相对表达量分别高于肿瘤直径≤3 cm、TNM分期Ⅰ+Ⅱ期、中高分化、无淋巴结转移患者肿瘤组织(P均<0.05)。结论口腔鳞状细胞癌组织中miRNA-222表达升高,检测miRNA-222表达变化有助于口腔鳞状细胞癌的诊断和病情判断。
口腔鳞状细胞癌;微小RNA;微小RNA-222
口腔鳞状细胞癌约占口腔癌的80%,具有发病率高、侵袭性高、患者预后差等特点[1~3]。微小RNA(miRNA)是一类单链小分子非编码RNA,其可与靶基因序列通过互补配对的方式特异性结合,具有抑癌或促癌功能,与恶性肿瘤的发生、发展密切相关[4,5]。miRNA-222是位于X染色体上miRNA家族成员之一,研究证实其参与了胃癌、结直肠癌等恶性肿瘤的发病过程,并与患者预后密切相关[6,7]。目前,miRNA-222与口腔鳞状细胞癌的关系尚不明确。本研究观察了口腔鳞状细胞癌组织中miRNA-222表达变化,并分析其与口腔鳞状细胞癌患者临床病理参数的关系。
1 资料与方法
1.1 临床资料 收集2016年8月~2017年5月南昌市中西医结合医院收治的86例口腔鳞状细胞癌患者的肿瘤组织标本(观察组)。纳入标准:①手术切除并经病理检查证实为原发性口腔鳞状细胞癌;②术前未接受过任何放、化疗,也未接受过激素治疗;③肿瘤原发灶保存良好。排除标准:①妊娠期及哺乳期女性;②心功能不全;③肝、肾功能障碍;④其他类型恶性肿瘤。患者男51例,女35例;年龄37~69(49.3±5.5)岁,其中<60岁56例,≥60岁30例;舌癌54例,颊癌32例;TNM临床分期Ⅰ+Ⅱ期39例,Ⅲ+Ⅳ期47例;中高分化33例,低分化53例;有淋巴结转移40例,无淋巴结转移46例。选取同期30例因良性肿瘤行手术切除患者的正常口腔黏膜组织为对照组,患者男19例、女11例,年龄38~69(48.0±5.9)岁。两组性别、年龄具有可比性。
1.2 miRNA-222表达检测 采用实时荧光定量PCR法。采用组织miRNA快速提取试剂盒(上海吉玛制药技术有限公司)提取两组标本的总RNA,提取过程严格按照试剂盒说明操作。采用紫外分光光度计对所得RNA浓度及纯度进行测定,A260/A280为1.8~2.1表明纯度较好。采用TaqMan MicroRNA反转录试剂盒(美国Life Technologies公司)合成cDNA。总反应体系为25 μL,包括2 μL总RNA,1 μL 2.5 U/μL Poly A Polymerase,1 μL RTase Mix,5 μL 5XPAP/RT buffer,最后加入ddH2O定容至25 μL。反应条件为37 ℃ 60 min,85 ℃ 5 min。将得到的cDNA产物置于-20 ℃环境中保存。miRNA-222引物上游序列为5′-CGCAGATCTTTTCT-TCCACAGA-3′,下游序列为5′-GGGGATCCTCTCAGGACACTGAAGC-3′,扩增片段长度为155 bp。内参为U6基因。U6引物上游序列为5′-CTCGCTTCGGAGCACA-3′,下游序列为5′-AAAAATATGGAACGCTTCACGAA-3′,扩增片段长度为96 bp。反应体系为20 μL,其中包括10 μL 2× All-in-One qPCR Mix,2 μL Universal Adaptor PCR Primer,2 μL All-in-One miRNA qPCR Primer,2 μL cDNA,4 μL ddH2O。反应条件为95 ℃ 10 s预变性,95 ℃ 3 s变性,80 ℃ 20 s退火,72 ℃ 20 s延伸,变性至延伸这个过程共计循环40次。采用2-ΔΔCt表示miRNA-222相对表达量。实验重复3次,结果取平均值。分析口腔鳞状细胞癌组织miRNA-222表达与患者临床病理参数的关系。
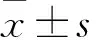
2 结果
观察组、对照组miRNA-222相对表达量分别为2.854±0.172、0.765±0.113,两组比较P<0.05。肿瘤直径>3 cm、TNM分期Ⅲ+Ⅳ期、低分化、有淋巴结转移的口腔鳞状细胞癌患者肿瘤组织miRNA-222相对表达量分别高于肿瘤直径≤3 cm、TNM分期Ⅰ+Ⅱ期、中高分化、无淋巴结转移患者肿瘤组织(P均<0.05)。见表1。

表1 口腔鳞状细胞癌组织miRNA-222表达量与患者临床病理参数的关系
3 讨论
口腔癌病情进展迅速,早期即可转移至区域淋巴结,晚期易发生远处转移,局部切除联合术后放、化疗为其主要治疗方法,但患者术后复发转移率较高,5年生存率仅60%[8,9]。
miRNA是一类调控基因表达的单链小分子非编码RNA,约为22个核苷酸,通过识别特定的mRNA并转录,可使靶mRNA降解,或者对其翻译过程产生抑制作用,在基因的表达过程中发挥调控功能[10]。研究表明,在肿瘤的发生、发展过程中,miRNA具有抑癌或促癌基因的作用,其异常表达可参与信号激活、细胞增殖和分化、血管形成和侵袭转移等生物学过程[11]。张竹青等[5]研究发现,miRNA-222通过介导转录后基因表达参与肝癌细胞的增殖、分化、凋亡、转移等过程。韩福新等[12]报道,miRNA-21、miRNA-221、miRNA-222在脑胶质瘤发病中发挥重要作用,可作为脑胶质瘤早期诊断和患者预后评估的重要指标。姜训圳等[13]发现,miRNA-21、miRNA-135b、miRNA-141过高表达参与了结肠癌的发病过程,并且与肿瘤分期、浸润深度、淋巴结转移密切相关。口腔鳞状细胞癌组织中也存在不同程度的miRNA异常表达,这些miRNA参与肿瘤的生长、浸润和转移过程。王远财等[2]研究证实,miRNA-149表达下调参与口腔鳞状细胞癌的发病过程,并且与肿瘤的病理分级、转移密切相关,可作为评估口腔鳞状细胞癌临床分期的肿瘤标志物。此外,Li 等[14]研究发现,miRNA-21在口腔鳞状细胞癌组织中表达上调,且与患者预后密切相关,miRNA-21表达越高,患者预后越差、术后5年生存率越低。
miRNA-222定位于染色体Xp11.3,作为促癌因子在肝细胞癌[15]、膀胱癌[16]等肿瘤组织中表达异常。本研究结果显示,观察组miRNA-222相对表达量高于对照组。提示miRNA-222表达上调可能参与口腔鳞状细胞癌的发生,可将其作为诊断口腔鳞状细胞癌的辅助指标。本研究发现,肿瘤直径>3 cm、TNM分期Ⅲ+Ⅳ期、低分化、有淋巴结转移的口腔鳞状癌细胞组织中miRNA-222相对表达量相对较高。miRNA-222表达水平越高,口腔鳞状细胞癌恶性程度越高,同时也越容易出现远处淋巴结转移,患者预后也越差。提示miRNA-222可作为评估口腔鳞状细胞癌病情的肿瘤标志物。
综上所述,miRNA-222在口腔鳞状细胞癌中表达上调。miRNA-222可能参与了口腔鳞状细胞癌的发生、发展过程。早期检测miRNA-222有助于口腔鳞状细胞癌的辅助诊断及病情评估。
[1] Ahn H, Yang JM, Kim H, et al. Clinicopathologic implications of the miR-197/PD-L1 axis in oral squamous cell carcinoma[J]. Oncotarget, 2017,8(39):66178-66194.
[2] 王远财,程国琼.miRNA-149在口腔鳞状细胞癌中的表达及其临床有意义[J].口腔医学研究,2014,30(5):458-460,464.
[3] 刘艳华.口腔鳞状细胞癌组织中细胞角蛋白19、乙酰肝素酶的表达及检测意义[J].标记免疫分析与临床,2016,23(3):291-293.
[4] Yu X, Zheng H, Chan MT, et al. MicroRNAs: new players in cataract[J]. Am J Transl Res, 2017,9(9):3896-3903.
[5] 张竹青,卢书明,王花丽,等.microRNA-222在肝细胞癌组织中的表达及意义[J].临床肝胆病杂志,2017,33(8):1502-1505.
[6] Fu Z, Qian F, Yang X, et al. Circulating miR-222 in plasma and its potential diagnostic and prognostic value in gastric cancer[J]. Med Oncol, 2014,31(9):164.
[7] Liu S, Sun X, Wang M, et al. A microRNA-221 and 222 mediated feedback loop maintains constitutive activation of NF-κB and STAT3 in colorectal cancer cells[J]. Gastroenterology, 2014,147(4):847-859.
[8] Pathiyil V, D′Cruz AM. Salivary lactate dehydrogenase as a prognostic marker in oral squamous cell carcinoma patients following surgical therapy[J]. J Exp Ther Oncol, 2017,11(2):133-137.
[9] Hema KN, Smitha T, Sheethal HS, et al. Epigenetics in oral squamous cell carcinoma[J]. J Oral Maxillofac Pathol, 2017,21(2):252-259.
[10] Han C, Seebacher NA, Hornicek FJ, et al. Regulation of microRNAs function by circular RNAs in human cancer[J]. Oncotarget, 2017,8(38):64622-64637.
[11] Chatterjee N, Rana S, Espinosa-Diez C, et al. MicroRNAs in cancer: challenges and opportunities in early detection, disease monitoring, and therapeutic agents[J]. Curr Pathobiol Rep, 2017,5(1):35-42.
[12] 韩福新,张蕊,马善波,等.miRNA-21、miR-221、miRNA-222与脑胶质瘤发生发展的相关性[J].神经损伤与功能重建,2017,12(2):175-177.
[13] 姜训圳,赵科,何向辉.miR-21、miRNA-135b、miRNA-141在结肠癌中的表达及其意义[J].中国普通外科杂志,2014,23(10):1367-1372.
[14] Li JS, Huang HZ, Sun LJ, et al. MiR-21 indicates poor prognosis in tongue squamous cell carcinomas as an apoptosis inhibitor[J]. Clin Cancer Res, 2009,15(12):3998-4008.
[15] Motawi TM, Sadik NA, Shaker OG, et al. Elevated serum microRNA-122/222 levels are potential diagnostic biomarkers in Egyptian patients with chronic hepatitis C but not hepatic cancer[J]. Tumour Biol, 2016,37(7):9865-9874.
[16] Cao Y, Yu SL, Wang Y, et al. MicroRNA-dependent regulation of PTEN after arsenic trioxide treatment in bladder cancer cell line T24[J]. Tumour Biol, 2011,32(1):179-188.
江西省卫计委科技计划项目(20167037)。
10.3969/j.issn.1002-266X.2017.48.030
R739.8
B
1002-266X(2017)48-0087-03
2017-09-22)

