趋化因子CXCL13对TNF-α诱导的人骨关节滑膜细胞RANKL表达的影响
金晟宇,任红革
(延边大学附属医院,吉林延吉133000)
趋化因子CXCL13对TNF-α诱导的人骨关节滑膜细胞RANKL表达的影响
金晟宇,任红革
(延边大学附属医院,吉林延吉133000)
目的探讨趋化因子CXCL13对TNF-α诱导的人骨关节滑膜细胞调控细胞核因子-κB受体活化因子配体(RANKL)表达的影响。方法①体外培养人骨关节滑膜细胞,并给予10 μg/mL TNF-α处理,分别在培养0、6、12、24 h时采用免疫荧光法检测CXCL13表达。②人滑膜细胞给予10 μg/mL TNF-α处理24 h,将培养液更换为含0、5、10、25 ng/mL CXCL13的培养液继续培养24 h,或将培养液更换为含25 ng/mL CXCL13的培养液分别作用0、1、3、6、24 h;以不加TNF-α及CXCL13处理的常规培养细胞作为对照细胞。收集各浓度、各时间点细胞,采用Western blotting法检测RANKL蛋白相对表达量。结果①TNF-α作用0、6、12、24 h时细胞CXCL13相对表达量(荧光强度)分别为0.907±0.350、0.823±0.730、0.710±0.660、0.653±0.850,组间比较P均<0.05。②对照细胞RANKL蛋白相对表达量为0.956±0.014,25 ng/mL CXCL13处理0、1、3、6、24 h时RANKL蛋白相对表达量分别为1.543±0.047、1.366±0.026、0.883±0.026、0.367±0.034、0.246±0.015;0、5、10、25 ng/mL CXCL13作用24 h时RANKL蛋白相对表达量分别为0.287±0.007、0.189±0.008、0.069±0.004、0.022±0.002;上述各组、各时间及各浓度细胞比较P均<0.05。结论趋化因子CXCL13能够在一定浓度和时间内抑制TNF-α诱导的人骨关节滑膜细胞RANKL蛋白表达。
骨关节炎;趋化因子CXCL13;肿瘤坏死因子α;细胞核因子-κB受体活化因子配体;人骨关节滑膜细胞
骨关节炎是一种由复杂病因导致的慢性退行性疾病,又称退行性骨关节炎,通常累及全身负重较大的关节,导致关节畸形,降低关节的使用寿命[1]。趋化因子CXCL13在骨关节炎滑膜组织低表达可能引起细胞因子分泌失衡,加重炎症反应[2]。调控细胞核因子-κB受体活化因子配体(RANKL)又称骨保护素配体,在破骨细胞分化、发育、激活中扮演关键角色[3]。有学者发现,在口腔鳞状细胞癌细胞中诱导CXCL13表达可上调RANKL水平[4]。TNF-α是诱导炎症发生的细胞因子,通过持续活化细胞核因子-κB(NF-κB)诱导炎症发生[5]。2015年10月~2016年10月我们进行本研究,探讨趋化因子CXCL13对TNF-α诱导的人骨关节滑膜细胞RANKL表达的影响。
1 材料与方法
1.1 材料 人骨关节滑膜细胞购于上海钰博生物科技有限公司。TNF-α、CXCL13(英国R&DSystems),Anti-CXCL13兔多克隆抗体(英国Abcam),Anti-RANKL兔多克隆抗体(美国Sigma-Aldrich),灵敏度化学发光检测试剂盒(北京康为世纪生物科技有限公司),TCS SP5Ⅱ型激光共聚焦显微镜(北京莱卡仪器有限公司),超高灵敏度化学发光ChemiDoc成像系统(美国伯乐BIO-RAD技术有限公司)。
1.2 细胞培养 将滑膜细胞培养于含10% FBS及抗生素的DMEM培养基中,于5% CO2、37 ℃条件下培养,0.25%胰酶消化传代,取生长状态良好的第3代细胞进行研究。
1.3 TNF-α诱导的滑膜细胞CXCL13表达检测 采用免疫荧光法。将细胞消化,调整密度为1.0×105个/mL接种于6孔板,分别加入含10 μg/mL TNF-α的培养基,于5% CO2、37 ℃条件下培养;分别在培养0、6、12、24 h时取出部分玻片,PSB清洗,多聚甲醛固定,Triton X-100处理15 min,加入小牛血清(BSA)封闭30 min;加入CXCL13一抗,4 ℃过夜;洗去一抗,加荧光二抗孵育5 min;用含DAPI抗荧光封片剂封片,荧光显微镜分析。
1.4 CXCL13对TNF-α诱导的滑膜细胞RANKL表达的影响 采用Western blotting法。将细胞消化,调整密度为1.0×105个/mL接种于6孔板,置于含10 μg/mL TNF-α培养液处理24 h,将培养液更换为含0、5、10、25 ng/mL CXCL13的培养液继续培养24 h,或将培养液更换为含25 ng/mL CXCL13的培养液分别作用0、1、3、6、24 h;收集各浓度、各时间点细胞,PBS洗涤,Bradford法进行蛋白定量;取30 μg蛋白与5×SDS加样缓冲液混合,95 ℃变性5 min;经10% SDS-聚丙烯酰胺凝胶电泳分离后转移到PVDF膜上,室温封闭2 h,加入相应一抗,4 ℃过夜;洗去一抗,加入辣根过氧化物酶偶联二抗,反应2 h;采用Image J测定各蛋白条带灰度值,以目的条带与内参(GAPDH)条带灰度值比值作为目的蛋白的相对表达量。以不加TNF-α及CXCL13处理的常规培养细胞作为对照细胞。
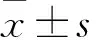
2 结果
2.1 TNF-α诱导对滑膜细胞CXCL13表达的影响 CXCL13主要定位于滑膜细胞的细胞核中,在显微镜下呈微弱的绿色荧光。在加入TNF-α刺激后,细胞质中的绿色荧光强度减弱,且随着TNF-α刺激时间延长荧光强度逐渐下调。TNF-α刺激0、6、12、24 h时细胞CXCL13相对表达量(荧光强度)分别为0.907±0.350、0.823±0.730、0.710±0.660、0.653±0.850,组间比较P均<0.05。
2.2 CXCL13对TNF-α诱导的滑膜细胞RANKL表达的影响 对照细胞RANKL蛋白相对表达量为0.956±0.014。25 ng/mL CXCL13处理0、1、3、6、24 h时RANKL蛋白相对表达量分别为1.543±0.047、1.366±0.026、0.883±0.026、0.367±0.034、0.246±0.015;0、5、10、25 ng/mL CXCL13作用24 h时RANKL蛋白相对表达量分别为0.287±0.007、0.189±0.008、0.069±0.004、0.022±0.002;上述各组各时间点、各浓度细胞间比较P均<0.05。见图1、2。
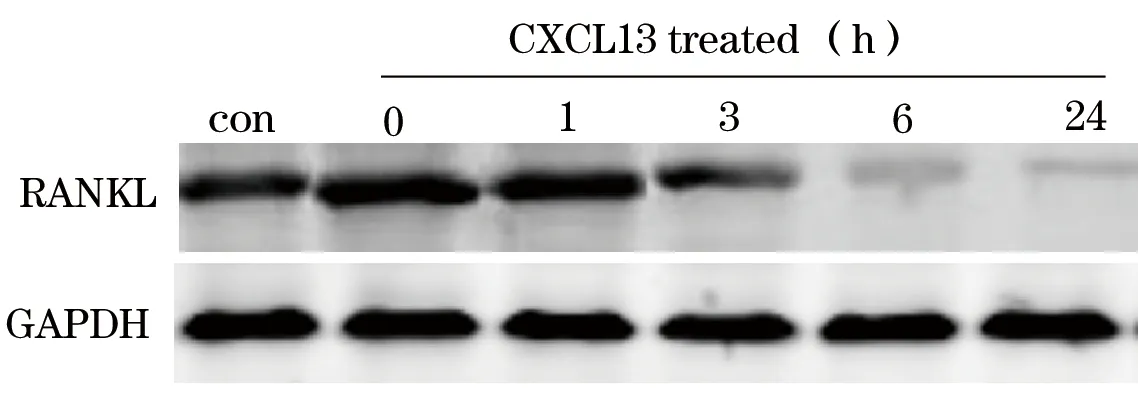
注:con指对照细胞;其余条带为TNF-α、CXCL13处理细胞。
图125ng/mLCXCL13作用0、1、3、6、24h时细胞RANKL表达电泳图
3 讨论
骨关节炎是一种以关节软骨退行性变和继发性骨质增生为特征的慢性关节疾病,其发生、发展是由多种细胞因子通过不同的作用机制相互作用、相互影响而形成的复杂过程。细胞因子在关节中结构和功能的改变可引发骨关节炎的病理变化,加重临床症状[6,7]。检测骨关节炎患者血液、关节液中各种因子的表达水平、分泌机制,可以为明确骨关节炎的发病机制、判断临床进展提供帮助。关节滑膜是覆盖在关节腔内的疏松结缔组织,具有清除吞噬、分泌制造滑液和调节关节滑液等作用[8]。越来越多的研究表明,滑膜炎症的出现是多种细胞因子异常分泌的结果,且滑膜炎可引起软骨结构异常,进一步加重临床症状。
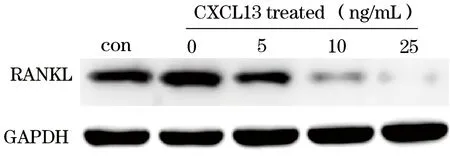
注:con指对照细胞;其余条带为TNF-α、CXCL13处理细胞。
图20、5、10、25ng/mLCXCL13作用24h时细胞RANKL表达电泳图
CXCL13又称B淋巴细胞趋化因子(BLC)或B细胞吸附因子1(BCA-1),对B淋巴细胞具有显著的吸附作用[9],属于趋化因子CXC亚族中的一种。CXCL13是由异位淋巴细胞生发中心的滤泡树突状细胞分泌,并不是由巨噬细胞及T细胞分泌聚集,在骨关节炎患者滑膜组织中CXCL13表达下降。这种CXCL13异常分泌造成B淋巴细胞在滤泡树突状细胞附近异常聚集,从而导致慢性骨关节炎的发生、发展[10]。有报道称,CXCL13可以促进骨关节炎患者成骨细胞分泌Ⅰ型胶原蛋白[11]。Ⅰ型胶原蛋白是关节软骨的重要组成部分,在构造及维持软骨组织框架过程中扮演重要角色,能够保护及修复关节软骨,预防各种原因引起的关节炎症。本研究结果显示,TNF-α处理的滑膜细胞中CXCL13表达明显低于对照组,与既往研究结果一致[2]。骨关节滑膜细胞中CXCL13过低表达,可能导致关节软骨组织结构破坏,进一步影响整个关节内部的细胞因子微环境,导致细胞因子分泌失衡,造成相关炎症的进一步发展。本研究进一步设计将趋化因子CXCL13作为诱导剂,人为提高细胞环境中CXCL13浓度,观察CXCL13对TNF-α诱导的细胞炎症模型进行处理,检测其是否可引起相关细胞因子表达变化发挥抑制骨关节炎症的作用。
RANKL又称骨保护素配体(OPGL),是TNF超家族成员之一,可以促进破骨细胞成熟,加强骨骼吸收。RANKL通过与破骨细胞前体细胞模表面调控细胞核因子-κB受体活化因子(RANK)结合,促使破骨细胞分化,进一步激活骨吸收活性。RANKL过度上调会导致骨骼改建,引起骨性疾病[12,13]。在口腔鳞状细胞癌骨浸润转移的研究中发现,CXCL13可以上调RANKL表达[13];对口腔鳞状细胞癌骨浸润的骨母细胞及骨髓基质细胞给予CXCL13激活剂c-Myc刺激,亦可以上调RANKL表达[14]。但本研究显示出不同结果,TNF-α诱导正常关节滑膜细胞建立的细胞炎症模型中RANKL表达上调,RANKL异常高表达导致关节滑膜中相应细胞因子微环境失衡,通过特异性细胞信号通路调控细胞分化,控制基因表达,进一步抑制破骨细胞分化、促进骨吸收,导致骨骼重建与吸收失去动态平衡。
本研究采用TNF-α建立细胞炎症模型后,应用趋化因子CXCL13对细胞进行处理,发现随着CXCL13作用时间延长,RANKL表达逐渐降低;随着CXCL13刺激浓度增加,RANKL表达量亦逐渐降低。上述结果提示,CXCL13对炎症模型中RANKL表达有明显的抑制作用。在对细胞给予浓度为25 ng/mL的CXCL13作用后,RANKL表达明显降低,我们考虑过高浓度的CXCL13可能引起某条信号通路关闭,造成表达失调。本研究结果与前期研究[12~14]结果不同,可能与以下原因有关:研究对象的细胞种类、细胞株、细胞分化阶段不同,其对外界刺激的反应能力也有所不同;在实验设计方面,既往实验大多针对CXCL13对某种细胞的单独作用,本研究是在TNF-α诱导建立炎症模型后利用CXCL13对模型进行刺激,探讨这几种因子之间可能存在相互影响,产生协同或拮抗作用。
综上所述,CXCL13可在一定浓度和时间内抑制TNF-α诱导的骨关节滑膜细胞RANKL蛋白表达,该作用呈一定的浓度和时间依赖性。
[1] Cross M, Smith E, Hoy D, et al. The global burden of hip and knee osteoarthritis: estimates from the global burden of disease 2010 study[J]. Ann Rheum Dis, 2014,73(7):1470-1476.
[2] 任红革,李振浩,李国振,等.趋化因子13在膝关节骨关节炎滑膜中的表达研究[J].中国修复重建外科杂志,2015(1):39-42.
[3] Kalantari N, Abroun S, Soleimani M, et al. Effect of the receptor activator of nuclear factor κB and RANK ligand on in vitro differentiation of cord blood CD133+hematopoietic stem cells to osteoclasts[J]. Cell J, 2016,18(3):322-331.
[4] Yuvaraj S, Griffin AC, Sundaram K, et al. A novel function of CXCL13 to stimulate RANK ligand expression in oral squamous cell carcinoma cells[J]. Mol Cancer Res, 2009,7(8):1399-1407.
[5] Ramberg P, Sekino S, Uzel NG, et al. Bacterial colonization during de novo plaque formation[J]. J Clin Periodontol, 2003,30(11):990-995.
[6] Söder S, Sesselmann S, Aigner T, et al. Tenosynovial giant cell tumour (pigmented villonodular synovitis-)-like changes in periprosthetic interface membranes[J]. Virchows Arch, 2015,468(2):231-238.
[7] Yang KC, Wu CC, Chen WY, et al. 1-Glutathione enhances antioxidant capacity of hyaluronic acid and modulates expression of pro-inflammatory cytokines in human fibroblast-like synoviocytes[J]. J Biomed Mater Resa, 2016,104(8):2071-2079.
[8] Montell E, Calamia V, Lopez-Armada M, et al. Mitochondria: a new chondroitin sulphate therapeutic target for osteoarthritis[J]. Osteoarthritis Cartilage, 2015,23(8):A162-A163.
[9] Zhou Y, Chen J, Yang G. Serum and synovial fluid levels of CCL18 are correlated with radiographic grading of knee osteoarthritis[J]. Med Sci Monit, 2015(21):840-844.
[10] Shi K, Hayashida K, Kaneko M, et al. Lymphoid chemokine B cell-attracting chemokine-1 (CXCL13) is expressed in germinal center of ectopic lymphoid follicles within the synovium of chronic arthritis patients[J]. J Immunol, 2001,166(1):650-655.
[11] Lisignoli G, Toneguzzi S, Piacentini A, et al. CXCL12 (SDF-1) and CXCL13 (BCA-1) chemokines significantly induce proliferation and collagen type Ⅰ expression in osteoblasts from osteoarthritis patients[J]. J Cell Physiol, 2006,206(1):78-85.
[12] Jin Z, Li X, Wan Y. Minireview: nuclear receptor regulation of osteoclast and bone remodeling[J]. Mol Endocrinol, 2015,29(2):172-86.
[13] Miyauchi Y, Ninomiya K, Miyamoto H, et al. The Blimp1-Bcl6 axis is critical to regulate osteoclast differentiation and bone homeostasis[J]. J Exp Med, 2010,207(4):751-762.
[14] Nhanchang CL, Romero R, Kusanovic JP, et al. A role for CXCL13 (BCA-1) in pregnancy and intra-amniotic infection/inflammation[J]. J Matern Fetal Neonatal Med, 2008,21(11):763-775.
[15] Palmas F, Fattuoni C, Noto A, et al. The choice of amniotic fluid in metabolomics for the monitoring of fetus health[J]. Expert Rev Mol Diagn, 2016,16(4):473-486.
[16] Sun J, Sun WJ, Li ZY, et al. Daidzein increases OPG/RANKL ratio and suppresses IL-6 in MG-63 osteoblast cells[J]. Int Immunopharmacol, 2016(40):32-40.
[17] Wang Y, Yang C, Xie WL, et al. Puerarin concurrently stimulates osteoprotegerin and inhibits receptor activator of NF-κB ligand (RANKL) and interleukin-6 production in human osteoblastic MG-63 cells[J]. Phytomedicine, 2014,21(8-9):1032-1036.
InfluenceofCXCL13onexpressionofRANKLinhumansynovialcellsinducedbyTNF-α
JINShengyu,RENHongge
(YanbianUniversityHospital,Yanji133000,China)
ObjectiveTo investigate the effect of CXCL13 on the expression of receptor activator of NF-κB ligand (RANKL) in human synovial cells induced by tumor necrosis factor-α (TNF-α).Methods① The human synovial cells were cultured in vitro and were treated with 10 g/mL TNF-α. At 0, 6, 12, and 24 h, we used immunofluorescence to detect the CXCL13 expression. ② The human synovial cells cultured in vitro were treated with 10 g/mL TNF-α for 24 h, after that, we replaced the culture fluid with medium containing 0, 5, 10, and 25 ng/mL CXCL13 and continued to culture for 24 h, or replaced the culture fluid with medium containing 25 ng/mL CXCL13 and continued to culture for 0, 1, 3, 6, and 24 h. The relative expression of RANKL was detected by Western blotting. The normal cultured cells without treatment of TNF-α and CXCL13 were used as the control group.Results①The expression levels of CXCL13 (fluorescence intensity) were 0.907±351, 0.823±735, 0.710±664, and 0.653±853 in cells treated with TNF-α at 0, 6, 12, and 24 h (allP<0.05). ②The expression of RANKL protein was 0.956±0.014 in the control group, and the expression levels of RANKL protein in cells treated with 25 ng/mL CXCL13 for 0, 1, 3, 6, and 24 h were 1.543±0.047, 1.366±0.026, 0.883±0.026, 0.367±0.034, and 0.246±0.015; the expression levels of RANKL protein in cells treated with different contentrations (0, 5, 10, 25 ng/mL) of CXCL13 were 0.287±0.007, 0.189±0.008, 0.069±0.004, and 0.022±0.002; significant difference was found between them (allP<0.05).ConclusionCXCL13 can inhibit the expression of RANKL protein of osteoarticular synovial cells induced by TNF-α in a certain concentration and time.
osteoarthritis; chemokine CXCL13; tumor necrosis factor-α; receptor activator of NF-κB ligand (RANKL); human synovial cells
吉林省教育厅科学技术研究“十二五”规划课题资助项目(吉教科合字201310)。
金晟宇(1990-),男,硕士研究生在读,研究方向为骨关节疾病。E-mail: jinshy0923@hotmail.com
任红革(1975-),男,副主任医师,研究方向为骨关节疾病。E-mail: renhg196@sina.com
10.3969/j.issn.1002-266X.2017.48.002
R684.3
A
1002-266X(2017)48-0005-04
2017-04-29)

