元素及其化合物得分宝典
北京 李宏华
元素及其化合物得分宝典

古人云:“学而不思则罔”,在学习中要善于归纳总结、勤于思考,找出知识的内在联系,对不懂的问题要及时解决,只有这样才能灵活运用所学的知识。细节决定成败,也决定了考试中得分的高低。
一、非金属及其化合物
1.硅及其化合物
【问题1】从元素周期表的位置看,碳和硅均为ⅣA元素,自然界中有碳的多种单质存在,自然界中有硅的单质吗?为什么?
【答案】没有,因为硅有很强的亲氧性,在地壳形成时硅与氧易结合,难分离,因而硅在自然界中主要以氧化物和硅酸盐形式存在。
【问题2】硅单质有广泛的用途,用化学方程式表示工业上获取硅单质的过程。

【问题3】SiO2既能与酸反应又能与碱反应,有的同学认为它是一种两性氧化物,你同意这种看法吗?
【答案】不同意。因为SiO2只能与HF反应,这是SiO2的特性,生成的也不是盐和水,SiO2是一种酸性氧化物,而不是两性氧化物。
【问题4】实验室要熔化NaOH固体,现有三种坩埚:石英坩埚、陶瓷坩埚和铁坩埚。你认为选哪一种,为什么?
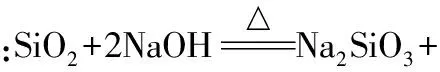
【问题5】光电材料和光纤材料的成分分别是什么?
【答案】光电材料的主要成分是晶体硅;光纤材料的主要成分是二氧化硅。
【问题6】若将长石和高岭土改写成氧化物的形式,试写出分别与HCl反应的离子方程式。

2.氯及其化合物
【问题1】如遇到氯气泄漏应如何自救?
【答案】Cl2密度比空气大,因此要逆着风向往高处转移。由于Cl2易和碱反应,可用蘸有肥皂水或纯碱溶液的毛巾捂住鼻子。向空中喷洒石灰水用于处理Cl2。
【问题2】将Cl2通入石蕊试液中的现象是什么?能用pH试纸测定氯水的pH吗?
【答案】现象是先变红后褪色。不能用pH试纸测定,因为氯水中的HClO能将pH试纸漂白。
【问题3】如何保存氯水、漂白粉?说明原因。
【答案】应避光(棕色试剂瓶中),密封保存。原因:氯水中的HClO见光易分解,氯水具有挥发性,易挥发出Cl2;漂白粉易吸收空气中的CO2和水蒸气生成HClO,HClO见光分解而使漂白粉失效。
【问题4】用排饱和食盐水法可以收集较纯净的氯气的原因是什么?该原理还可以用于收集哪些气体?
【答案】氯气在饱和食盐水中的溶解度较小,同时饱和食盐水又能够吸收其中含有的HCl。其原理则是饱和氯化钠溶液中Cl-的存在,导致Cl2与水的反应受到了抑制,所以Cl2的溶解度减小。CO2的收集可以用排饱和NaHCO3溶液法;SO2的收集可以用排饱和NaHSO3溶液法;H2S可以通过排饱和NaHS溶液法收集。
3.其他卤素单质及其化合物
【问题1】能使溴水褪色的物质有哪些?
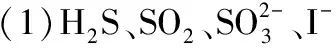
【问题2】下列哪些事实或实验能说明氧化性Cl2gt;Br2gt;I2?
。
①氯水分别滴入KBr、NaI溶液中颜色加深,而溴水滴入NaCl溶液中无明显变化,滴入KI - 淀粉溶液中,溶液变蓝;②H2和Cl2的混合气体光照爆炸,H2和Br2的混合气体加热才能反应,而H2和I2反应更困难;③Fe分别与Cl2、Br2、I2反应生成Fe的化合物的化合价高低;④HCl、HBr、HI的热稳定性越来越差;⑤Cl2、Br2、I2在水中的溶解度逐渐减小。
【答案】①②④
【问题3】淀粉 - KI试纸常用于检验哪些物质?
【答案】检验强氧化性物质如Cl2、Br2、FeCl3溶液、O3等,反应原理是I-被氧化成I2而使淀粉变蓝。
【问题4】请设计多种方案鉴别NaCl、NaBr、KI三种白色固体。
【答案】方法一:可用氯水鉴别。各取少量三种物质配成溶液,加入新制的氯水和汽油(或四氯化碳),振荡,分层,使汽油层呈无色的是NaCl;使汽油层呈橙色的是NaBr;呈紫红色的是KI。方法二:可先用焰色反应将KI区分出来。然后再将另外两种物质各取少量配成溶液,加入AgNO3溶液,有白色沉淀生成的是NaCl,有淡黄色沉淀生成的是NaBr。方法三:分别取少量固体配成溶液,分别加入 AgNO3溶液,有白色沉淀生成的是NaCl,有淡黄色沉淀生成的是NaBr,有黄色沉淀生成的是KI。
【问题5】检验X-存在时,加入稀硝酸的作用是什么?能否用盐酸代替?
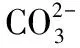
4.硫及其化合物
【问题1】氧化物为酸性氧化物、碱性氧化物,这样的分类与氧化物能够与水反应生成酸、碱有什么关系?
【答案】氧化物的酸碱性与其能否与水反应无直接联系,氧化物的酸碱性是根据其能否与酸或碱反应生成盐和水进行分类的,因为有的酸性氧化物或碱性氧化物不与水反应。
【问题2】如何洗涤附着在试管内壁上的硫?
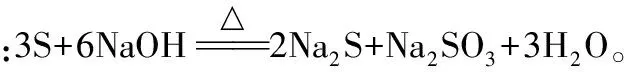
【问题3】哪些事实能说明硫的氧化性比Cl2的氧化性弱?
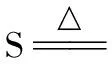
【问题4】有两瓶分别经过Cl2和SO2漂白的品红溶液,如何通过简单的实验鉴别?
【答案】加热,恢复红色的是经过SO2漂白的品红溶液,否则是经过Cl2漂白的品红溶液。
5.氮及其化合物
【问题1】根据氮在元素周期表中的位置可知氮元素是一种活泼的非金属,为什么氮气很稳定?
【答案】氮气的性质不仅与原子结构有关,还与氮分子的构成有关;氮气分子中的N≡N键,键能很大,分子结构稳定,故氮气很稳定。
【问题2】俗话说“雷雨发庄稼”,这说明雷雨中含有能被植物吸收利用的化合态的氮,请写出三个有关的化学方程式:
①
;
②
;
③
。
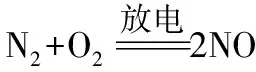
【问题3】如何鉴别NO2与溴蒸气?
【答案】由于NO2和Br2在性质上有不少相似性:①均具有氧化性;②溶于水均有酸生成;③均可与碱反应;④均为红棕色等。所以不能用淀粉 - KI试纸、pH试纸、NaOH溶液来鉴别,但二者性质又有差别,可以用下列方法鉴别:①AgNO3溶液;②CCl4溶液;③用水洗法。
【问题4】实验室收集NO和NO2气体时应分别采取什么方法?

【问题5】久置的硝酸呈黄色,如何除去?怎样保存硝酸?

【问题6】常温下,铝和铁在浓硝酸中“钝化”是化学变化吗?
【答案】是化学变化,钝化是在铁、铝的表面形成一层致密的氧化物保护膜,阻止了金属与硝酸的进一步反应。
【问题7】浓硝酸与铜反应产生NO2气体,稀硝酸与铜反应产生NO气体,有人认为稀硝酸的氧化性更强,这种说法正确吗?
【答案】不正确。浓硝酸与铜反应时反应剧烈,而稀硝酸与铜反应时相对平缓,故说明浓硝酸的氧化能力强。
【问题8】加热条件下,足量的铜与一定量的浓硫酸是否会有不同的气体产生?
【答案】随着反应的不断进行,硫酸的浓度降低,稀硫酸不能与铜反应,只能产生SO2气体。
【问题9】固态NH4Cl受热变成气体,气体遇冷又变为固态NH4Cl;固态碘受热变成蒸气,蒸气遇冷又变成固态碘,这两种现象的本质是否相同?
【答案】不相同,NH4Cl固体受热分解成NH3和HCl,发生了化学变化;固态碘受热升华成为碘蒸气,是物理变化。
【例1】(2016全国新课标Ⅰ)氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
(1)氨气的制备
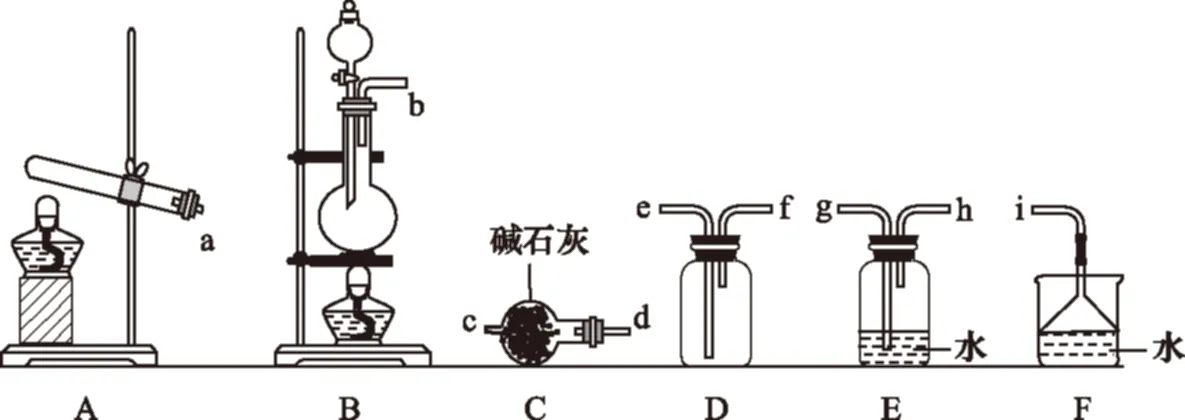
①氨气的发生装置可以选择上图中的________,反应的化学方程式为
。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→________(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
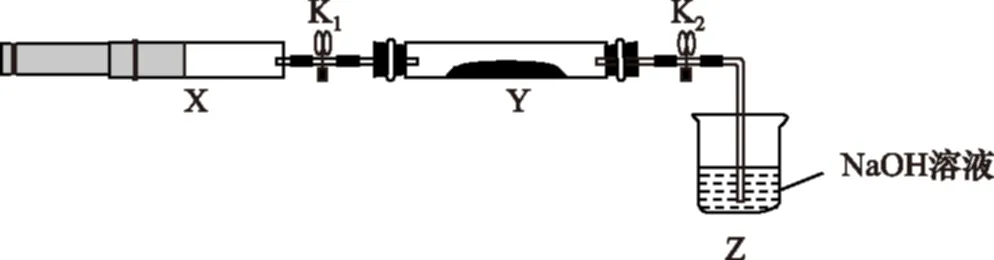
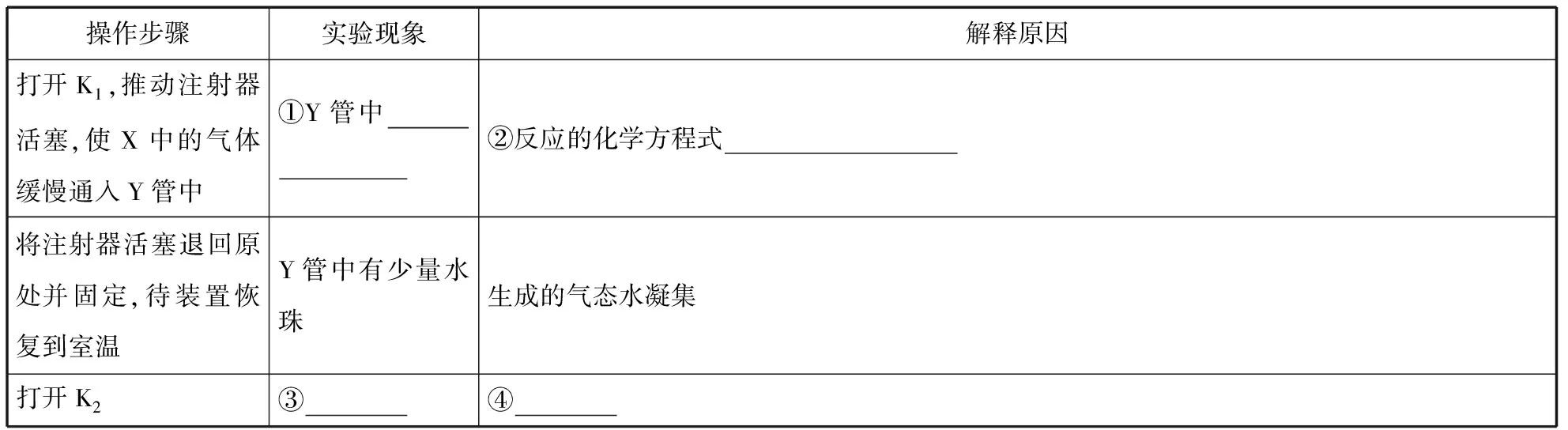
操作步骤实验现象解释原因打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中①Y管中________________②反应的化学方程式________________ 将注射器活塞退回原处并固定,待装置恢复到室温Y管中有少量水珠生成的气态水凝集打开K2③________④________

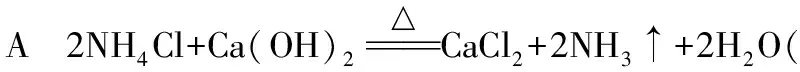

【名师点评】制取气体的装置与反应物的状态有关,通常由固体混合物加热制取气体可以用略向上倾斜的试管进行,但NH4Cl与Ca(OH)2的反应有H2O产生,防止其回流炸裂试管,故用略向上倾斜的试管进行实验。固体混合或固体与液体混合不加热制取气体可以在锥形瓶中进行,也可以在烧瓶中进行。液体用分液漏斗或长颈漏斗加入;若是液体与固体混合物加热制取气体,要在烧瓶中进行,同时为了受热均匀,应该垫上石棉网,判断装置连接顺序时,一般是按照:制取气体、除杂、干燥、收集、尾气处理。要根据除杂原则,采用适当的试剂除杂、干燥,根据物质的物理性质或化学性质进行气体的收集和尾气处理。对于极易溶于水或某溶液的气体,尾气处理要注意防止倒吸现象的发生。另外,解题时会根据物质的性质判断反应现象。
二、金属及其化合物
1.钠及其化合物
【问题1】钠能否保存在CCl4中?
【答案】否,因为CCl4的密度比钠的大。

【答案】Na2O NaOH 溶液 Na2CO3
【问题3】金属钠着火,不能用H2O、干冰灭火的原因是________________,通常用________掩埋。
【答案】金属钠能与H2O或CO2反应 干燥沙土
【问题4】将CO2气体通入到饱和Na2CO3溶液中有何现象?原因是什么?
【答案】开始无明显现象,后有沉淀析出。原因是 NaHCO3的溶解度小于Na2CO3的溶解度,而且反应消耗溶剂水。
【问题5】Na2CO3固体粉末中混有少量NaHCO3,用什么方法除杂?Na2CO3溶液中混有少量NaHCO3,用什么方法除杂?NaHCO3溶液中混有少量Na2CO3,用什么方法除杂?
【答案】用加热法可以将Na2CO3固体粉末中混有的NaHCO3转化为Na2CO3;向混合液中滴加适量的NaOH溶液,可以将其中的NaHCO3转化为Na2CO3;向混合液中通入过量的CO2气体,可以将Na2CO3转化为NaHCO3。
【问题6】根据碱金属的性质规律思考下列问题。
(1)钠与氧气反应有Na2O、Na2O2两种氧化物生成,其他碱金属单质与氧气反应也只生成两种类似的氧化物吗?
【答案】不是,如Li与氧气反应只生成Li2O,K与O2反应还能生成更复杂的氧化物。
(2)钠的还原性比钾的弱,但工业上制取钾时却用钠置换钾的原因是
。

【问题7】焰色反应是物理变化还是化学变化?
【答案】物理变化
2.铝及其化合物
【问题8】铝的化学性质活泼,为什么日常生活中广泛使用的铝制品通常具有较好的抗腐蚀性能?
【答案】铝在常温下迅速被氧气氧化,形成一层致密的氧化膜,保护铝不再被氧化,因而铝制品通常具有较强的抗腐蚀性能。
【问题9】金属铝是活泼的金属,能与酸反应,为什么能用铝槽储运浓H2SO4或浓HNO3?
【答案】常温下浓H2SO4、浓HNO3能使铝钝化(在表面形成一层致密的氧化膜),阻止反应继续进行。
【问题10】实验室能否用硫化物与铝盐溶液混合制取Al2S3?用离子方程式说明原因。

【问题11】Al既能溶于强酸,又能溶于强碱,所以说“Al既有金属性,又有非金属性”你认为这种说法是否恰当?为什么?
【答案】不恰当。金属性是指元素的原子失电子的能力,非金属性是指元素的原子得电子的能力。铝不论是与酸反应还是与碱反应,都是失去3e-,化合价升高为+3价,在反应中均作还原剂,因而铝具有较强的金属性。
【问题12】明矾的净水作用与液氯对自来水的消毒作用原理是否相同?
【答案】不同。明矾净水只能除去水中的悬浮杂质,不能杀菌消毒,而液氯只能杀菌消毒,不能沉淀悬浮的杂质。
【问题13】在做铝的燃烧实验时,用坩锅钳夹住一小块铝箔,在酒精灯上加热至其熔化,会看到的现象是铝箔熔化,失去光泽,但熔化的铝并不滴落。原因是
。
【答案】铝箔加热时与O2发生反应生成熔点很高的Al2O3薄膜,使内部的铝被Al2O3包裹着,所以熔化的铝不易滴下。
3.铁及其化合物
【问题13】铁、铝遇浓硫酸或浓硝酸发生钝化,是物理变化还是化学变化?
【答案】常温下铁、铝遇冷的浓HNO3、浓H2SO4时表面会生成一层致密的氧化物薄膜,化学上称为钝化,属于化学变化。
【问题14】铁元素是典型的变价金属元素,它在化合物中主要表现为+2价和+3价,请归纳总结:
(1)Fe单质通常与哪些氧化剂反应生成含+2价铁元素的化合物?写出有关反应的化学方程式或离子方程式。
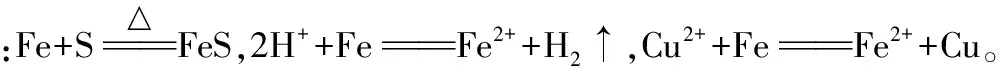
(2)Fe单质通常与哪些氧化剂反应生成含+3价铁元素的化合物?写出有关反应的化学方程式。
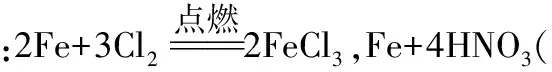
【问题15】FeCl3、FeCl2和Fe(OH)3是否都可以通过化合反应制取?
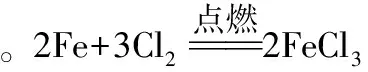
【例2】(2016全国新课标Ⅱ)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是
。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为
。
(3)乙组同学认为甲组的实验不够严谨,该组同学在 2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是________
。
(4)丙组同学取10 mL 0.1 mol/L KI溶液,加入6 mL 0.1 mol/L FeCl3溶液混合。分别取2 mL此溶液于3 支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层呈紫色;
②第二只试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有________(填离子符号),由此可以证明该氧化还原反应为________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是________________;生成沉淀的原因是________________(用平衡移动原理解释)。



北京市顺义区第八中学)

