构建化学模型 速判焓变大小
甘肃 马丰国
构建化学模型 速判焓变大小

反应热是化学反应中吸收或放出的热量,等压条件下与焓变相等。这部分内容是实施新课改以来新增加进去的。近几年在高考中考查的频率很高,是高考的热点。有关反应热大小比较的题目很多,有一类题目是由于反应物和生成物的状态不同而比较焓变的大小,解法虽有多种,但笔者认为利用图象构建化学模型,巧解这类题目,能帮助学生直观、快速、有效地判断ΔH的相对大小。
一、知识储备
学生在学习了这部分内容以后,已经会判断常见的化学反应哪些是放热反应,哪些是吸热反应,并根据化学反应中的能量变化,掌握了等物质的量的同一物质在不同状态下的所具有的能量是不同的,即E(气态)gt;E(液态)gt;E(固态)。
二、模型的建立
下面笔者以A(状态)+B(状态)C(状态)反应为例,根据A、B、C三种物质在不同状态下的化学反应中的焓变,构建了以下四种解题模型:
模型1:反应物状态变化而生成物状态不变的放热反应:
A(g)+B(g)C(g) ΔH1
A(l)+B(l)C(g) ΔH2
A(s)+B(s)C(g) ΔH3

由上图可以看出,由于放热反应的ΔH是负值,ΔH1的数值最大,反而是最小,即ΔH3gt;ΔH2gt;ΔH1
模型2:反应物状态不变而生成物状态变化的放热反应:
A(g)+B(g)C(g) ΔH1
A(g)+B(g)C(l) ΔH2
A(g)+B(g)C(s) ΔH3

由上图可以看出,由于放热反应的ΔH是负值,ΔH1的数值最小,反而是最大,即ΔH1gt;ΔH2gt;ΔH3。
模型3:反应物状态变化而生成物状态不变的吸热反应:
C(g)A(g)+B(g) ΔH1
C(l)A(g)+B(g) ΔH2
C(s)A(g)+B(g) ΔH3

由上图可以看出,由于吸热反应的ΔH是正值,ΔH1的数值最小,即ΔH3gt;ΔH2gt;ΔH1
模型4:反应物状态不变而生成物状态变化的吸热反应:
C(g)A(g)+B(g) ΔH1
C(g)A(l)+B(l) ΔH2
C(g)A(s)+B(s) ΔH3
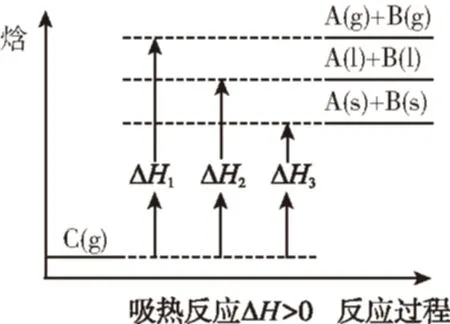
由上图可以看出,由于吸热反应的ΔH是正值,ΔH1的数值最大,即ΔH1gt;ΔH2gt;ΔH3
三、效果检测
根据以下三个热化学方程式:
①2H2S(g)+O2(g)2S(s)+2H2O(g) ΔH1

