对一些化学教学疑问的合理解释
重庆 刘怀乐 杜文敏
对一些化学教学疑问的合理解释

一、为什么浓盐酸在空气中冒白雾,而氨水在空气中不呈现白雾状
原来,水蒸气的质点(H2O)n是氯化氢在空气中的凝聚中心,氯化氢与水可以形成具有高于水沸点的恒沸点的盐酸酸雾。凡是可以跟水形成恒沸溶液的气态物质(如表1所示卤化氢),都可以形成相似的雾。
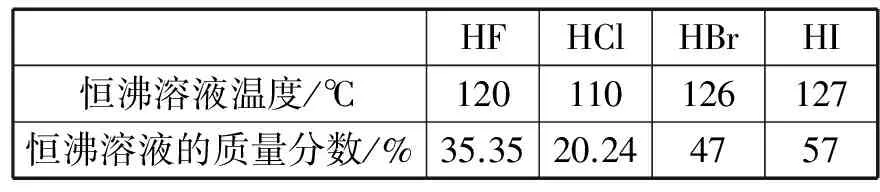
表1 恒沸溶液温度与质量分数
再如,纯硝酸(无水)容易挥发出硝酸蒸气,发烟硝酸容易挥发出NO2,它们都会跟空气中的水蒸气形成恒沸点为128.8℃的硝酸;发烟硫酸能挥发出SO3,它与空气中的水反应生成具有恒沸点(334℃)且沸点远高于水的硫酸。
尽管氨极易溶于水,但是NH3与水不形成恒沸溶液。任何浓度的氨水都具有挥发性。乙醇溶于水,可与水形成恒沸溶液(质量分数为95.5%),但是它的沸点低于水的沸点,仅为78.1℃。同样,任何浓度的酒精都具有挥发性。所以,大凡以水为凝聚中心,且能形成比水的沸点还要高的恒沸溶液的气态物质,都可以在空气中呈现白雾状。
二、为什么大理石没有液态,乙炔没有固态,H3PO4没有沸点
这是因为还不待液化时,大理石就已经分解了;还没有凝固时,C2H2就聚合成其他物质——生成链状及环状化合物;加热时,H3PO4会逐渐失水生成偏磷酸和焦磷酸。
三、石灰石的热分解温度是多少
资料1:加热至420℃即开始分解为CaO和CO2,894.4℃±0.3℃时,CO2蒸气压力可达1个大气压。
资料2:加热到825℃左右分解为氧化钙和二氧化碳。
资料3:CaCO3,898.6℃分解。
资料4:CaCO3,825℃分解。
资料5:在1.01×105Pa下加热至898℃(方解石晶型)、825℃(霰石晶型)分解成二氧化碳和氧化钙。
资料6:碳酸钙的热分解温度为1 170 K(987℃)。
资料7:无水CaCO3为无色斜方晶体,加热至1 000 K(727℃)转变为方解石。


判断ΔH1、ΔH2、ΔH3三者关系正确的是
( )
A.ΔH1gt;ΔH2gt;ΔH3
B.ΔH3gt;ΔH1gt;ΔH2
C.ΔH2gt;ΔH1gt;ΔH3
D.ΔH3gt;ΔH2gt;ΔH1
【解析】常规解法:由①式-②式得,
由②式-③式得,

由①式-③式得,

综合得出结论:ΔH2gt;ΔH1gt;ΔH3,选答案C。
图象模型解法:
由上述化学方程式可以看出反应物状态不变而生成物状态变化的放热反应,则根据解题模型2做出图象如下:
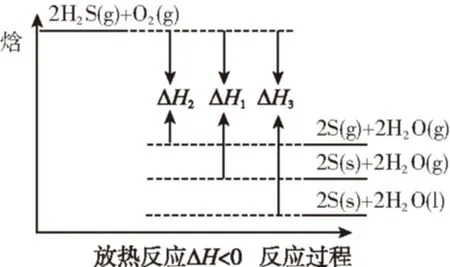
可以很快得出结论:ΔH2gt;ΔH1gt;ΔH3。
四、结论与建议



表2 平衡常数与温度的关系
石灰窟中的温度实际可达1 000℃以上。
以上资料均摘自权威文献,文献的权威性和可靠性是毋庸置疑的。问题是提供这些数据的前提和条件是有差异的。
有的以CaCO3开始热分解,以实际可以检验CO2和CaO的存在为CaCO3的热分解温度(420℃);有的以 CaCO3热分解产生的CO2的蒸气达到1大气压为准(898℃);有的以CaCO3不同晶型为准——方解石晶型、霰石晶型;有的以化学纯的沉淀CaCO3热分解为准;有的甚至以石灰窟生产石灰的实际温度为准,不一而足,相信都有参考价值。不过笔者对资料7中无水CaCO3加热至727℃转变为方解石还不甚理解。
四、无水碳酸钠是晶体还是粉末
高中化学必修1第57面有如下一段文字:碳酸钠粉末遇水生成有结晶水的碳酸钠晶体——水合碳酸钠 (Na2CO3·xH2O)。碳酸钠晶体在干燥空气里容易逐渐失去结晶水变成碳酸钠粉末。

笔者参阅了不下10种权威文献,几乎无一例外地指明,无水碳酸钠是白色粉末,是非晶型的。某文献上的这一段叙述值得一读:“目前生产的碳酸钠由于生产时工艺条件不同,产品有非晶型的无水物和结晶型的有水物两类。通常讲的纯碱是指非晶型的无水碳酸钠。常用的晶型碳酸钠有十水碳酸钠( Na2CO3·10H2O)和一水碳酸钠两种。十水碳酸钠又称面碱、洗涤碱,一水碳酸钠在摄影业中称碳氧。”
这又似乎可以给无水碳酸钠下个结论是非晶型的白色粉末了。不过后来在文献查得,作为制碱工业之父的化学工程大家侯德榜有如下的一句陈述:“纯碱本是一种结晶颗粒,因为粒子细小,所以看起来是粉状,把它灼烧,不会放出二氧化碳来。”笔者本不迷信权威,但我相信这样富有底气的权威的客观真实的判断——白色的碳酸钠粉末实际是很小的结晶颗粒。
五、Na2CO3·10H2O晶体会风化成白色粉末,这白色粉末的成分是什么
资料9:在空气中容易风化而转变成白色粉末状的一水碳酸钠Na2CO3·H2O。
资料10:露置在空气中容易风化而成一水物的粉末。
资料11:在空气中迅速风化而成白色粉末——Na2CO3·5H2O。
可见,Na2CO3·10H2O风化后的白色粉末的成分并不单一。有一点可以肯定,其组成不可能还是当初的那种无水碳酸钠粉末。
再有一点值得一说,就是模块教材对碳酸钠晶体在空气中的风化现象设置了个前提(或条件)是“在干燥的空气里容易风化”。我们查阅文献以及2002年经全国中小学教材审查通过的高中化学(必修)第一册(2007年人教版20面),其对Na2CO3·10H2O晶体风化,都分别明确叙述成“容易风化”“迅速风化”“很容易风化”。笔者想问个究竟,这种改变是符合实际的吗?不过笔者还是建议以不设“干燥空气”这个前提条件更科学、更准确,更符合实际。
六、Na2CO3可以形成多少种水合物
高一化学必修1第57面有注:碳酸钠水合物有Na2CO3·H2O、Na2CO3·7H2O和Na2CO3·10H2O三种。有文献指出由于条件不同,还有Na2CO3·5H2O、Na2CO3·2H2O 和Na2CO3·3H2O。如有文献指出“纯碱从溶液中析出晶体的时候,根据溶液浓度、温度、杂质等条件的不同,可能和水生成带多种结晶水的纯碱晶体(如带1分子、7分子、10分子结晶水的纯碱)成为水合物。但在普通条件下(严格说32℃以下),从浓溶液中析出的结晶体是带10个结晶水的粗颗粒晶碱;在33℃以上,或从热溶液里结晶出来的是1个分子水合物”。
七、CuSO4与Na2CO3反应,何不生成CuCO3
据说正规的CuCO3并不存在。如果你去化学试剂商店购买CuCO3,售货员会给你碱式碳酸铜,而且还可能告诉你“碱式碳酸铜就是碳酸铜”,或者“碱式碳酸铜可以当作碳酸铜来用”。话虽然说得不那么专业,但事实确实如此。
问题当然没有那么简单。原来在CuSO4溶液中加入Na2CO3,不是生成CuCO3,而是生成成分不定的 Cu2(OH)2SO4和Cu2(OH)2CO3的绿色混合物。不仅如此,即使在冷的CuSO4溶液中加入NaOH溶液,当滴入NaOH溶液的量少时,也只能得到絮状浅蓝色沉淀Cu2(OH)2SO4,而得不到Cu(OH)2沉淀。更有甚者,当把少量CuSO4的浓溶液滴进普通水(如自来水)中,溶液变得浑浊,静置将溶液加热到沸腾,甚至蒸干,也不见沉淀物分解。这也是因为生成了具有溶度积小、热稳定性高的 Cu2(OH)2SO4。
原来CuSO4溶液因水解显酸性,当加入少量NaOH、Na2CO3或用水稀释CuSO4溶液时,由于溶液pH升高,首先生成溶解度极小的碱式硫酸铜和碱式碳酸铜,而得不到CuCO3。
八、关于碳酸钠、碳酸氢钠溶于水的热现象
四支试管里分别放入2 g Na2CO3、Na2CO3·H2O(碳氧)、Na2CO3·10H2O和NaHCO3(小苏打),再分别注入 4 mL 水,观察温度变化(如表3所示)。

表3 室温10℃,水温10℃,溶液温度变化测试
九、给“粉末”加个注释
一般来说物质有三态——固态、液态和气态。“粉末”当然不属于科学概念上的什么态,它是一种对某些固体物质外观形象的一种说法。难怪有人常常提出这样的问题:生石灰、熟石灰、无水CuSO4等,我们常常以粉末称之,那它们的细小颗粒又属不属于离子晶体?尽管我们常常习惯地称什么“灰”,什么“粉末”“粉状”,但从它们的微粒结构来看,跟无水Na2CO3一样都是些细小的结晶颗粒,有的小得比“粉”末还小,称什么“灰”。从物质微观结构来看,CaO、Ca(OH)2、CuSO4等都是含有大量阴阳离子的离子化合物,它们熔点高、不挥发、相当硬,将其熔化可以导电,水溶液可以导电,难溶于有机溶剂等。因此,从广义上说,所有这些以及类似这些外观看似粉末状的物质,其细小颗粒还是由大量阴阳离子组成的离子晶体。从这个角度讲,对于生石灰、熟石灰、无水CuSO4、Na2CO3等外观,形象地说它们是什么粉末并不错,微观地说它们是晶体也对,这不矛盾。或者更为形象地说,生石灰、熟石灰、无水CuSO4、Na2CO3等离子晶体,它们都是些心里揣着明白(是晶体)装糊涂(粉、末、灰)的物质。
十、测定液体(如水)的沸点,温度计的水银泡是没入液体内还是在液面上方
正确的操作为图1中b。原因:我们测定的液体不一定是纯粹的,比如自来水(有硬性),它的沸点就比纯水要高。即使用蒸馏水,也可能会有杂质的影响。所以我们测定某种液体的沸点,应当是它逸出的蒸气与冷凝液平衡时的温度。为此,须在加热液体沸腾后,待温度计水银球泡上有两三滴液体往下滴时,再观察温度计所指示的读数,那便是该液体的沸点。

图1 测液体沸点示意图
十一、静置搁放的一杯水,是上层还是底层水体的温度高,或是上下的温度相同
答案只能由实验测定来回答。以下三个实验值得一做。
实验1:用一只250~500 mL的烧杯盛满水,静置隔夜后用温度计测试,上层液体的温度会高于下层液体的温度0.5~1℃。
实验2:在一个250~500 mL的烧杯中注满刚沸腾后的水,待它缓慢冷却到50℃左右时再测试,你会发现上层液体的温度也会比下层液体的温度高出1~1.5℃,而且实验2的现象——变化速率比实验1来得快。
实验3:高中化学讲醛基(—CHO)的还原性时有如下的实验:加热煮沸碱性Cu(OH)2与乙醛的混合液时,混合液的颜色逐渐由蓝色→黄绿色→橙黄色→红色(生成Cu2O)。实验时你会发现,变色的现象总是最先从试管液面开始,逐渐扩散至试管底。这表明,尽管是在加热试管底部的液体,液面的温度却比试管底部液体的温度要高,所以反应(变色)最先从液面开始。
不论是静置的水还是加热溶液,液体的传热都有一个对流过程——热的溶液向上流动,冷的溶液向下流动,上层液体的温度比下层液体的温度要高就成了很自然的事了。

(转载自《中学化学教学参考》2016年第13期,有改动)
甘肃省临夏回民中学)

