立足“基础” 强化“对策”
——高三化学一轮复习的几个着眼点
河北 颜建河
立足“基础” 强化“对策”
——高三化学一轮复习的几个着眼点

新一轮高考复习已经拉开序幕,如何才能把握正确的备考方向呢?这是我们考生所面临的首要问题,给考生指明高效备考方向,才能做到提“效”增“益”,立足“基础”,强化“对策”才是复习之大策。从近年来的高考真题中不难发现,高考命题注重对化学学习能力的要求。其着眼点主要体现在:第一,接受、吸收、整合化学信息的能力;第二,分析和解决化学问题的能力;第三,化学实验与探究的能力。基于此,依据化学的学科体系和学科特点,从三个方面进行针对性的复习,才能实现复习的最大效益。
着眼点之一:立足“课本”,强化基础知识
高三化学一轮复习是中学化学学习非常重要的时期,也是巩固基础、优化思维、提高能力的重要阶段。为此,在复习中一定要立足“课本”,强化基础知识,特别要强化《考纲》对每个知识内容的要求层次,努力做到由点到线,由线到面,形成完整的基础知识体系,实现对基础知识的再认识,做到了解、理解(掌握)、综合应用的目的。例如,在复习选修模块“物质结构与性质”内容时,考生更应该强化课本知识,依据“考纲”对知识内容的要求层次,认认真真地梳理每一个知识点,达到相应的了解、理解(掌握)、综合运用的层次要求。同时,要做到在解决化学问题(习题)时,能从课本上查找依据,明确认识试题的“源头”、基础都来自课本。无论是简单题还是难题,“根”都离不开课本,且都能从课本上找出依据,培养分析问题和解决问题的能力。
例1(2015·全国Ⅰ卷)碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用________形象化描述。在基态14C原子中,核外存在________对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是________。
(3)CS2分子中,共价键的类型有________,C原子的杂化轨道类型是________,写出两个与CS2具有相同空间构型和键合形式的分子或离子:________。
(4)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253 K,沸点为376 K,其固体属于________晶体。
(5)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:

①在石墨烯晶体中,每个C原子连接________个六元环,每个六元环占有________个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接________个六元环,六元环中最多有________个C原子在同一平面。
分析与解答:本题是一道涉及“物质结构与性质”模块内容的题目,试题立足课本,强调对基础知识的理解和运用,突出抽象思维、空间想象以及知识迁移能力的考查,试题有一定难度。解决好这类问题的关键,就是掌握课本知识,即物质结构与性质包括原子结构与性质(原子核外电子排布,元素电负性大小比较,元素金属性、非金属性的强弱等)、化学键与分子结构(化学键、键参数、分子的电子式、结构式、结构简式的书写等)、晶体结构与性质(晶体类型的判断、物质熔沸点的高低比较、晶体的密度计算、均摊方法的应用等)。依据这些基础知识,试题中的各个问题可迅速得以解决。
(1)电子在原子核外出现的概率密度可用电子云来描述;基态14C原子核外电子排布式为1s22s22p2,2个s轨道分别存在1对自旋相反的电子,2p轨道上的2个电子自旋方向相同。
(2)碳原子有4个价电子,且碳原子半径较小,很难通过得或失电子形成稳定结构,在形成化合物时,通常通过共用电子对形成共价键,则键型以共价键为主。

(4)Fe(CO)5的熔、沸点较低,符合分子晶体的性质,则Fe(CO)5固体属于分子晶体。
(5)①由图可知,石墨烯中每个碳被3个六元环所共有,每个六元环占有的碳原子数为6×1/3=2个。②金刚石晶体中每个碳原子被12个环所共有。六元环呈船式或椅式结构,最多有4个原子共平面。
答案:(1)电子云 2 (2)C有4个价电子,且原子半径小,难以通过得或失电子达到稳定电子结构 (3)σ键和π键 sp杂化 CO2、COS或SCN-、OCN-(4)分子 (5)①3 2 ②12 4
着眼点之二:立足“基础”,强化核心考点
基础和能力是相辅相成的,没有基础,能力就缺少了扎根的土壤。“考纲”明确了对知识内容的要求层次,特别是涉及理解(掌握)和综合运用的知识,必将成为高考的核心考点。为此,在复习备考中要做到能领会所学知识的含义及其适用条件,能够正确判断、解释和说明有关化学现象和问题。能“知其然”,还能“知其所以然”,从而实现知识的再升华。同时,高考强调命题要突出主干知识(核心知识)考查,不回避考试热点和传统题型,不再过分强调知识的覆盖面,而是抓住主干知识,突出以能力测试为主导。例如,在复习中要依据“教材”特点和“考纲”要求,抓住主要知识的精髓,特别是中学化学的核心内容。这些内容包括:物质结构、氧化还原反应、离子反应、盖斯定律、化学平衡、元素化合物知识、电化学、有机化学、化学实验、化学基本计算等。同时,要依据“考纲”要求,深化对核心考点的理解,促进知识网络的建构,提高解决化学问题的综合能力。
例2(2015·全国Ⅱ卷)甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:



回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:

化学键H—HC—OC≡OH—OC—HE/(kJ·mol-1)4363431076465413
由此计算ΔH1=________kJ·mol-1,已知ΔH2=-58 kJ·mol-1,则ΔH3=________kJ·mol-1。
(2)反应Ⅰ的化学平衡常数K的表达式为________________ ;图1中能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母),其判断理由是
。


(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而________(填“增大”或“减小”),其原因是________________ 。图2中的压强由大到小为________,其判断理由是
。
分析与解答:本题是一道涉及利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇的方法,着力考查反应热计算、盖斯定律应用、平衡常数以及外界条件对平衡状态的影响等,试题有一定难度。解决好这类问题的关键,就是深刻理解盖斯定律、化学平衡方面的相关核心知识,理解图象、表格中数字的意义,联系相关化学知识,巧妙地将表格语言转换成化学语言,或利用相关数据进行计算,则试题中的各个问题可迅速给予解决。
(1)从反应①中的相关的化学键键能数据,则ΔH1=[E(C≡O)+2E(H-H)]-[3E(C-H)+E(C-O)+E(H-O)]=(1 076 kJ·mol-1+2×436 kJ·mol-1)-(3×413 kJ·mol-1+343 kJ·mol-1+465 kJ·mol-1)=-99 kJ·mol-1;根据盖斯定律,由Ⅱ式-Ⅰ式可得反应Ⅲ式,即ΔH3=ΔH2-ΔH1=-58 kJ·mol-1-(-99 kJ·mol-1)=+41 kJ·mol-1。
(2)根据化学平衡常数的概念可写出反应Ⅰ的K的表达式;反应Ⅰ是放热反应,升高温度,化学平衡向逆反应方向移动,化学平衡常数K减小,则曲线a符合。
(3)由图2可知,压强不变时,随着温度的升高,α(CO)减小;反应Ⅲ为气体分子数不变的反应,加压对其平衡无影响;反应Ⅰ为气体分子数减小的反应,加压使α(CO)增大;由图2可知,固定温度(如530 K)时,p1→p2→p3,α(CO)增大,则综合分析可知:p3gt;p2gt;p1。
答案:(1)-99 +41 (2)K=c(CH3OH)/[c(CO)·c2(H2)] a 反应Ⅰ为放热反应,升高温度使其平衡向逆反应方向移动,平衡常数K应减小 (3)减小 由图2可知,压强恒定时,随着温度的升高,α(CO)减小p3gt;p2gt;p1温度恒定时,反应Ⅰ为气体分子数减小的反应,加压使平衡向正反应方向移动,α(CO)增大,而反应Ⅲ为气体分子数不变的反应,加压对其平衡无影响,故增大压强时α(CO)增大。
着眼点之三:立足“考点”,强化真题训练
练习是化学总复习的重要组成部分,是运用知识解决问题的再学习、再认识过程,也是促进知识迁移,训练思维,提高分析问题和解决问题能力的重要途径,但练习量必须合理,以保证质量为前提,避免简单的机械重复和陷入“题海”。为此,在复习进程中要做到对每个知识点的真正掌握,就必须强化真题训练,做到在理解所学各部分化学知识之间的本质区别与内在联系的基础上,运用所掌握的知识进行必要的分析、类推或计算,解释、论证一些具体的化学问题。要实现这一目标,必须认真研读近几年的高考真题,了解高考命题方向,通过训练复习,掌握解题技巧、提高准确性,优化解题思路和方法。同时,做题一定要真正弄懂,融会贯通,并能举一反三,实现能力的再升级。例如,以化学工艺流程(框图)为载体,以图象、数据、图表为信息载体,以化学实验控制变量为载体,以新药、新的染料中间体、新型有机材料的合成为载体的高考主打题目,在强化真题训练中,一定要训练到位,认真反思,认真总结,才能做到战无不胜。
例3(2015·天津卷)废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:

回答下列问题:
a.富集铜元素
b.使铜元素与水溶液中的物质分离
c.增加Cu2+在水中的溶解度
(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和________。
若操作③使用如图装置,图中存在的错误是________。
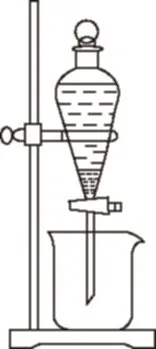
(4)操作④以石墨作电极电解CuSO4溶液。阴极析出铜,阳极产物是________。操作⑤由硫酸铜溶液制胆矾的主要步骤是________________________。
(5)流程中有三处实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是________。循环使用的NH4Cl在反应Ⅰ中的主要作用是
。
分析与解答:本题是一道模拟回收铜和制取胆矾方法的化学工艺流程题,着力考查物质制备流程的分析判断,离子方程式的书写,基本实验操作的分析、判断、评价和设计等,试题难度不大。解决好这类问题的关键,就是熟悉化学工艺流程试题的分析思路,认真读题,特别要认真读懂流程(框图),并依据设问结合所学相关知识,则试题中的各个问题可迅速得以解决。
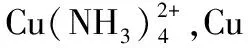
(3)CuR2中R元素为-1价,所以反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和RH;操作③使用的过滤操作中分液漏斗尖端未紧靠烧杯内壁,且分液漏斗内的液体太多。

(5)电解CuSO4溶液时能得到硫酸,操作④中得到的硫酸可用在反应Ⅲ中,所以第三种循环的试剂为H2SO4;氯化铵溶液呈酸性,可降低溶液中氢氧根离子的浓度,防止由于溶液中的c(OH-)过高,生成Cu(OH)2沉淀。

河北省衡水市故城县教育局)

