氧化还原反应之“一二三四”
宁夏王开山
氧化还原反应之“一二三四”

一、一个思想
守恒思想是中学化学核心思想之一,也是氧化还原反应的核心思想。守恒思想在氧化还原反应中主要体现在以下几个方面:
1.电子得失总数守恒
氧化剂得电子总数等于还原剂失电子总数。
2.化合价升降总数守恒
氧化剂中元素化合价降低总数等于还原剂中元素化合价升高总数。
3.元素守恒
反应前后各元素的种类不变,各元素原子的数目不变,也可称为质量守恒。
4.电荷守恒
在有离子参加的氧化还原反应中,反应前后离子所带电荷总数相等。
说明:非氧化还原反应也遵守元素守恒和电荷守恒。
二、两块内容
1.基本概念
(1)氧化还原反应的判断依据
有元素化合价变化的化学反应就是氧化还原反应。
(2)氧化剂和还原剂的概念
在反应过程中所含元素化合价降低(得到电子)的物质是氧化剂。所含元素化合价升高(失去电子)的物质是还原剂。
(3)氧化产物和还原产物的概念
还原剂失去电子被氧化生成的产物是氧化产物。氧化剂得到电子被还原生成的产物是还原产物。
(4)氧化性和还原性的概念
物质得电子的性质叫氧化性。物质得电子的能力越强,氧化性越强。
物质失电子的性质叫还原性。物质失电子的能力越强,还原性越强。
2.常见的氧化剂和还原剂
(1)常见的氧化剂
①活泼非金属单质:F2、Cl2、Br2、I2、O2、O3
②高价氧化物:MnO2、PbO2、CO2(高温)
③高价态酸:HNO3、HClO3、HClO4、浓H2SO4
④高价态盐:KNO3(酸性)、 KMnO4(酸性)、 KClO3、FeCl3、K2Cr2O7(酸性)
⑤过氧化物:H2O2、Na2O2、CaO2、BaO2、K2O2
⑥弱氧化剂:能电离出H+的物质、银氨溶液、新制的Cu(OH)2溶液
⑦其他:HClO、NaClO、漂白粉、NO2、KO2
(2)常见的还原剂
①金属单质:ⅠA族、ⅡA族中的金属元素单质,金属活动性顺序表中靠前的金属
②非金属单质:H2、C、Si
③变价元素中元素低价态氧化物:SO2、CO

⑤变价元素中元素低价态的盐、碱,如:Na2SO3、Na2S、FeSO4、Na2S2O3、Fe(OH)2
⑥其他:S、Sn2+、NH3等
三、三个规律
1.价态规律
(1)元素处于最高价的物质一般只具有氧化性,只作氧化剂。
(2)元素处于最低价的物质一般只具有还原性,只作还原剂。
(3)元素处于中间价的物质一般既有氧化性又有还原性,既可作氧化剂又可作还原剂。
误区明辨:所含元素化合价的高低和氧化性、还原性的强弱没有必然的联系。如HClO(Cl为+1价)的氧化性强于HClO4(Cl为+7价)。
2.强弱规律
(1)具有较强氧化性的氧化剂与较强还原性的还原剂发生反应生成较弱还原性的还原产物和较弱氧化性的氧化产物。
误区明辨:氧化剂与还原剂混合到一起不一定能发生氧化还原反应,如可以用强氧化性的浓H2SO4干燥还原性的气体H2、CO等。
(2)金属单质的还原性越强,其阳离子的氧化性越弱;非金属单质的氧化性越强,其阴离子的还原性越弱。
例如,Cu的还原性强于Ag的还原性,但氧化性Ag+gt;Cu2+;Cl2的氧化性强于I2的氧化性,但还原性I-gt;Cl-。
误区明辨:①要注意某些变价金属元素对应离子的氧化性或还原性。如Fe的还原性强于Cu,Fe2+的氧化性弱于Cu2+,但Fe3+的氧化性强于Cu2+。
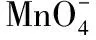
(3)一种氧化剂同时和几种还原剂相遇时,还原性强的先反应;同理,一种还原剂遇到多种氧化剂时,氧化性强的先反应。即“遇强先反应”。
例如,向FeBr2溶液中通入Cl2,Cl2首先与溶液中还原性强的Fe2+反应。
3.转化规律
(1)同种元素不同价态之间发生反应,化合价只靠近不交叉。
(2)同种元素相邻价态之间不发生反应。

四、四个考点
考点1.氧化还原反应基本概念
【例1】下列应用不涉及氧化还原反应的是
( )
A.Na2O2用作呼吸面具的供氧剂
B.工业上电解熔融状态的Al2O3制备Al
C.工业上利用合成氨实现人工固氮
D.实验室用NH4Cl和Ca(OH)2制备NH3
【解析】A选项Na2O2用作呼吸面具的供氧剂,主要是Na2O2与CO2反应生成O2,属于氧化还原反应;B选项工业上电解熔融状态的Al2O3制备Al,Al元素和O元素的化合价都发生变化,属于氧化还原反应;C选项工业上利用合成氨实现人工固氮,N元素由游离态(N2)变为化合态(NH3),属于氧化还原反应;D选项实验室用NH4Cl和 Ca(OH)2制备NH3,没有元素的化合价发生变化,属于非氧化还原反应。
【答案】D

( )





【答案】C
【解答策略】元素所处的化合价以及反应前后化合价的变化是解答氧化还原反应基本概念试题的关键点。可以作为是否为氧化还原反应的判断依据,也是确定氧化剂、还原剂、氧化产物、还原产物的依据,也能确定某种物质是否具有氧化性或还原性。
考点2.物质氧化性、还原性强弱比较
【例3】已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是
( )



D.2Fe3++2I2Fe2++I2
【解析】Fe3+的氧化性弱于Cl2的氧化性,但氧化性:FeCl3gt;I2,则还原性:I-gt;Fe2+,I-先被氧化,所以在A选项中,不会有FeI3生成;B、C、D选项中的反应都符合氧化性强的物质制备氧化性弱的物质这一规律。A选项不可能发生。
【答案】A
【例4】已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉-KI试纸上,试纸变蓝色。
下列判断正确的是
( )
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉-KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
【解析】由①可知,KMnO4的氧化性强于Cl2的氧化性;由②可知,Cl2的氧化性强于Fe3+的氧化性;由③可知,Fe3+的氧化性强于I2的氧化性。所以A选项正确;上述三个反应都是氧化还原反应;由于Cl2的氧化性强于I2的氧化性,所以Cl2可以使湿润的淀粉-KI试纸变蓝;实验②只证明了Fe2+的还原性。A正确。
【答案】A
【解答策略】在氧化还原反应中,物质氧化性、还原性强弱的比较主要是根据氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性。找对氧化剂、氧化产物,还原剂、还原产物是解答这一类试题的关键。
考点3.与氧化还原反应有关的离子方程式正误判断和离子共存问题(以下选取与氧化还原反应有关的选项进行分析)
(1)与氧化还原反应有关的离子方程式正误判断

【解析】Fe(OH)2具有还原性,稀硝酸具有氧化性,氢氧化亚铁会被氧化生成Fe3+,该离子方程式错误。
【答案】错误

【解析】Ca(ClO)2溶液具有强的氧化性,SO2具有强的还原性,所以会发生氧化还原反应。S元素变为+6价,Cl元素变为-1价。该离子方程式错误。
【答案】错误
(2)与氧化还原反应有关的离子共存问题
【例7】在下列给定条件的溶液中,一定能大量共存的离子组是
( )

【答案】B中离子不共存
【例8】下列分子或离子在指定的分散系中能大量共存的一组是
( )
B.空气:C2H2、CO2、SO2、NO
【解析】B中NO易被空气中氧气氧化生成NO2,不能共存; D中高锰酸根在酸性条件下具有强氧化性,葡萄糖具有还原性,能发生氧化还原反应,不能大量共存。
【答案】B、D中微粒都不共存。

考点4.守恒思想
(1)运用守恒思想计算电子转移的数目

( )
A.10 mol B.11 mol
C.12 mol D.13 mol
【解析】对反应进行分析得知,氧化剂为Cu(IO3)2,得电子的原子有铜原子和碘原子,1 mol Cu(IO3)2中Cu原子得电子为1 mol,2 mol I原子得电子为10 mol,总共得电子为11 mol。另析:也可从还原剂失电子入手。
【答案】B
【例10】从矿物学资料查得,一定条件下自然界存在如下反应:

( )
A.Cu2S既是氧化产物又是还原产物
B.5 mol FeS2发生反应,有10 mol电子转移
D.FeS2只作还原剂
【解析】对反应进行分析得知,氧化剂为CuSO4,FeS2既作氧化剂又作还原剂, FeS2中S元素的化合价为-1价。在该反应中,5 mol FeS2中的3 mol S原子化合价从-1价升高到+6价,即电子转移的物质的量为21 mol。
【答案】C
【解答策略】氧化还原反应中电子转移数目的计算,主要依据元素化合价的变化和变价元素的总物质的量。化合价的变化是一个原子得失电子或电子对发生偏移,与右下角标没有关系。算总的化合价变化或电子的得失(电子对偏移)时,要把右下角标算上。
(2)运用守恒思想计算有关物质的量
【例11】锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为
( )
A.2 mol B.1 mol
C.0.5 mol D.0.25 mol
【解析】根据氧化还原反应中电子得失守恒的原则,当生成1 mol硝酸锌时,电子转移为2 mol(Zn从0价到+2价)。部分硝酸被还原生成硝酸铵, 当生成1 mol硝酸铵时,电子转移为8 mol(N从+5价到-3价),所以当生成 1 mol 硝酸锌时,被还原的硝酸的物质的量为0.25 mol。
【答案】D
【例12】硫代硫酸钠可作为脱氯剂,已知25.00 mL 0.100 mol·L-1Na2S2O3溶液恰好把224 mL(标准状况下)Cl2完全转化为Cl-,则 Na2S2O3将转化成
( )
A.S2-B.S

【解析】根据氧化还原反应中电子得失守恒的原则,25.00 mL 0.100 mol·L-1Na2S2O3溶液失去的电子应该

