以硫及其化合物为例的“知识脉络”法应用
安徽 尉言勋 房兴礼
以硫及其化合物为例的“知识脉络”法应用

“元素及其化合物”知识是高考化学命题的重要载体,掌握好元素化合物知识,有利于高考取得理想的成绩。硫是一种重要的非金属元素,相关化合物的性质及氧化还原反应的方程式较多,内容丰富,知识点多,涉及面广,学生难以系统掌握和运用。为帮助同学们巩固学习,现对硫及其化合物知识进行归纳总结。
一、知识脉络

等于224 mL(标准状况下)Cl2完全转化为Cl-时得到的电子,设最终生成S元素的化合价为+x价,即0.025 L×0.100 mol·L-1×2×(x-2)=0.224 L/22.4 L·mol-1×2。解得x=6。D正确。
【答案】D
【解答策略】与氧化还原反应有关的计算都以化合价升降守恒(电子转移守恒)为依据进行计算。即还原剂化合价升高总数(失电子总数)等于氧化剂化合价降低总数(得电子总数)。
(3)运用守恒思想进行配平
①直接对氧化还原反应进行配平
【例13】(试题节选)配平下面的化学方程式(将有关的化学计量数填入方框中):

【解析】在反应中,KMnO4中锰元素化合价降低,FeSO4中铁元素化合价升高,根据化合价升降守恒和元素守恒配平该方程式。

②补写反应物或生成物,并进行配平
【例14】(试题节选)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个配平的化学方程式。
【解析】通过分析可知,N2O为还原产物,FeSO4为还原剂、Fe(NO3)3和Fe2(SO4)3为氧化产物,HNO3为氧化剂。根据化合价升降守恒可得结果。


二、知识梳理
1.硫单质
(1)物理性质:游离态的硫存在于火山喷口附近或地壳的岩层里,淡黄色固体,不溶于水,微溶于酒精,易溶于CS2(用于洗去试管壁上的硫);硫有多种同素异形体:如单斜硫、斜方硫、弹性硫等。
(2)化学性质:硫原子最外层有6个电子,较易得电子,表现较强的氧化性。
①与金属反应(与变价金属反应,均是将金属氧化成低价态)

②与非金属反应
③与化合物的反应
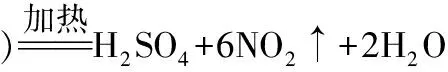

(3)用途:用于制造硫酸、硫化天然橡胶,也用于制造“三药一柴”(医药、火药、农药和火柴)的原料。
2.硫的氢化物
(1)物理性质:无色、有臭鸡蛋气味的有毒气体,能溶于水,密度比空气略大。
(2)化学性质
①弱酸性:二元弱酸,能与NaOH溶液反应。


②可燃性


③强还原性:可被常见氧化剂氧化。


3.二氧化硫
(1)物理性质
SO2是无色、有刺激性气味的有毒气体,密度比空气大,容易液化,易溶于水(1∶40)。
(2)化学性质
①酸性氧化物通性:与水、碱性氧化物以及某些弱酸盐溶液反应。
②还原性:能被O2、X2(Cl2、Br2、I2)、KMnO4(H+)溶液等强氧化剂氧化。



④漂白性:与有色物质化合生成不稳定的无色物质而起漂白作用(可逆、非氧化还原反应),但见光、加热或长时间放置,不稳定物质又分解为原有色物质和SO2。

4.三氧化硫
(1)物理性质
SO3的熔点16.8℃,沸点44.8℃,标准状况下SO3为晶体。具有酸性氧化物的通性,遇水剧烈反应生成硫酸并放出大量的热,气态SO3是具有强刺激性臭味的有毒气体。
(2)化学性质
SO3是一种酸性氧化物,具有酸性氧化物的通性,与H2O、CaO、Ca(OH)2等发生反应。
5.硫酸
(1)物理性质:纯硫酸是一种无色粘稠的液体,常用的浓硫酸中H2SO4的质量分数为98.3%,其密度为 1.84 g·cm-3,物质的量浓度为18.4 mol·L-1。硫酸是一种高沸点、难挥发的强酸。
【注意】浓硫酸溶解时放出大量的热,稀释时应将浓硫酸沿器壁慢慢加入水中,边加边搅拌。
(2)浓H2SO4的特性
①吸水性(常用作干燥剂)
a.中学化学中常用浓H2SO4干燥的气体有:H2、O2、CO2、SO2、Cl2、HCl等。
b.不能用浓硫酸干燥的气体有:碱性气体,如NH3;还原性气体,如H2S等。
②脱水性:指浓H2SO4将有机物里的氢、氧元素按原子个数2∶1的比例脱去水的性质。
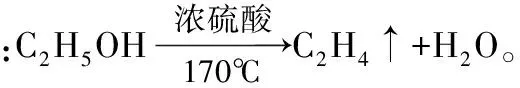
③强氧化性
a.常温下,铁、铝遇浓H2SO4发生“钝化”,因为表面生成一层致密的氧化膜,所以常温下可用铝槽车装运浓硫酸。




6.酸雨的形成和防治

酸雨危害:①直接引起人的呼吸系统疾病;②使土壤酸化,损坏森林;③腐蚀建筑结构、工业装备,电信电缆等。
酸雨防治:要防治酸雨的污染,最根本的途径是减少人为的污染物排放。因此研究煤炭中硫资源的综合开发与利用、采取排烟脱硫技术回收二氧化硫、寻找替代能源、城市煤气化、提高燃煤效率等都是防止和治理酸雨的有效途径。
三、典型例题解析
1.硫的氧化物性质的考查
例1(改编)下列有关硫的氧化物性质的说法中错误的是
( )
A.SO2和SO3混合气体通入Ba(NO3)2溶液均可得到BaSO3和BaSO4
B.二氧化硫的水溶液中滴加氯化钡无现象,再加入 0.5 mL 3%的过氧化氢后产生沉淀
C.将足量二氧化硫通入酸性高锰酸钾溶液中,溶液褪色,说明二氧化硫具有还原性
D.二氧化硫能漂白某些有色物质,是因为与有色物质化合生成不稳定的无色物质
【解析】SO2和SO3混合气体通入Ba(NO3)2溶液中,由于硝酸根在酸性情况下具有强氧化性,所以产物只有BaSO4,A错误。SO2被H2O2氧化为H2SO4,然后与BaCl2反应产生沉淀,B正确;SO2被酸性高锰酸钾溶液氧化为K2SO4,KMnO4转化为MnSO4,故溶液褪色,C正确; SO2的漂白具有可逆、非氧化还原反应的特点,与有色物质化合生成不稳定的无色物质,D正确。
【答案】A
2.硫的氢化物性质的考查
例2(2012上海)和氢硫酸反应不能产生沉淀的是
( )
A.Pb(NO3)2溶液 B.Na2S溶液
C.CuSO4溶液 D.H2SO3溶液

【答案】B
3.浓硫酸的性质考查
例3将一定量的锌与100 mL 18.5 mol·L-1浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6 L(标准状态)。将反应后的溶液稀释至1 L,测得溶液的pH=1,则下列叙述中错误的是
( )
A.气体A为SO2和H2的混合物
B.气体A中SO2与H2的体积比为5∶1
C.反应中共消耗Zn 97.5 g
D.反应中共转移电子3 mol
【答案】B
4.工业制硫酸原理的考查
例4(2016上海)在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室。下列说法错误的是
( )
A.a、b两处的混合气体成分含量相同,温度不同
B.c、d两处的混合气体成分含量相同,温度不同
C.热交换器的作用是预热待反应的气体,冷却反应后的气体
D.c处气体经热交换后再次催化氧化的目的是提高SO2的转化率
【解析】根据装置图可知,从a进入的气体含有SO2、O2、N2等的冷气,经过热交换器后从b处出来的是热的气体,成分与a处相同,A正确;在c处出来的气体SO2、O2在催化剂表面发生反应产生的含有SO3及未反应的SO2、O2等气体,该反应是放热反应,当经过热交换器后被冷的气体降温,SO3变为液态,故c、d两处含有的气体的成分不相同,B错误;热交换器的作用是预热待反应的冷的气体,同时冷却反应产生的气体,为SO3的吸收创造条件,C正确;c处气体经过热交换器后再次被催化氧化,目的就是使未反应的SO2进一步反应产生SO3,从而可以提高SO2的转化率,D正确。

(作者单位:安徽省砀山四中,安徽省砀山二中)
宁夏育才中学)

