天门冬对氟中毒大鼠认知行为能力的影响及机制
刘洋,李艳菊,唐东昕,王宁,刘振华,王飞清
(1贵阳中医学院第一附属医院,贵阳550001;2贵州医科大学附属医院;3贵州省骨科医院;4贵州省人民医院)
天门冬对氟中毒大鼠认知行为能力的影响及机制
刘洋1,李艳菊2,唐东昕1,王宁3,刘振华4,王飞清1
(1贵阳中医学院第一附属医院,贵阳550001;2贵州医科大学附属医院;3贵州省骨科医院;4贵州省人民医院)
目的探讨天门冬水煎剂灌胃对氟中毒大鼠认知行为能力的影响,并探讨其作用机制。方法将60只SD大鼠分成5组各12只,模型对照组和天门冬低、中、高剂量组给予含氟50 mg/kg的玉米饲料制作氟中毒大鼠模型,对照组给予普通饲料喂养。天门冬低、中、高剂量组在大鼠食用含氟饲料当天开始,每天给予天门冬水煎剂3、6、12 g/kg灌胃1次,连续90 d。实验结束前7 d采用Morris水迷宫法检测各组大鼠认知行为能力;分离血清和脑组织,用黄嘌呤氧化酶法测定血清和脑组织中SOD活性,硫代巴比妥酸法测定血清和脑组织中MDA含量。结果空间探索实验显示,模型对照组和天门冬低、中、高剂量组大鼠首次穿越平台时间大于对照组,穿越平台次数和穿越平台区时间少于对照组,天门冬高剂量组大鼠首次穿越平台时间少于中、低剂量组,穿越平台次数和穿越平台区时间高于中、低剂量组(P均<0.05)。模型对照组和天门冬低、中、高剂量组大鼠血清和脑组织SOD水平低于对照组,模型对照组低于天门冬低、中、高剂量组,天门冬高剂量组高于中、低剂量组(P均<0.05)。模型对照组和天门冬低、中、高剂量组大鼠血清和脑组织MDA水平高于对照组,模型对照组高于天门冬低、中、高剂量组,天门冬高剂量组低于中、低剂量组(P均<0.05)。结论氟中毒可导致大鼠血清及脑组织中氧化与抗氧化水平紊乱,影响大鼠的认知行为能力;天门冬水煎剂灌胃可调整氟中毒大鼠血清及脑组织中的氧化水平与抗氧化水平,改善大鼠的认知行为能力。
氟中毒;天门冬;丙二醛;超氧化物歧化酶;氧化应激;认知行为能力;脑损伤;中药
流行病学调查显示,氟化物蓄积于脑组织可引起大脑损伤、智力下降、学习记忆功能损害及行为障碍[1~4]。研究[5]发现,氟引起脑损伤与体内的自由基、脂质过氧化物水平明显相关。我们的前期研究发现,中草药天门冬具有抗氧化、抗衰老、抗凋亡等作用[6~8],而天门冬能否通过较强的清除氧化应激产物达到拮抗氟的毒性,目前尚无定论。2016年12月~2017年2月,我们构建了氟中毒大鼠模型,观察天门冬对大鼠认知行为能力的影响,并探讨其作用机制,为中草药防治地方性氟中毒脑损伤提供实验依据。
1 材料与方法
1.1 材料 清洁级SD大鼠60只,雌雄各半,体质量90~100 g,由贵州医科大学动物实验中心提供,适应性喂养1周后用于实验。天门冬购于贵阳仁济堂,取天门冬50 g加入500 mL水,沸水煎煮2次,煮沸1 h,抽滤,用水补足减少的质量,药液在70 ℃减压浓缩,得到浓度为1 g/mL的天门冬水煎剂,2~8 ℃冰箱保存备用。超氧化物歧化酶(SOD)和丙二醛(MDA)检测试剂盒购自南京建成生物工程研究所,氟化钠(分析纯)购自无锡市展望化工试剂有限公司;pF-1型氟离子选择性电极为上海精密科学仪器有限公司产品;Morris水迷宫图像自动采集和处理系统为中科院药物研究所产品。
1.2 动物分组及处理 将大鼠随机分为模型组48只和对照组12只,对照组给予普通饲料喂养,模型组自由食用模拟氟病区配方的原煤加拌泥煤烘烤的玉米饲料(饲料内含氟50 mg/kg),连续90 d。以模型组尿氟和骨氟含量高于对照组为模型构建成功。将模型组48只大鼠分为模型对照组和天门冬低、中、高剂量组各12只,天门冬低、中、高剂量组在大鼠食用含氟饲料当天开始每天给予天门冬水煎剂3、6、12 g/kg灌胃1次,连续90 d。
1.3 认知行为能力观察 采用Morris水迷宫实验。实验结束前第7天开始,连续4 d对大鼠实施定向航行实验,观察大鼠在不同象限寻找平台的时间。24 h后行空间探索实验,撤除平台,将各组大鼠从平台对侧象限放入水中,记录其在60 s内首次穿越平台时间、穿越平台次数以及在平台所在象限停留时间。
1.4 血清和脑组织SOD、MDA检测 实验第90天,股动脉取血处死各组大鼠,离心分离血清,低温保存备用。取脑组织,加入生理盐水制成10%的组织匀浆,离心取上清,再用生理盐水按1∶9稀释成1%组织匀浆,待测。采用黄嘌呤氧化酶法测定SOD活性,硫代巴比妥酸法测定MDA含量,具体步骤严格按照试剂说明书操作。
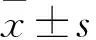
2 结果
2.1 各组大鼠认知行为能力比较 模型对照组和天门冬低剂量组首次穿越平台时间较对照延长,天门冬中、高剂量组首次穿越平台时间较模型对照组和天门冬低剂量组缩短(P均<0.05)。对照组穿越平台次数较其余各组增多,天门冬高剂量组穿越平台次数多于中、低剂量组(P均<0.05);对照组平台停留时间较模型对照组和天门冬低剂量组延长,天门冬高剂量组平台停留时间较中、低剂量组延长(P均<0.05)。见表1。

表1 各组大鼠空间探索实验结果比较
注:与对照组比较,*P<0.05;与模型对照组比较,#P<0.05;与天门冬低剂量组比较,△P<0.05。
2.2 各组血清SOD、MDA水平比较 各模型组血清SOD水平低于对照组,模型对照组血清SOD水平低于天门冬中、高剂量组,天门冬高剂量组血清SOD水平高于中、低剂量组(P均<0.05)。各模型组血清MDA水平高于对照组,模型对照组血清MDA水平高于天门冬各剂量组,天门冬组高剂量组血清MDA水平低于中、低剂量组(P均<0.05)。见表2。
2.3 各组脑组织SOD、MDA水平比较 各模型组脑组织SOD水平低于对照组,模型对照组脑组织SOD水平低于天门冬中、高剂量组,天门冬高剂量组脑组织SOD水平高于中、低剂量组(P均<0.05)。

表2 各组血清SOD和MDA水平比较
注:与对照组比较,*P<0.05;与模型对照组比较,#P<0.05;与天门冬高剂量组比较,△P<0.05。
各模型组脑组织MDA水平高于对照组,模型对照组脑组织MDA水平高于天门冬各剂量组,天门冬高剂量组脑组织MDA水平低于中、低剂量组(P均<0.05)。见表3。

表3 各组脑组织SOD和MDA水平比较
注:与对照组比较,*P<0.05;与模型对照组比较,#P<0.05;与天门冬高剂量组比较,△P<0.05。
3 讨论
动物实验证实,过量摄入氟的大鼠学习记忆能力显著下降。氟离子可通过血脑屏障蓄积于脑组织造成脑损伤,致使脑组织代谢、酶活性、学习记忆能力等异常改变,而脂质过氧化作用被认为是氟中毒的机制之一[9,10]。氟化物蓄积可消耗体内的抗氧化物质和自由基清除酶类,导致抗氧化水平与自由基之间失去平衡,造成机体组织损伤[11~13]。氟对脑组织的损伤作用逐渐受到人们重视。氟在大脑内蓄积可直接损伤脑组织,从而影响记忆和思维能力[14,15]。研究[16]发现,饮用不同剂量氟化钠溶液的小鼠学习记忆能力降低,并与染氟剂量明显相关。脑组织富含不饱和脂肪酸,是氟化物损伤的主要靶器官,脑组织又是耗氧量最多的器官,容易产生活性氧,进一步影响脑的正常生理功能[17]。氟中毒对大脑认知行为能力改变可能是通过氟中毒致大脑氧化应激损伤。本研究结果发现,模型对照组脑组织SOD水平明显低于对照组,模型对照组脑组织MDA含量明显高于对照组。
针对氟中毒致氧化应激的抗氧化药物研究较多,主要是利用一些矿物质微量元素和维生素等治疗慢性氟中毒[18,19]。近年来,具有抗氧化作用的中草药逐渐用于防治氟中毒的研究。我们的前期实验[6~8]发现,天门冬具有明显抗氧化作用。本实验结果显示,大鼠血清SOD活力增高,血清MDA含量降低,机体抗氧化能力得到提升,且高剂量组效果更佳。本实验结果显示,对氟中毒大鼠模型给予天门冬水煎剂灌胃,可提高大鼠脑组织SOD活力,降低脑组织MDA含量,脑组织抗氧化能力得到提升,且高剂量组效果更佳。水迷宫空间探索实验结果显示,天门冬各剂量组首次穿越平台时间较模型对照组缩短,穿越平台次数增加,穿越平台区时间延长。表明天门冬水煎剂灌胃可降低大脑组织氧化水平,提高大脑抗氧化能力,并进一步改善大鼠的认知行为能力。
综上所述,氟中毒可降低大鼠血液和脑组织SOD水平,提高大鼠血液和脑组织MDA水平,降低大鼠认知行为能力;天门冬水煎剂灌胃可降低血液和脑组织中MDA水平,提高血液和脑组织SOD水平,改善大鼠的认知行为能力。这为今后中草药用于氟中毒脑损伤提供了实验依据。
[1] Editorial. Fluoride and intelligence[J]. Fluoride, 2000,433(1):49-52.
[2] Wang SX, Wang ZH, Cheng XT, et al. Arsenic and Fluoride exposure in drinking water: children′s IQ and growth in Shanyin Country, Shanxi Province, China[J]. Environmental Health Perspectives, 2007,115(4):643-647.
[3] Lu Y, Sun ZR, Wu LN, et al. Effect of high-fluoride water on intelligence in children[J]. Fluoride, 2000,33(2):74-78.
[4] Xiang Q, Liang Y, Chen L, et al. Effect of fluoride in drinking water on children′s intelligence[J]. Fluoride, 2003,36(2):84-94.
[5] Chinoy NJ. Fluoride stress on antioxidant defence systems[J]. Fluoride, 2003,36(3):138-141.
[6] 李艳菊,丁文,李琴山,等.贵州产天冬总皂苷清除氧自由基能力的研究[J].医药导报,2012,31(7):874-876.
[7] 李艳菊,李琴山,田硕,等.天冬总皂苷对D-半乳糖致衰老大鼠肾脏p53基因表达的影响[J].中国老年学杂志,2012,32(18):3961-3963.
[8] 李艳菊,王季石,李琴山,等.天冬总皂苷对衰老大鼠脾脏Bcl-2基因表达水平的影响[J].时珍国医国药,2012,23(5):1192-1193.
[9] Wang YN, Xiao KQ, Liu JL, et al. Effect of long term fluoride exposure on lipid composition in rat liver[J]. Toxicology, 2000,146:161-169.
[10] Guan ZZ, Xiao KQ, Zheng XY, et al. Changed celluar membrane lipid composition and lipid perox idation of kidney in rats with chronic fluorosis[J]. Arch Toxicol, 2000,74:602-608.
[11] Sargis RM, Subbmah PV. Protection of membrane cholesterol by sphingomyelin against flee radical-mediated oxidation[J]. Free Radic Biol Med, 2006,40(12):2092-2102.
[12] Stadtman ER, Levine RL. Free radical mediated oxidation of free amino acids and amino acid residues in proteins[J]. Amino Acids, 2003,25(3-4):207-218.
[13] 刘文俊,魏清宇,邱建东,等.氟中毒与氧化应激相关性的研究进展[J].贵州畜牧兽医,2010,34(1):15-16.
[14] Trivedi MH, Verma RJ, Chinoy NJ, et al.Effect of high fluoride water on children′s intelligence in India[J]. Fluoride, 2007,40(2):178-183.
[15] Lin CC, Huang JF, Tsai LY, et al. Selenium,iron,copper,and zinc levels and copper-to-zinc ratios in serum of patients at different stages of viral hepatic diseases[J]. Biol Trace Elem Res, 2006,109(1):15-24.
[16] Bhatnagar M, Rao P, Sushma J, et al. Neurotoxicity of fluoride: neurodegeneration in hippocampus of female mice[J]. Indian J Exp Biol, 2002(5):546 -554.
[17] Shanthakumari D, Srinivasalu S, Subramanian S. Effect of fluoride intoxication on lipidperoxidation and antioxidant status in experimental rats[J]. Toxicol, 2004,204(2-3):219-228.
[18] Thangapandiyan S, Mihonprabu S. Epigallocateehin gallate effectively ameliorate fluoride induced oxidative stress and DNA damage in the liver of rats[J]. Can J Physiol Pharmacol, 2013,91(7):528-537.
[19] Nabavi SF, Nabavi SM, Latifi AM, et al. Mitigating role of quercetin against sodium fluoride induced oxidative stress in the rat brain[J]. Pharm Biol, 2012,50(11):1380-1383.
10.3969/j.issn.1002-266X.2017.42.010
R994.6
A
1002-266X(2017)42-0037-03
贵州省科技合作计划项目(黔科合LH字2016-7511号,黔科合基础2016-1019);贵州省教育厅青年科技人才成长项目(黔教合KY2016-190)。
王飞清(E-mail: cnwangfeiqing2006@126.com)
2017-02-19)

