非融合绿色荧光蛋白标记EV71型人肠道病毒的构建
耿磊,窦烨,王清路
(齐鲁医药学院,山东淄博255213)
非融合绿色荧光蛋白标记EV71型人肠道病毒的构建
耿磊,窦烨,王清路
(齐鲁医药学院,山东淄博255213)
目的构建非融合绿色荧光蛋白(EGFP)标记的肠道病毒71型(EV71),为EV71抗病毒机制研究及抗病毒药物的筛选提供方法。方法取野生型病毒EV71,在EV71基因组的3D蛋白编码区后添加HBV的link序列,将EGFP基因连入link与EV71型病毒3′非翻译区之间,构建EGFP标记的EV71病毒基因组,并转染横纹肌瘤RD细胞以获得EV71-link-EGFP重组病毒。采用PCR方法鉴定重组病毒中link、EGFP位置。感染RD细胞后24、48、72、96、120、144和168 h时收获病毒,采用组织半数感染量法测定病毒滴度,绘制病毒生长曲线,比较重组病毒与野生型病毒的生长动力学。RT-PCR测定EGFP转录表达。将重组病毒感染RD细胞后72 h裂解,采用Western blotting法检测RD细胞中GFP、P1蛋白的表达情况。重组病毒感染RD细胞后,经过13轮传代,Western blotting法检测EGFP基因稳定性。结果RD细胞内表达较强的GFP荧光,病毒感染细胞后病毒的mRNA正常表达,重组病毒中link序列、EGFP基因链接位置正常,证实EV71-link-EGFP重组病毒拯救成功。重组病毒滴度的曲线峰值与野生型病毒滴度的峰值相同。重组病毒中EGFP的表达在48 h时最高。重组病毒中GFP和P1蛋白表达正常稳定。经过13轮传代,第13代重组病毒表达的GFP蛋白与第1代无明显差别。结论通过添加link序列成功构建了非融合表达的EV71-link-EGFP重组病毒,可在RD细胞中良好生长并高效表达EGFP,且具有稳定的遗传性。
人肠道病毒;肠道病毒71型;绿色荧光蛋白;荧光标记;基因重组
肠道病毒属于小RNA病毒科,分为肠道病毒A、B、C、D共4种类型。肠道病毒71型(EV71)属于HEV-A型,其感染后主要引起手足口病,还能引起无菌性脑膜炎、脑干脑炎和麻痹型脊髓灰质炎等多种与神经系统相关的疾病。自1957年首次被报道以来,EV71已引发全球范围内的10多次爆发与流行[1,2],主要通过粪口传播,还可通过飞沫传播,其他则以隐性感染为主[3]。目前,临床上尚缺乏特异高效的EV71抗病毒药物,只能以对症支持治疗为主[4]。因此,构建EV71重组病毒对于研究EV71的致病机制及研制抗病毒药物具有重要意义。利用荧光蛋白对病毒结构蛋白进行标记或使其伴随病毒结构蛋白同时表达,是目前构建荧光病毒的一种常用方法,有助于对病毒侵染细胞的过程和繁殖状况进行观察。研究发现,将增强型绿色荧光蛋白(EGFP)基因连入EV71病毒基因组5′端后,可实现EGFP与病毒蛋白的融合表达,但添加的EGFP基因在表达成绿色荧光蛋白(GFP)后,与病毒蛋白呈融合状态,可能会影响病毒蛋白的成熟及组装效率,进而影响病毒的繁殖[5]。2015年1月~2017年3月,我们在EV71病毒基因组3D蛋白编码区后添加HBV的非编码link序列,构建EGFP标记的EV71重组病毒,以既实现EGFP与病毒蛋白的非融合表达,又促进病毒蛋白的稳定表达,为新型抗病毒药物的筛选提供方法。
1 材料与方法
1.1 材料与试剂 横纹肌瘤细胞RD细胞株由本实验室保存培养;大肠杆菌DH5α为本实验室保存;pEGFPN1-EV71-GFP载体由本实验室构建。DNA Marker、rTaq DNA聚合酶及限制性内切酶购自宝生物工程(大连)有限公司;DNA回收试剂盒、质粒抽提试剂盒(B型质粒小量提取试剂盒)、LB培养基购自上海生工生物工程有限公司;EV71病毒P1蛋白和EGFP蛋白单抗购自Abcam公司;NC膜其他试剂等均国产;青霉素、链霉素、卡那霉素购自北京索莱宝公司;EZfusion同源重组酶购自上海捷瑞生物有限公司。PCR引物合成和DNA序列测定由宝生物工程(大连)有限公司完成。
1.2 携带EGFP基因的EV71病毒基因组的构建 根据野生型病毒EV71型(GenBank: JF738002.1)全长序列分析,选择在病毒基因组的第7 218位碱基后插入来源于HBV两编码基因之间的link序列,link序列之后插入EGFP基因序列(自带终止密码子TTA),最后连入EV71型病毒3′端非翻译区,即第7 218位以后的序列,见图1。在全基因组序列的5′端添加SacⅠ酶切位点,3′端添加NotⅠ酶切位点。根据EV71-7 218 bp序列、link序列、EGFP序列以及7 218 bp以后序列,分别设计引物,通过PCR方法获得各个片段,相邻片段间有20 bp的相同碱基。将PCR产物与用SacⅠ和NotⅠ线性化的pEGFP-N1载体等比例混合,用EZfusion同源重组酶处理后转化大肠杆菌,即获得重组EV71型病毒基因组。

注:UTR为非翻译区;link为 HBV两编码基因之间的DNA序列。
图1EV71-link-EGFP重组病毒基因组结构
1.3 重组病毒的拯救 用大提试剂盒提取pEGFP-N1-EV71-link-EGFP质粒,按照Lipofectamine2000转染试剂说明书,将大提的质粒转染至生长为70%的RD细胞培养板中(6孔板),转染剂量为2.5 μg,6 h后换为含有质量分数为3%胎牛血清的DMEM维持液,并将转染的6孔板置于37 ℃、5%CO2孵箱中培养72 h,使质粒能够在细胞内更有效地转录病毒基因组RNA。72 h后换为2%的DMEM维持液,并将细胞转移到33 ℃、5%CO2孵箱中培养72 h。为了获得更多的病毒,在33 ℃、5%CO2培养3 d后的细胞,以1∶3的比例传代到细胞培养瓶中,37 ℃、5%CO2培养48 h。待细胞融合达到80%左右时,换为2%的DMEM维持液,转入33 ℃、5%CO2孵箱中进行培养,3 d后收取细胞和上清,经37 ℃与-80 ℃反复冻融3次,混合后于3 000 r/min离心5 min,0.45 μm的滤膜过滤,将收获的病毒命名为EV71-link-EGFP。
1.4 EV71-link-EGFP重组病毒的鉴定
1.4.1 重组病毒mRNA表达检测 将拯救的重组病毒EV71-link-EGFP及其野生型病毒分别接种于生长至70%的RD细胞中,2 h后用PBS洗1遍,换为DMEM,在5%CO2、37 ℃环境中继续培养。72 h后弃掉培养液,用PBS清洗细胞2遍,然后用冷无水乙醇固定细胞。30 min后加入抗P1蛋白的血清,在室温下作用2 h后用PBS洗涤细胞3次,并加入1∶200稀释的FITC标记的羊抗鼠IgG,于室温中避光作用1 h,用PBS洗涤细胞3次,5 min/次,在倒置荧光显微镜下观察并拍照。
1.4.2 重组病毒link、EGFP序列检测 采用TRIzol法。提取细胞总RNA,利用TaKaRa反转录试剂盒获得cDNA,以cDNA为模板,用引物EV71F(5′-GCAATTAGATCCGTCCCAATAGG-3′)和linkR(5′-TTACCCTCGGATCCAACAAGG-3′)鉴定link序列的链接,用引物EV71F与GFPR(5′-TGGCATCGCCCTCGCCCTCG-3′)鉴定GFP基因的链接,以证实EGFP基因链接位置是否正常。
1.5 EV71-link-EGFP重组病毒生长动力学测定 将重组病毒和野生型病毒分别按MOI 0.01/孔的感染量接种于生长至单层的RD细胞中,并在感染后24、48、72、96、120、144、168 h时收获病毒。将不同时间点收获的病毒分别用采用组织半数感染量(TCID50)法测定病毒滴度,绘制病毒生长曲线,比较重组病毒与野生型病毒的生长动力学。
1.6 EV71-link-EGFP重组病毒报告基因表达测定 将重组病毒按MOI 0.01/孔剂量感染24孔板中的RD细胞,分别于感染后24、48、72、96、120、144、168 h时,应用RT-PCR方法测定EGFP转录表达,以评价重组病毒表达EGFP基因的能力。
1.7 EV71-link-EGFP重组病毒中GFP、P1蛋白表达检测 将重组病毒及其野生型病毒的RD细胞在72 h后裂解,采用Western blotting法检测第1代、第3代RD细胞中GFP、P1蛋白的表达情况,以进一步验证重组病毒表达EGFP基因的能力。
1.8 EV71-link-EGFP重组病毒遗传稳定性分析 将重组病毒(定义为P0)以MOI=0.01剂量感染RD细胞,感染96 h时收获病毒(定义为N1),之后将300 μL N1代病毒液加入到新鲜RD细胞中培养(定义为N2)。经过13轮类似的传代,TCID50方法测定病毒滴度,以评价插入的EGFP基因在重组病毒基因组中的遗传稳定性。
2 结果
2.1 EV71-link-EGFP重组病毒鉴定结果 荧光显微镜示,RD细胞内表达较强的FITC标记荧光,病毒感染细胞后,病毒的mRNA正常表达,证实EV71-link-EGFP重组病毒拯救成功。见图2。经引物EV71F和linkR鉴定,link序列链接正确。经引物EV71F与GFPR鉴定GFP基因链接,证实EGFP基因链接位置正常。
2.2 RD细胞中重组病毒生长动力学结果 RD细胞中EV71-link-EGFP病毒滴度的生长曲线峰值与野生型病毒滴度的峰值相同。见图3。
2.3 RD细胞中重组病毒报告基因表达动力学测定结果 RD细胞中EV71-link-EGFP重组病毒EGFP的表达在48 h时最高。见图4。
2.4 RD细胞中GFP、P1蛋白表达结果 Western blotting实验证实,第1代、第3代RD细胞中GFP和P1蛋白表达正常稳定。见图5。

注:M为Marker;1为GFP;2为link。
图2RD细胞内EV71mRNA表达情况
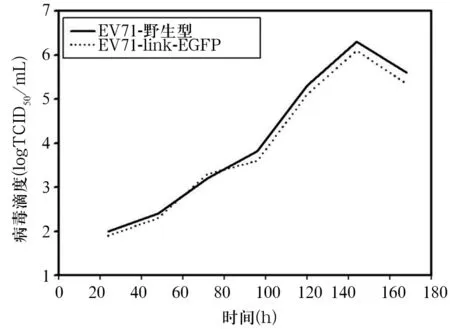
图3 RD细胞中EV71-link-EGFP重组病毒生长曲线

图4 RD细胞中EV71-link-EGFP重组病毒

注:1为第1代病毒,2为第3代病毒。
图5EV71-link-EGFP重组病毒中GFP、P1蛋白表达结果(Westernblotting法)
2.5 重组病毒遗传稳定性结果 EV71-link-EGFP重组病毒在RD细胞上连续传代的过程中,第13代病毒表达的GFP与第1代无明显差别,并未发生病毒传代丢失EGFP基因等现象。见图6。

注:WT为野生型病毒;N1为第1代病毒蛋白;N13为第13代病毒蛋白。
图6EV71-link-EGFP重组病毒遗传稳定性结果
3 讨论
EV71病毒是诱发婴幼儿手足口病的主要病毒之一。人类是EV71惟一已知的自然宿主,10岁以下儿童为主要易感人群,主要通过粪口传播,还可通过飞沫传播,其他则以隐性感染为主[3,6]。EV71的基因组为约7.4 kb的单股正链RNA,仅含一个开放阅读框(ORF),编码含有2 193个氨基酸的多聚蛋白[7,8]。在EV71基因组的5′端和3′端,分别有约为745 nt的5′非编码区(UTR)和约为83 nt的3′非编码区[5,9]。目前EV71抗病毒药物的开发重点集中在阻止病毒与细胞膜吸附、侵入和脱壳,以及失活病毒的RNA复制酶RdRp(3D)[10,11]。构建荧光病毒有利于通过荧光定位直观观察病毒是否能够侵入细胞,进而用于药物抑制病毒侵染细胞具体环节的研究,从而研究药物是抑制病毒侵入还是抑制病毒繁殖。
利用各种荧光蛋白或其他物质对病毒结构蛋白进行标记,或者伴随病毒结构蛋白同时表达,可完成对病毒侵染细胞过程和繁殖状况的观察,也可为抗病毒药物筛选和作用机制研究提供帮助[12,13]。近年来,GFP已经成功地用于标记HBV、艾滋病病毒、腺相关病毒及疱疹病毒等多种病毒[14,15]。EGFP比GFP具有更强的荧光蛋白表达量,可更容易地检测病毒的侵染和繁殖。重组病毒基因组中的EGFP基因是荧光报告基因,其不仅可以直观地提供病毒侵入细胞的效率,还可以检测病毒在细胞内重新组装生成的情况。江军[16]制备了家蚕浓核病毒结构蛋白VP4与EGFP融合表达的荧光病毒样颗粒,为家蚕病毒的防治奠定了基础。彭莹等[17]构建了表达EGFP的巨细胞病毒Towne株,为研究巨细胞病毒致病机制和抗病毒药物筛选的新型工具提供了载体。朱守海等[5]将EGFP基因连入EV71病毒基因组5′端,实现了EGFP与病毒蛋白的融合表达,最后再利用2A酶活性去除GFP,使EV71病毒子代颗粒顺利组装。然而该设计中添加的EGFP基因在表达成GFP蛋白后,与病毒蛋白呈融合状态,可能会影响病毒蛋白的成熟及组装效率,进而影响病毒的繁殖。研究发现,通过添加HBV序列中link序列的方法,可避免EGFP蛋白对病毒蛋白表达的影响。
本研究利用生物信息学以及PCR、DNA片段连接等分子克隆技术构建荧光标记病毒,在EV71型病毒基因组的3D蛋白编码区后面添加HBV的link序列,而后将EGFP基因连入link与EV71型病毒3′非翻译区之间,从而构成荧光蛋白标记的病毒基因组。本研究发现,经引物EV71F和linkR鉴定,link序列链接正确;经引物EV71F与GFPR鉴定GFP基因链接,证实EGFP基因链接位置正常,表明EGFP序列连入了重组病毒的基因组预期位置;荧光显微镜示,RD细胞内表达较强的FITC标记荧光,病毒感染细胞后病毒的mRNA正常表达,证实重组病毒拯救成功;IFA示,EV71-link-EGFP病毒滴度的生长曲线峰值与野生型病毒滴度的峰值相同,表明病毒生长曲线与野生病毒株相似,不影响病毒翻译后的蛋白加工修饰;重组病毒EGFP的表达在48 h时最高,重组病毒中GFP、P1蛋白表达正常稳定,且在表达量比例上无明显差别,表明该病毒能够高效表达EGFP基因,拯救的重组病毒产生的EGFP也不影响子代病毒颗粒组装,表明插入的EGFP基因在连续传代过程中较为稳定。
由于EGFP基因对EV71病毒属于外源基因,对病毒自身繁殖来说并不是必须的,因此可能在病毒的传代过程中该基因被丢失。为了观察EGFP基因的遗传稳定性,我们将EV71-link-EGFP重组病毒在RD细胞上进行13次传代,以检查插入的EGFP基因在四株重组病毒基因组中的遗传稳定性。本研究结果显示,重组病毒在RD细胞上连续传代的过程中,第13代病毒表达的GFP与第1代无明显差别,并未发生病毒传代丢失EGFP基因等现象,表明重组病毒EV71-link-EGFP具有稳定的遗传性。
综上所述,通过生物信息学以及PCR、DNA片段连接等分子克隆技术成功构建了EV71-link-EGFP重组病毒,可在RD细胞中良好生长并高效表达EGFP,且能稳定遗传EGFP基因而不丢失,为借助酶标仪等相关仪器构建抗病毒药物的高通量筛选平台或研究该病毒的感染机制提供了高效的载体。
[1] Bible JM,Pantelidis P,Chan PK, et al. Genetic evolution of enterovirus 71: epidemiological and pathological implications[J]. Rev Med Virol, 2007,17(6):371-379.
[2] Xing W, Liao Q, Viboud C, et al. Hand, foot, and mouth disease in China, 2008-12: an epidemiological study[J]. Lancet Infect Dis, 2014,14(4):308-318.
[3] Solomon T, Lewthwaite P, Perera D, et al. Virology, epidemiology, pathogenesis, and control of enterovirus 71[J]. Lancet Infect Dis, 2010,10(11):778-790.
[4] 雷小英,彭东红.人副流感病毒的研究进展[J].儿科药学杂志,2012,18(11):54-59.
[5] 朱守海,王璐璐.肠道病毒71型(EV71)荧光病毒的构建[J].生物技术通报,2014,(7):179-183.
[6] Robinson CR, Doane FW, Rhodes AJ. Report of an outbreak of febrile illness with pharyngeal lesions and exanthem: Toronto, summer 1957; isolation of group A Coxsackie virus[J]. Can Med Assoc J, 1958,79(8):615-621.
[7] Ho M, Chen ER, Hsu KH, et al. An epidemic of enterovirus 71 infection in Taiwan. Taiwan Enterovirus Epidemic Working Group[J]. N Engl J Med, 1999,341(13): 929-935.
[8] Khanh TH, Sabanathan S, Thanh TT, et al. Enterovirus 71-associated hand, foot, and mouth disease, Southern Vietnam, 2011[J]. Emerg Infect Dis, 2012,18(12):2002-2005.
[9] Wu Y, Yeo A, Phoon MC, et al. The largest outbreak of hand; foot and mouth disease in Singapore in 2008: the role of enterovirus 71 and coxsackievirus A strains[J]. Int J Infect Dis, 2010,14(12):e1076-e1081.
[10] Wang X, Peng W, Ren J, et al. A sensor-adaptor mechanism for enterovirus uncoating from structures of EV71[J]. Nat Struct Mol Biol, 2012,19(4):424-429.
[11] Wu Y, Lou Z, Miao Y, et al. Structures of EV71 RNA-dependent RNA polymerase in complex with substrate and analogue provide a drug target against the hand-foot-and-mouth disease pandemic in China[J]. Protein Cell, 2010,1(5):491-500.
[12] Costantini LM, Irvin SC, Kennedy SC, et al. Engineering and exploitation of a fluorescent HIV-1 gp120 for live cell CD4 binding assays[J]. Virology, 2015,476:240-248.
[13] Ohkura T, Minakuchi M, Sagai M, et al. Infection of the upper respiratory tract of hamsters by the bovine parainfluenza virus type 3 BN-1 strain expressing enhanced green fluorescent protein[J]. Virology, 2015,476:134-140.
[14] Campbell EM, Perez O, Melar M, et al. Labeling HIV-1 virions with two fluorescent proteins allows identification of virions that have productively entered the target cell[J]. Virology, 2007,360(2):286-293.
[15] 林园园.活细胞内示踪乙型肝炎病毒的实验研究[D].中华中科技大学博士学位论文,2009.
[16] 江军.家蚕浓核病毒BmDNV_1荧光假病毒粒子的制备及人博卡病毒VP2的纯化[D].中华中师范大学硕士学位论文,2012.
[17] 彭莹,张晓梅,雷雪明,等.荧光巨细胞病毒的构建及活性检测[J].山东大学学报(医学版),2009,47(2):28-32.
ConstructionofEV71genomelabeledbynon-fusionenhancedgreenfluorescentprotein
GENG Lei, DOU Ye, WANG Qinglu
(Qilu Medical University, Zibo 255213, China)
ObjectiveTo construct the Enterovirus 71 (EV71) labeled by non-fusion enhanced green fluorescent protein (EGFP) so as to provide a method for studying the anti-viral mechanism of EV71 and screening of antiviral drugs.MethodsThe EV71 genome labeled by EGFP was constructed by connecting non-fusion link-EGFP sequence in the back of 3D sequence and front of 3'-UTR, and then new EV71 virus was obtained by transferring EV71-link-EGFP plasmid into RD cell line. The location of link and EGFP sequence were identified by PCR. Virus titer was estimated with TCID50 methods at the 24, 48, 72, 96, 120, 144, and 168 h after RD cells were infected, respectively. The mRNA level was analyzed by RT-PCR. The recombinant virus was used to infect the RD cells and RD cells lysed after 72 h. The GFP and P1 protein expression was detected by Western blotting. After the recombinant virus infected RD cells, and after 13 rounds of passage, the EGFP gene stability was determined by Western blotting.ResultsEV71-link-EGFP recombinant virus was obtained via analyzing mRNA expression level, observing GFP fluorescence and locating link and EGFP site. The curve peak in recombinant virus was the same as the wild type virus. The GFP fluorescence value in recombinant virus was the highest at 48 h. GFP and P1 proteins were stably expressed in recombinant virus. GFP protein level in 13th generation recombinant virus had no significant difference as compared with that of the first generation.ConclusionEV71-Link-EGFP recombinant virus is constructed successfully via adding link sequence between 3D and EGFP sequence, which can grow well, effectively express EGFP gene in RD cells and has stable heredity.
human enterovirus; Enterovirus 71 type; green fluorescent protein; fluorescence labeling; genetic recombination
10.3969/j.issn.1002-266X.2017.42.006
Q784;R373.2
A
1002-266X(2017)42-0020-05
山东省高校中医药抗病毒协同创新中心基金资助项目(XTCX2014B01-07)。
耿磊(1974-),男,硕士,副教授,主要研究方向为抗病毒药物筛选。E-mail: 778175260@qq.com
王清路(1976-),男,博士,教授,主要研究方向为中医药抗病毒研究。E-mail: wql_zcq@126.com
2017-06-02)

