薯蓣皂苷对哮喘小鼠气道上皮细胞糖皮质激素受体表达的影响
李先茜,吴宁,余荣环,管超,徐婷,吴嘉熙
(上海市徐汇区中心医院,上海200031)
薯蓣皂苷对哮喘小鼠气道上皮细胞糖皮质激素受体表达的影响
李先茜,吴宁,余荣环,管超,徐婷,吴嘉熙
(上海市徐汇区中心医院,上海200031)
目的观察薯蓣皂苷对哮喘模型小鼠气道上皮细胞糖皮质激素受体GRα、GRβ表达的影响,探讨其对哮喘的抗炎作用机制。方法取哮喘模型小鼠气道上皮细胞,将其分为哮喘对照组(加入不含药物的培养基)、哮喘治疗组(加入含薯蓣皂苷的培养基)、哮喘治疗拮抗组(加入含薯蓣皂苷和GR拮抗剂RU486的培养基)。以正常小鼠气道上皮细胞为空白对照组。采用ELISA方法检测各组细胞培养基中IL-1、IL-6、TNF-α水平,实时荧光定量PCR法检测各组细胞中GRα、GRβ、HSP90 mRNA表达,Western blotting法检测各组GRα、GRβ、HSP90蛋白表达。结果哮喘对照组细胞培养基中IL-1、IL-6、TNF-α水平高于空白对照组,哮喘治疗组IL-1、IL-6、TNF-α水平低于哮喘对照组,哮喘治疗拮抗组IL-1、IL-6、TNF-α水平高于哮喘治疗组(P均<0.05)。哮喘治疗组GRα 、GRβ、HSP90 mRNA和蛋白表达低于空白对照组(P均<0.05);哮喘治疗组GRα蛋白表达高于哮喘对照组(P<0.05);GRβ、HSP90 mRNA和蛋白表达低于哮喘对照组(P均<0.05)。哮喘治疗拮抗组中GRα、GRβ、HSP90 mRNA和蛋白表达与模型对照组比较无统计学差异。结论薯蓣皂苷通过调节气道上皮细胞中GRα、GRβ和HSP90的表达量来发挥其在哮喘小鼠中的抗炎作用。
哮喘;薯蓣皂苷;气道上皮细胞;糖皮质激素受体;热休克蛋白90;小鼠
支气管哮喘(简称哮喘)是由多种细胞和细胞因子参与的慢性气道炎症性疾病。气道炎症导致气道损伤,平滑肌收缩,使易感者对各种激发因子具有气道高反应性,进而引起组织水肿,气道壁增生肥厚、结构异常,并引起气道狭窄,造成不可逆性气道阻塞。气道上皮损伤是引起气道高反应性的重要机制之一。糖皮质激素对哮喘的抗炎效应主要通过糖皮质激素受体(GR)来实现[1]。GR包括GRα和GRβ,糖皮质激素主要通过结合GRα发挥生物学效应。GRβ能与DNA结合,不能被糖皮质激素活化,并通过干扰GRα与DNA结合对GRα有拮抗作用,对糖皮质激素的生理功能具有负性调节作用,且可能与激素的耐药性有关[2~4]。GR的形成、激活及功能发挥与热休克蛋白90(HSP90)关系密切。HSP90可与GRα组成复合体,以激活前状态存在于细胞质内,并抑制其进入细胞核[5~7]。HSP90与糖皮质激素受体结合后可以抑制其发挥作用。然而糖皮质激素长期使用易造成激素依赖[8]。中医药在增加激素敏感性、减少激素用量及降低不良反应等方面具有明显优势。中药穿山龙具有活血祛风、化痰平喘的作用,临床用于治疗哮喘已取得良好效果[9]。现代药理研究显示,穿山龙具有抗氧化、抗炎作用,其主要成分薯蓣皂苷的结构与激素相似[10],可能具有与糖皮质激素竞争GR的能力,但目前国内外尚无相关研究。我们于2013~2016年观察了薯蓣皂苷对气道上皮细胞GR活性的影响,探讨其抗炎作用机制,为薯蓣皂苷治疗支气管哮喘提供实验依据。
1 材料与方法
1.1 材料 实验用气道上皮细胞来源于正常清洁型BALB/c小鼠和同类小鼠的哮喘模型(由中国科学院上海细胞所提供)。薯蓣皂苷(南京春秋生物工程有限公司),胎牛血清和DMEM高糖培养基(美国Invitrogen公司);兔抗鼠GRa、GRb、HSP90、β-actin抗体(SANTA公司)。IL-6、TNF-α、IL-1β的ELISA检测试剂盒由北京百灵克生物科技有限责任公司提供。
1.2 细胞分组与处理 取正常小鼠气道上皮细胞和哮喘小鼠气道上皮细胞,分别加入含10%小牛血清的RPMI1640高糖培养基,置于37 ℃、饱和湿度、体积分数5% CO2培养箱中常规培养;当细胞长满瓶底80%并贴壁后,加入0.25%胰酶消化,倒置显微镜下见细胞间隙增大、胞质回缩时消化终止,然后分瓶再培养;待进入对数生长期,弃去原培养液,用PBS冲洗后用于实验。将哮喘小鼠气道上皮细胞分为哮喘对照组、哮喘治疗组、哮喘治疗拮抗组,哮喘对照组加入不含药物的培养基中培养,哮喘治疗组加入含薯蓣皂苷10 μmol/L的培养基中培养1 h,哮喘治疗拮抗组加入含薯蓣皂苷注射液10 μmol/L和GR拮抗剂RU486 100 nmol/L的培养基中培养1 h。以正常小鼠气道上皮细胞作为空白对照组。
1.3 细胞上清液中IL-6、TNF-α、IL-1β水平检测 采用ELISA方法。收集细胞上清液,使用ELSIA试剂盒检测IL-6、TNF-α、IL-1β水平。
1.4 细胞中GRα、GRβ、HSP90 mRNA表达检测 采用实时荧光定量PCR法。按Triozol说明书提取各组细胞总RNA,逆转录合成cDNA。GRa、GRb、HSP90、GAPDH的引物由吉玛基因公司合成。GRa引物:上游5′-ACACAGGCTTCAGGTATCTT-3′,下游5′-ACTGCTTCTGTTGCCAAG-3′;GRb引物:上游5′-ACACAGGCTTCAGGTATCTT-3′,下游5′-CGCCAAGATTGTTGGGATGA-3′;HSP90引物:上游5′-GTCTGGGTATCGGAAAGCAAG-3′,下游5′-GTGAGGGTTGGGGATGATGTC-3′;内参GAPDH引物:上游5′-TGCACCACCAACTGCTTAGC-3′,下游5′-GGCATGGACTGTGGTCATGAG-3′。反应体系:MasterMix(2×)10 μL,上、下游引物各0.6 μL(10 μmol/L),cDNA 4 μL,H2O 4.8 μL,总体积20 μL。循环条件:95 ℃ 2 min;95 ℃ 15 s,61 ℃ 30 s,72 ℃ 20 s,共40个循环;72 ℃延伸10 min。反应结束后,记录相关Ct值。利用β-actin作为内参,计算GRα、GRβ、HSP90 mRNA的相对表达量。
1.5 细胞中GRα、GRβ、HSP90蛋白表达检测 采用Western blotting法。向细胞中加入细胞裂解液,离心取上清,蛋白定量后分别取50 μg蛋白加入上样缓冲液,95 ℃变性10 min。12%聚丙烯酰胺-SDS凝胶电泳后,电转移至硝酸纤维膜上,5%脱脂奶粉封闭,依次加入一抗、二抗,室温孵育2 h。TBST缓冲液洗涤,加入化学发光试剂,压片,显影,定影,照相。使用抗兔多克隆抗体检测GRα、GRβ、HSP90蛋白。以β-actin作为内参,计算GRα、GRβ、HSP90蛋白的相对表达量。
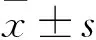
2 结果
2.1 各组细胞上清液中IL-1、IL-6、TNF-α水平比较 见表1。哮喘对照组细胞上清液中IL-1、IL-6、TNF-α水平高于空白对照组(P均<0.05),哮喘治疗组IL-1、IL-6、TNF-α水平低于哮喘对照组(P均<0.05),哮喘治疗拮抗组IL-1、IL-6、TNF-α水平高于哮喘治疗组(P均<0.05)。
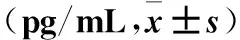
表1 各组细胞上清液中IL-1、IL-6、TNF-α水平比较
注:与空白对照组比较,*P<0.05;与哮喘对照组比较,#P<0.05。
2.2 各组细胞中GRα、GRβ、HSP90 mRNA表达比较 见表2。哮喘对照组GRα mRNA表达低于正常对照组,GRβ、HSP90 mRNA表达高于正常对照组(P均<0.05);哮喘治疗组GRα mRNA表达高于哮喘对照组,GRβ、HSP90 mRNA表达低于哮喘对照组(P均<0.05);哮喘治疗拮抗组GRα、GRβ、HSP90 mRNA表达与哮喘对照组无统计学差异(P均>0.05)。

表2 各组细胞中GRα、GRβ、HSP90 mRNA相对表达量比较
注:与空白对照组比较,*P<0.05;与哮喘对照组比较,#P<0.05。
2.3 各组细胞中GRα、GRβ、HSP90蛋白表达比较 见表3。哮喘对照组GRα蛋白表达低于空白对照组,GRβ、HSP90蛋白表达高于空白对照组(P均<0.05)。哮喘治疗组GRα蛋白表达高于哮喘对照组,GRβ、HSP90蛋白表达低于哮喘对照组(P均<0.05)。哮喘治疗拮抗组GRα、GRβ、HSP90蛋白表达与哮喘对照组无统计学差异(P均>0.05)。

表3 各组细胞中GRα、GRβ、HSP90蛋白水平比较
注:与空白对照组比较,*P<0.05;与哮喘对照组比较,#P<0.05。
3 讨论
糖皮质激素是截至目前控制哮喘最为有效的药物。它需要与GR特异性结合才能发挥抑制气道炎症作用。GR在肺内广泛存在[11],糖皮质激素主要通过结合GRα发挥生物学效应。糖皮质激素以扩散作用穿过细胞膜,与胞质内未激活的GRα相结合,使得HSP90与GRα分离,形成GRα-糖皮质激素复合体,进入细胞核。GRα-糖皮质激素复合体的作用机制包括:直接与激素应答基因启动区的糖皮质激素反应元件结合,激活抗炎蛋白编码的基因,诱导抗炎蛋白合成;与其他转录因子如NF-κB共同竞争环腺苷酸反应元件结合蛋白上的结合位点,调控转录因子介导的基因转录,产生炎症抑制作用;增加锌指蛋白36的表达,抑制IL-1、IL-6、TNF-α等与哮喘有关的细胞因子水平[12,13]。然而,布地奈德等糖皮质激素药物长期使用可引起诸多不良反应,反馈性减少促皮质激素和糖皮质激素的合成及释放,进一步加重GR数量减少,增加机体对激素的依赖性。中医认为,伏痰是哮喘发病的主要的内在因素,痰气瘀阻、肺失宣降为哮证的基本病机,痰、气、瘀为主要病理因素,三者胶结为患,既是哮喘发病过程中的病理产物,又是哮喘反复发作、病情发展的重要病理基础。其治疗应以化痰祛瘀、降气平喘为基本大法,使气血调畅、肺络宣通。中药穿山龙是薯蓣科薯蓣属植物穿龙薯蓣的根茎,具有活血舒筋、祛风除湿、化痰平喘之功。薯蓣皂苷为穿山龙的药物主要单体成分,具有抗炎、抗过敏、镇咳、平喘等多种药理作用[14,15]。临床将薯蓣皂苷用于治疗支气管哮喘已取得较好效果[16]。本研究显示,哮喘小鼠气道上皮细胞培养基中IL-1、IL-6、TNF-α水平高于正常,应用薯蓣皂苷作用后,IL-1、IL-6、TNF-α降低;使用GR拮抗剂RU486可以抵消薯蓣皂苷对IL-1、IL-6、TNF-α水平的影响。薯蓣皂苷与甾体激素类药物结构相近,是合成甾体激素的主要原料之一,因此可能具有与之竞争糖皮质激素受体的活性部位的能力,从而阻碍相关脏器对皮质激素的还原代谢。
GRα能与糖皮质激素结合发挥作用;GRβ能与DNA结合,不能被糖皮质激素活化,对GRα具有拮抗作用,对糖皮质激素的生理功能具有负性调节作用,且可能与激素的耐药性有关。故GRα和GRβ在哮喘发病时会升高,在薯蓣皂苷药物治疗时与GRα和GRβ发生特异性结合才能发挥抑制气道炎症作用。GRα的形成和功能的发挥又与HSP90的作用密切相关。在游离状态下GR以复合物的形式存在于细胞质内,该受体复合物以HSP90的作用最为重要,它可以抑制未结合激素的GRα进入细胞核内。当激素以扩散作用穿过细胞膜并与胞质内未激活的GRα相结合后,通过磷酸化作用引起构型改变,HSP90与GRα分离,使得GRα-糖皮质激素复合体活化,并得以进入细胞核内。进入细胞核内的GRα-糖皮质激素复合体可以发挥其生理功能。糖皮质激素最终抑制了IL-1、IL-6、TNF-α等与哮喘有关的细胞因子的基因转录。因此,GR在哮喘的炎症反应及治疗过程中具有重要作用。
本研究显示,哮喘小鼠气道上皮细胞中GRα、GRβ mRNA和蛋白表达水平低于正常气道上皮细胞,而HSP90 mRNA和蛋白表达高于正常气道上皮细胞;应用薯蓣皂苷后,细胞中GRα、GRβ mRNA和蛋白表达升高,HSP90 mRNA和蛋白表达降低;使用GR拮抗剂RU486可以抵消薯蓣皂苷对GRα、GRβ、HSP90 mRNA和蛋白表达的影响。
综上所述,薯蓣皂苷对支气管哮喘有一定的抗炎作用。薯蓣皂苷通过调节气道上皮细胞中GRα、GRβ和HSP90的表达来发挥其在哮喘模型小鼠中的抗炎作用。
[1] Ebrahimi H, Badalzadeh R, Mohammadi M, et al. Diosgenin attenuates inflammatory response induced by myocardial reperfusion injury: role of mitochondrial ATP-sensitive potassium channels[J]. J Physiol Biochem, 2014,70(2):425-432.
[2] Kino T, Su YA, Chrousos GP. Human glucocorticoid receptor (GR) isoform β: recent understanding of its potential implications in physiology and pathophysiology[J]. Cellular Molecular Life Sciences, 2012,66(21):3435-3448.
[3] Manda VK, Avula B, Ali Z, et al. Characterization of in vitro ADME properties of diosgenin and dioscin from Dioscoreavillosa[J]. Planta Med, 2013,79(15):1421-1428.
[4] Chen J, Zhang HF, Xiong CM, et al. Inhibitory effect of diosgenin on experimentally induced benign prostatic hyperplasia in rats[J]. J Huazhong Univ Sci Technolog Med Sci, 2016,36(6):806-810.
[5] Lin Y, Jia R, Liu Y, et al. Diosgenin inhibits superoxide generation in FMLP-activated mouse neutrophils via multiple pathways[J]. Free Radic Res, 2014,48(12):1485-1493.
[6] Nie C, Zhou J, Qin X, et al. Diosgenin induced autophagy and apoptosis in a human prostate cancer cell line[J]. Mol Med Rep, 2016,14(5):4349-4359.
[7] Koh EK, Yun WB, Kim JE, et al. Beneficial effect of diosgenin as a stimulator of NGF on the brain with neuronal damage induced by Aβ-42 accumulation and neurotoxicant injection[J]. Lab Anim Res, 2016,32(2):105-115.
[8] 田德禄.中医内科学[M].北京:中国中医药出版社,2005:78-88.
[9] 王德杰,刘兴国,张东.糖皮质激素受体的研究进展[J].现代生物医学进展,2010,8(10):1592-1594.
[10] Kim JE, Go J, Koh EK, et al. Diosgenin effectively suppresses skin inflammation induced by phthalic anhydride in IL-4/Luc/CNS-1 transgenic mice[J]. BiosciBiotechnolBiochem, 2016,80(5):891-901.
[11] Manda VK, Avula B, Ali Z, et al. Characterization of in vitro ADME properties of diosgeninanddioscin from dioscoreavillosa[J]. Planta Med, 2013,79(15):1421-1428.
[12] 雷励.穿山龙注射液穴位注射治疗重症支气管哮喘临床观察[J].中国中医急症,2005,14(5):419-424.
[13] Zheng H, Wei Z, Xin G, et al. Preventive effect of a novel diosgenin derivative on arterial and venous thrombosis in vivo[J]. Bioorg Med Chem Lett, 2016,26(14):3364-3369.
[14] Fuller S, Stephens JM.Diosgenin, 4-hydroxyisoleucine, and fiber from fenugreek: mechanisms of actions and potential effects on metabolic syndrome[J]. Adv Nutr, 2015,6(2):189-197.
[15] Folwarczna J, Zych M, Nowińska B, et al. Effect of diosgenin, a steroidal sapogenin, on the rat skeletal system[J]. Acta Biochim Pol, 2016,63(2):287-295.
[16] Junchao Y, Zhen W, Yuan W, et al.Anti-trachea inflammatory effects of diosgenin from Dioscorea nipponica through interactions with glucocorticoid receptor α[J]. J Int Med Res, 2016,12(2):17-21.
Effectofdioscinonglucocorticoidreceptorofairwayepithelialcellsinmicewithasthma
LI Xianqian, WU Ning, YU Ronghuan, GUAN Chao, XU Ting, WU Jiaxi
(Shanghai Xuhui Central Hospital, Shanghai 200031, China)
ObjectiveTo observe the effects of dioscin on the glucocorticoid receptor GRα and GRβ of airway epithelial cells in mouse models with asthma, and to investigate its anti-inflammatory effect on asthma.MethodsNormal mouse airway epithelial cells were used as the blank control group, and the airway epithelial cells from asthmatic mouse models were divided into 3 groups as following: asthmatic non-treatment group (cells cultured in a medium containing no drug), asthmatic treatment group (cells cultured in a medium containing dioscin), and asthmatic antagonistic group (cells cultured in medium containing dioscin and GR antagonists, RU486). The levels of IL-1, IL-6 and TNF-α in the conditional media were measured by using ELISA. The mRNA and protein levels of GRα, GRβ, and HSP90 in the cells were detected by using real-time quantitative PCR and Western blotting, respectively.ResultsThe levels of IL-1, IL-6, and TNF-α were significantly higher in the asthmatic non-treatment group than in the asthmatic treatment group and the blank control group, and the levels of IL-1, IL-6, and TNF-α were higher in the asthmatic antagonistic group than in the asthmatic treatment group (allP<0.05). The expression of GRα, GRβ, and HSP90 at protein and mRNA levels was significantly lower in the asthmatic treatment group than in the blank control group (allP<0.05). The expression of GRα was higher, while the expression of GRβ and HSP90 at protein and mRNA levels was lower in the asthmatic treatment group than in the asthmatic non-treatment group (allP<0.05). The expression of GRα, GRβ, and HSP90 at protein and mRNA levels of the asthmatic antagonistic group had no statistic difference as compared with that of the asthmatic non-treatment group.ConclusionDioscin exerts its anti-inflammatory effects in asthmatic mice by regulating the expression of GRα, GRβ, and HSP90 in airway epithelial cells.
asthma; dioscin; airway epithelial cells; glucocorticoid receptor; heat shock protein 90; mice
10.3969/j.issn.1002-266X.2017.42.005
R562.2
A
1002-266X(2017)42-0016-04
上海市卫生和计划生育委员会科研项目(20134206)。
李先茜(1973-),女,副主任医师,主要研究方向为分子生物学及免疫学。E-mail: xeexee@126.com
2017-01-15)

