番茄碱对胃癌细胞增殖和凋亡的影响及机制
宋佳,董翔,韩梅
(新疆医科大学附属肿瘤医院,乌鲁木齐830011)
番茄碱对胃癌细胞增殖和凋亡的影响及机制
宋佳,董翔,韩梅
(新疆医科大学附属肿瘤医院,乌鲁木齐830011)
目的观察番茄碱对胃癌细胞增殖和凋亡的影响,并探讨其分子机制。方法体外培养胃癌BGC-823细胞,番茄碱组分别加入2.5、5、10 μmol/L番茄碱培养24 h;另设对照组,加入培养基培养24 h。采用CCK-8法检测算细胞增殖抑制率,流式细胞术检测细胞凋亡抑制率,Western blotting法检测细胞凋亡相关蛋白Bcl-2、Bax表达。结果番茄碱组加入2.5、5、10 μmol/L番茄碱培养24 h后,细胞增殖抑制率分别为21.21%±6.43%、42.51%±5.51%、63.71%±4.04%,均高于对照组的12.10%±2.33%;加入10 μmol/L番茄碱后细胞增殖抑制率最高(P均<0.05)。番茄碱组加入2.5、5、10 μmol/L番茄碱培养24 h后,细胞凋亡率分别为13.75%±1.02%、39.23%±1.48%、52.44%±2.02%,均高于对照组的1.52%±0.03%(P均<0.05);加入10 μmol/L番茄碱后细胞凋亡率最高(P均<0.05)。番茄碱组加入2.5、5、10 μmol/L番茄碱后Bcl-2相对表达量均低于对照组,Bax相对表达量均高于对照组(P均<0.05)。结论番茄碱对胃癌细胞的增殖具有抑制作用,可促进细胞凋亡;其作用机制可能与调节凋亡相关基因Bcl-2、Bax蛋白表达有关。
番茄碱;胃癌;细胞增殖;细胞凋亡;Bcl-2蛋白;Bax蛋白
虽然胃癌化疗、手术治疗效果显著,但不良反应明显,医疗费用昂贵。因此,寻找有效、低毒、价廉的植物用药治疗胃癌意义重大。番茄中富含番茄红素、β-胡萝卜素、番茄碱等生物活性物质[2]。研究发现,番茄碱可参与肿瘤细胞增殖、凋亡、转移及耐药等多方面的调控,对多种肿瘤细胞和肿瘤动物移植瘤模型均有一定的抑制作用,如结直肠癌[3]、肝癌[3]、前列腺癌[4]、白血病[5]和乳腺癌[6]等,但其对人胃癌细胞作用的研究较少。2015年3月~2016年12月,我们通过体外实验观察番茄碱对人胃癌细胞增殖、凋亡的作用,探讨番茄碱抗肿瘤的作用机制。
1 材料与方法
1.1 材料 胃癌BGC-823细胞株购自武汉博士德公司;番茄碱购自同田生物公司;RPMI1640培养基、胎牛血清购自Hyclone公司;CCK-8试剂盒购自Dojindo公司;Annexin V-FITC/PI试剂盒购自BD公司;蛋白质提取试剂盒、BCA蛋白定量试剂盒购自南京凯基生物科技有限公司;Bcl-2、Bax、GAPDH购自CST公司;PVDF膜购自美国Millipore公司;蛋白质Marker购自Life公司。
1.2 细胞培养与分组处理 将胃癌细胞加入含10%胎牛血清的RPMI1640培养基中,置于5%CO2、37 ℃培养箱中孵育。待细胞达到90%融合度时,用胰酶消化传代。取对数生长期的细胞,加入RPMI1640培养液,调整细胞密度为1×105/mL。将细胞接种于96孔板上,37 ℃、5% CO2培养箱中孵育。待细胞完全贴壁后,将细胞分成两组,番茄碱组分别加入番茄碱2.5、5、10 μmol/L共培养24 h,另设培养基对照组,每组设3个复孔。
1.3 细胞增殖抑制率测算 采用CCK-8法。收集各组细胞,加入90 μL培养基和10 μL CCK-8试剂,置于培养箱中孵育1 h。使用酶标仪于450 nm处检测各组的吸光度A450值,重复实验3次。细胞增殖抑制率=[(对照孔A450-实验孔A450)/(对照孔A450-空白孔A450)]×100%。
1.4 细胞凋亡率测算 采用流式细胞术。收集各组细胞,PBS漂洗3次,按说明书分别加入Annexin V-FITC和PI试剂,30 min内上流式细胞仪(贝克曼MOFIOXDP)进行检测,利用FlowJo软件处理数据。
1.5 细胞中Bcl-2、Bax蛋白表达检测 采用Western blotting法。收集各组细胞,加入含有PMSF的裂解液,4 ℃离心30 min。取上清液,BCA法测定蛋白浓度。参照说明书配置SDS-PAGE胶,常规电泳,转膜,封闭2 h,分别加入稀释后的一抗,4 ℃孵育过夜,TBST漂洗后加入二抗,室温孵育1 h,ECL发光显色。以目的条带与内参GAPDH条带灰度值的比值表示蛋白的相对表达量。
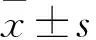
2 结果
2.1 两组细胞增殖抑制率比较 番茄碱组以2.5、5、10 μmol/L番茄碱作用于胃癌细胞24 h后,细胞增殖抑制率分别为21.21%±6.43%、42.51%±5.51%、63.71%±4.04%,均高于对照组的12.10%±2.33%(P均<0.05),且随浓度增加作用更为显著。
2.2 两组细胞凋亡率比较 番茄碱组以2.5、5、10 μmol/L番茄碱作用于胃癌细胞24 h后,细胞凋亡率分别为13.75%±1.02%、39.23%±1.48%、52.44%±2.02%,均高于对照组的1.52%±0.03%(P均<0.05),且随浓度增加作用更为显著。
2.3 两组细胞Bcl-2、Bax蛋白表达比较 番茄碱组以2.5、5、10 μmol/L番茄碱作用于胃癌细胞24 h后,随番茄碱浓度升高,Bcl-2表达降低,Bax表达升高,与对照组比较差异均有统计学意义(P均<0.05)。见表1。

表1 两组细胞Bcl-2、Bax蛋白相对表达量比较
注:与对照组比较,*P<0.05。
3 讨论
番茄碱是番茄根、茎、叶、青果中的天然成分,在番茄各部位含量各有不同。研究显示,随着番茄成熟度的增加,其番茄红素和番茄碱的含量呈负相关的。绿番茄中番茄碱的含量可达500 mg/kg,红番茄中番茄红素的含量最高。番茄碱不仅具有广泛的生物活性,对细菌、病毒、真菌、昆虫、其他植物、哺乳动物和人都具有显著的生物学作用;还具有广泛的药理学活性,可发挥抗菌[7]、降脂[8]、增强免疫力[9]、抗炎[10]等多种作用。
番茄碱具有低毒、天然、有效的特点。研究发现,番茄碱可参与肿瘤细胞增殖、凋亡、转移及耐药等多方面的调控,对多种肿瘤细胞和肿瘤动物移植瘤模型均有一定的抑制作用。体外研究显示,番茄碱可通过抑制肿瘤细胞增殖、诱导细胞凋亡和抑制肿瘤细胞侵袭转移等多种途径,对多种实体瘤发挥抗肿瘤的作用[4,11]。Shieh等[12]研究表明,番茄碱可有效抑制人非小细胞肺癌细胞NCI-H460的转移侵袭能力,且其抑制效果具有明显剂量依赖效应。Lee等[4]研究显示,番茄碱可通过抑制IκBα激酶活性,导致IκBα磷酸化,IκBα发生降解从而影响NF-κB的活性;番茄碱还可抑制TNF-α诱导的NF-κB依赖的促生存蛋白,如Bcl-2、Bcl-xL、c-IAP和XIAP等,发挥促进凋亡的作用。针对肺腺癌的研究[13]显示,番茄碱可通过抑制PI3K/Akt或NF-κB通路的活性抑制细胞的增殖和迁移能力。本研究结果显示,番茄碱作用胃癌细胞24 h后,可显著抑制细胞增殖并促进其凋亡。
细胞过度增殖和凋亡受阻是肿瘤发生的重要原因之一,故抑制肿瘤细胞增殖和诱导细胞凋亡可作为治疗恶性肿瘤的切入点。目前已知的凋亡信号转导通路主要有3条:线粒体通路、死亡受体通路及内质网通路。而线粒体通路是最普遍的凋亡机制,是细胞凋亡的核心。Chao等[5]研究显示,番茄碱可通过上调Bak和Mcl-1s蛋白的表达,改变线粒体膜电位,诱导白血病K562和HL60细胞凋亡,但这一促凋亡作用并不依赖于Caspase级联反应的激活。Lee等[4]研究证实,番茄碱可降低前列腺癌PC-3细胞中Bcl-2、Bcl-xL、Survivin等细胞增殖、凋亡相关蛋白的表达,从而促进肿瘤细胞凋亡。另一篇针对前列腺癌的研究[12]显示,番茄碱可有效抑制PC-3细胞增殖,诱导其凋亡,且呈浓度依赖性。本研究主要观察了番茄碱对胃癌BGC-823细胞线粒体凋亡通路相关蛋白Bcl-2、Bax蛋白表达的影响。Bcl-2作为Bcl-2家族抗凋亡蛋白的重要成员,其过表达与多种恶性肿瘤的发生、发展有关[14]。而Bax可形成同源二聚体,破坏线粒体膜的完整性,发挥促进细胞凋亡的作用。本研究中,与对照组比较,不同浓度番茄碱均可显著上调Bax表达,下调Bcl-2表达,从而促进胃癌细胞发生凋亡,且随其浓度的增高,促凋亡作用逐渐增强。由此推测,番茄碱可能通过线粒体凋亡途径,调节凋亡相关蛋白的表达,进而发挥诱导胃癌细胞凋亡的作用。
综上所述,番茄碱能够在体外抑制胃癌BGC-823细胞增殖并诱导其凋亡,这一过程可能通过Bcl-2/Bax相关的信号通路介导。其确切机制及体内实验是否有类似结果,有待进一步研究。
[1] Torre LA, Bray F, Siegel RL, et al. Globalcancerstatistics,2012[J].CA Cancer J Clin, 2015,65(2):87-108.
[2] Friedman M. Analysis of biologically active compounds in potatoes (Solanum tuberosum), tomatoes (Lycopersicon esculentum), and jimson weed (Datura stramonium) seeds[J]. J Chromatogr, 2004,1054(1-2):143-155.
[3] Lee KR, Kozukue N, Han JS, et al. Glycoalkaloids and metabolites inhibit the growth of human colon (HT29) and liver (HepG2) cancer cells[J]. J Agric Food Chem, 2004,52(10):2832-2839.
[4] Lee ST, Wong PF, He H, et al. Alpha-tomatine attenuation of in vivo growth of subcutaneous and orthotopic xenograft tumors of human prostate carcinoma PC-3 cells is accompanied by inactivation of nuclear factor-kappa B signaling[J]. PLoS One, 2013,8(2):e57708.
[5] Chao MW, Chen CH, Chang YL, et al. α-Tomatine-mediated anti-cancer activity in vitro and in vivo through cell cycle- and caspase-independent pathways[J]. PLoS One, 2012,7(9):e44093.
[6] Shi MD, Shih YW, Lee YS, et al. Suppression of 12-O-tetradecanoylphorbol-13-acetate-induced MCF-7 breast adenocarcinoma cells invasion/migration by α-tomatine through activating PKCα/ERK/NF-κB-dependent MMP-2/MMP-9 expressions[J]. Cell Biochem Biophys, 2013,66(1):161-174.
[7] Friedman M. Tomato glycoalkaloids: role in the plant and in the diet[J]. J Agric Food Chem, 2002,50(21):5751-5780.
[8] Friedman M, Fitch TE, Yokoyama WE. Lowering of plasma LDL cholesterol in hamsters by the tomato glycoalkaloid tomatine[J]. Food Chem Toxicol, 2000,38(7):549-553.
[9] Morrow WJ, Yang YW, Sheikh NA. Immunobiology of the tomatine adjuvant[J]. Vaccine, 2004,22(19):2380-2384.
[10] Bergers WW, Mink GM. Toxic effect of the glycoalkaloids solanine and tomatine on cultured neonatal rat heart cells[J]. Toxicol Lett, 1980,6(1):29-32.
[11] Shih YW, Shieh JM, Wu PF, et al. alpha-Tomatine inactivates PI3K/Akt and ERK signaling pathways in human lung adenocarcinoma A549 cells: effect on metastasis[J]. Food Chem Toxicol, 2009,47(8):1985-1995.
[12] Shieh JM, Cheng TH, Shi MD, et al. α-Tomatine suppresses invasion and migration of human non-small cell lung cancer NCI-H460 cells through inactivating FAK/PI3K/Akt signaling pathway and reducing binding activity of NF-κB[J]. Cell Biochem Biophys, 2011,60(3):297-310.
[13] Huang HR, Chen X, Li DL, et al. Combination of α-tomatine and curcumin inhibits growth and induces apoptosis in human prostate cancer cells[J]. PLoS One, 2015,10(12):e0144293.
[14]李通,黎欣,高枫,等.芒柄花黄素对结直肠癌细胞增殖、凋亡的影响及机制探讨[J].山东医药,2016,56(10):1-3.
10.3969/j.issn.1002-266X.2017.42.014
R965.2,R737.9
A
1002-266X(2017)42-0031-03
新疆医科大学科研创新基金项目(XYDCX2014103)。
2017-05-11)

