人DNMT3A基因慢病毒载体构建及其乳腺癌细胞MDA-MB-231稳定表达株的建立
张慧变,王媛,于林
(天津医科大学,天津300070)
人DNMT3A基因慢病毒载体构建及其乳腺癌细胞MDA-MB-231稳定表达株的建立
张慧变,王媛,于林
(天津医科大学,天津300070)
目的构建人类DNA甲基转移酶3A(DNMT3A)蛋白过表达慢病毒载体并建立乳腺癌细胞MDA-MB-231稳定表达株。方法从乳腺癌细胞MDA-MB-231中提取总RNA,逆转录出含DNMT3A的cDNA;以DNMT3A的cDNA为模板,根据其CDS序列设计含有EcoRⅠ和BamHⅠ限制性内切酶位点的引物序列,采用PCR法扩增出带有双酶切位点的目的基因;采用双酶切法将目的片段连接到到慢病毒表达质粒pLVX-IRES-Hyg中,获得重组的pLVX-FLAG-DNMT3A表达载体。重组的pLVX-FLAG-DNMT3A表达载体通过与包装质粒共转染293T细胞,获得携带FLAG-DNMT3A的重组慢病毒。以慢病毒感染MDA-MB-231细胞,48 h后在培养基中加入1 μg/μL的嘌呤霉素,筛选出稳定表达DNMT3A蛋白的细胞株,检测稳定株及野生型细胞DNMT3A蛋白及mRNA表达水平。结果构建的重组质粒经菌落PCR、重组质粒双酶切、质粒PCR验证及测序比对鉴定正确。用病毒感染MDA-MB-231细胞,药物筛选后获得的过表达稳定株中,DNMT3A蛋白及mRNA表达水平分别为13.2±0.48、107.10±0.46,均高于野生型及空载对照。结论成功构建了DNMT3A基因慢病毒表达载体pLVX-FLAG-DNMT3A,并在MDA-MB-231细胞中筛选出稳定表达DNMT3A的细胞株,为进一步探讨DNMT3A在乳腺癌中的作用提供了体外细胞系模型。
DNMT3A基因;慢病毒载体;MDA-MB-231细胞;乳腺癌
乳腺癌是全世界女性高发的癌症之一,严重危害女性健康[1]。研究表明,表观遗传学调控异常在乳腺癌的发生发展中起重要作用。表观遗传学调控能够动态改变染色质的构象,进一步影响基因转录或失活[2]。在肿瘤的发生发展过程中,DNA甲基化是表观遗传学修饰的重要方式之一[3],而DNA甲基转移酶(DNMT)作为调控甲基化的关键酶,在乳腺癌的发生发展中起关键作用。在哺乳动物中,具有催化活性的DNAT主要有4种,分别为DNMT1、DNMT3A、DNMT3B、DNMT3L[4]。DNMT3A是DNMT家族中重要成员之一,在从头合成甲基化中发挥关键作用[5]。最新研究表明,DNMT3A及其调控基因异常表达在促进乳腺癌发生发展中具有重要作用。2017年2~7月,我们通过构建DNMT3A慢病毒表达载体,经慢病毒感染并筛选出稳定表达DNMT3A的MDA-MB-231细胞株,为探讨DNMT3A在乳腺癌发生、发展及转移中的作用机制提供体外细胞系模型。
1 材料与方法
1.1 材料 人乳腺癌细胞系MDA-MB-231购于ATCC细胞库,293T细胞系为本实验室保存。慢病毒载体质粒pLVX-IRES-Hyg,包装质粒1和包装质粒2由天津医科大学生物化学与分子生物学教研室石磊教授惠赠,图1为慢病毒载体质粒pLVX-FLAG-DNMT3A图谱。Trans1-T1-T1 Phage Resistant Chemically Competent Cell、Trans2KPlusⅡDNA Marker购于北京全式金公司。Ampicillin和SYBRGreen购自罗氏公司,转染试剂Polyethyleneimine及鼠源FLAGM2抗体购自Sigma公司。PrimeSTAR®Max DNA Polymerase购于Takara公司。EcoRⅠ和BamHⅠ限制性内切酶、T4DNA连接酶购自Thermo Fisher Scientific公司。由苏州金唯智公司完成所有引物合成和基因测序工作。Puromycin、小量DNA快速回收试剂盒质粒及快速小提试剂盒购自北京索莱宝科技有限公司。兔源DNMT3A单克隆抗体购于CST公司。辣根过氧化氢酶标抗鼠IgG、兔IgG为美国KPL公司产品。
1.2 重组慢病毒载体pLVX-FLAG-DNMT3A的构建及鉴定 提取MDA-MB-231细胞的总RNA,逆转录为cDNA,以cDNA为模板,根据DNMT3A的CDS序列(NM_175629.2)设计含有EcoRⅠ和BamHⅠ限制性内切酶位点及FLAG标签的引物序列。上游引物5′-CCGGAATTCATGGATTACAAGGATGACGA-CGATAAGATGCCCGCCATGCCCTCC-3′;下游引物5′-CGCGGATCCTTACACACACGCAAAATACTC-3′。

图1 重组慢病毒表达载体pLVX-FLAG-DNMT3A图谱
PCR反应体系及条件参照说明书。用1%的琼脂糖凝胶将PCR产物进行电泳鉴定,切胶回收目的片段。以EcoRⅠ和BamHⅠ双酶切纯化后的PCR产物及本实验所有的pLVX-IRES-FLAG-SND1质粒,电泳后回收并纯化。将线性pLVX-IRES-Hyg质粒载体与具有相同黏性末端的DNMT3A目的片段在T4 DNA连接酶的作用下于25 ℃下连接1 h,连接产物转化感受态细菌大肠杆菌Trans1-T1,在含有氨苄西林抗性的LB平板上筛选克隆。挑取微量克隆加入到可扩增FLAG-DNMT3A的PCR体系中扩增,用1%琼脂糖凝胶电泳鉴定PCR产物。挑取阳性单克隆摇菌扩大培养并提取重组质粒,用FLAG-DNMT3A引物进行质粒PCR,PCR产物大小为2 805 bp。采用EcoRⅠ和BamHⅠ对重组质粒pLVX-IRES-DNMT3A进行双酶切鉴定,并以1%琼脂糖凝胶电泳验证片段大小,两条条带分子量分别在9 000 bp左右和3 000 bp左右为初步鉴定正确的质粒。将双酶切鉴定正确的质粒进行DNA测序进一步鉴定插入序列的准确性。
1.3 慢病毒毒粒包装 293T细胞常规传代培养,待细胞生长至60%左右,在转染试剂聚乙烯亚胺介导下,用上述3种重组质粒及空载质粒分别与包装质粒共转染293T细胞。48 h后收集培养液上清,4 ℃离心10 min,用0.45 μm的滤器过滤,-80 ℃长期保存用于感染。
1.4 MDA-MB-231细胞的感染及稳定株的筛选与鉴定 按3×105/孔将MDA-MB-231细胞接种于6孔培养板,待细胞生长至60%汇合后,弃上清直接加入2 mL病毒液,补加200 μL FBS和20 μg聚凝胺。感染病毒24 h后更换新鲜的L-15培养基,48 h后加入嘌呤霉素1 μg/mL进行抗药筛选。筛选出能够稳定表达FLAG-DNMT3A的MDA-MB-231稳定株,用TRIzol法提取MDA-MB-231野生型细胞及稳定株的总RNA,每份样品取2.5 μg逆转录为cDNA。采用定量PCR法检测DNMT3A mRNA表达,以GAPDH为内参。用RIPA缓冲液提取MDA-MB-231野生型细胞及稳定株的总蛋白,经BCA法检测总蛋白浓度后取15 μg,以β-actin为内参,用Western blotting法检测DNMT3A蛋白表达。
2 结果
2.1 重组慢病毒质粒pLVX-FLAG-DNMT3A的鉴定与测序 电泳结果显示,挑取的14个阳性克隆中,除10号以外,其余PCR产物的条带均在3 000 bp左右,证明除10号以外其余均转化成功(图1)。选取条带较亮且位置正确的1、2、3号菌液提取质粒,进行双酶切及质粒PCR,电泳结果显示,双酶切后得到两个条带分别为9 000 bp和3 000 bp左右(图2),质粒PCR产物的条带均在3 000 bp左右(图3),初步鉴定质粒正确。选取1、2、3号菌液进行基因测序,测序结果与目的序列完全一致,证明FLAG-DNMT3A已成功插入到pLVX-IRES-Hyg载体。
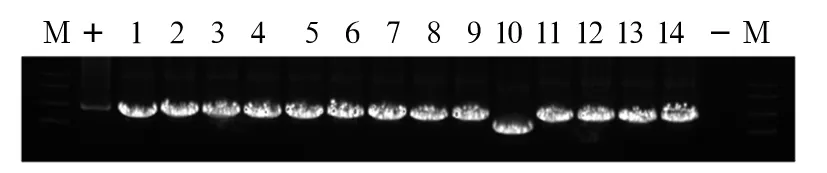
注:M为DNA Marker;1~14号为阳性克隆菌落PCR产物;+为以cDNA为模板扩增目的片段作为阳性对照;-为以细菌培养基为模板扩增PCR产物作为阴性对照。
图1重组质粒菌落PCR鉴定图
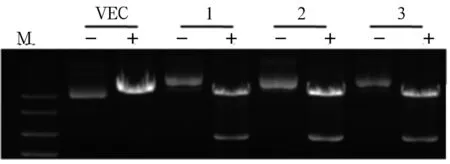
注:M为DNA Marker;VEC为pLVX-IRES-Hyg载体;1、2、3为1号、2号、3号阳性克隆菌落提取的环状pLVX-FLAG-DNMT3A重组质粒;-为酶切前质粒;+为质粒经EcoR1和BamH1双酶切后产物。
图2重组质粒EcoR1和BamH1双酶切鉴定图
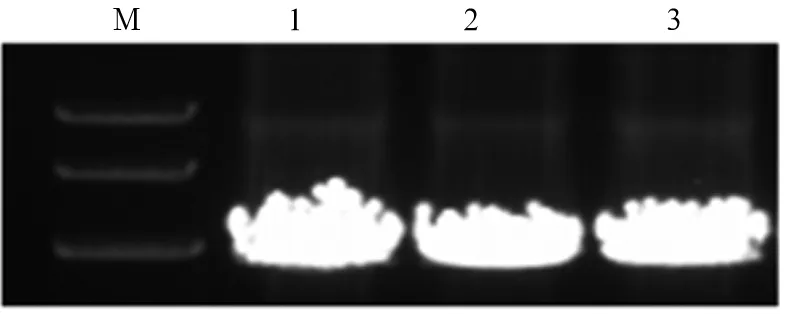
注:M为DNA Marker;1、2、3为pLVX-FLAG-DNMT3A重组质粒PCR产物。
图3重组质粒PCR鉴定图
2.2 MDA-MB-231细胞慢病毒稳定株的筛选与鉴定结果 以野生型MDA-MB-231细胞作为空白对照,其DNMT3A蛋白和mRNA表达量设为1,质粒空载对照及过表达稳定株中DNMT3A蛋白的相对表达量分别为2.16±0.67、13.2±0.48,DNMT3A mRNA的相对表达量分别为2.05±0.34、107.10±0.46,DNMT3A慢病毒稳定株蛋白及mRNA的相对表达量较野生型及空载对照均增加(P均<0.01),证明稳定表达DNMT3A蛋白的MDA-MB-231慢病毒稳定株构建成功。
3 讨论
表观遗传学是研究除DNA序列变化以外的其他机制引起的基因表达和细胞表型的可遗传的改变[6]。表观遗传学调控真核基因的表达,与人类重大疾病密切相关,一直以来都是生命科学领域研究的热点。表观遗传学现象涉及DNA甲基化、组蛋白修饰、染色质重塑及非编码RNA的调控。DNA甲基化作为表观遗传学的重要标志[7],在细胞分化、肿瘤发生发展中起着关键作用,DNA甲基转移酶负责将甲基基团添加到CpG二核苷酸,DNMT3A作为一种从头合成DNA甲基转移酶在调控DNA甲基化中有着重要作用[8]。DNMT3A位于染色体2p23,由34个外显子编码的长130 kDa蛋白质,总体来说其包含两个结构域:N端调节区和C端催化区,N端调节区又包括一个保守的PWWP结果域及富含半胱氨酸的ADD结构域[9],最新研究表明PWWP结构域可以与H3K36me3直接结合,ADD结果域通过与一些转录因子及表观遗传学调节因子相结合,如PU.1、Myc、p53、RP58、HDAC1、HP1、EZH2、SUV39H1[10],进而影响一些特定位点DNA的甲基化。
在肿瘤中,全基因组的甲基化模式发生了改变[7],在一些特殊基因的启动子区域常常伴随着CpG岛的高甲基化及非CpG岛的低甲基化[11],这些改变如何产生及其在肿瘤发生发展中的作用尚不明确。最新研究表明,DNMT3A在多种肿瘤细胞中高表达,然而DNMT3A促进肿瘤形成的机制尚不明确。有一种假说认为,DNMT3A升高导致一些重要的肿瘤抑制基因沉默[10]。在乳腺癌中,E-cadherin启动子区域高甲基化使其表达抑制[12],促进肿瘤细胞的上皮间质化转变[13],进而促进肿瘤细胞的侵袭与转移。此外有文献报道,乳腺癌组织DNMT3a的表达量增加[14],提示DNMT3a能促进乳腺癌的发生。因此研究DNMT3A参与乳腺癌发生和转移的机制显得尤为重要。
慢病毒载体介导的基因转移相对于真核表达质粒来说具有高病毒滴度、高转染效率及更好的稳定性等优势[15]。三阴性乳腺癌MDA-MB-231细胞系来源于发生乳腺癌转移患者的胸腔积液,具有高转移及侵袭能力[16],是研究乳腺癌很好的细胞模型。但是由于其转染效率不高,使用慢病毒载体能够高效地将外源目的基因稳定整合入宿主细胞的基因组中,从而实现目的基因持久稳定性表达的目的。本实验将FLAG-DNMT3A基因插入慢病毒表达载体pLVX-IRES-Hyg,构建重组慢病毒载体pLVX-FLAG-DNMT3A,在293T细胞中进行慢病毒包装。用包装好的慢病毒颗粒感染MDA-MB-231细胞,经过药物抗性筛选,建立MDA-MB-231慢病毒稳定株。DNMT3A稳定表达的MDA-MB-231细胞株的获得,为从细胞与分子水平上探讨DNMT3A对乳腺癌细胞的调控作用及机制提供了很好的体外细胞系模型,为进一步研究乳腺癌的发生发展及转移机制奠定了基础,并为乳腺癌的治疗提供了新的分子靶标。
[1] Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011,61(2):69-90.
[2] Tan EJ, Kahata K, Idas O, et al. The high mobility group A2 protein epigenetically silences the Cdh1 gene during epithelial-to-mesenchymal transition[J]. Nucleic Acids Res, 2015, 43(1): 162-178.
[3] Li E, Zhang Y. DNA methylation in mammals[J]. Cold Spring Harb Perspect Biol, 2014,6(5):a019133.
[4] Chédin F. The DNMT3 family of mammalian de novo DNA methyltransferases[J]. Prog Mol Biol Transl Sci, 2011,101:255-285.
[5] Cedar H, Bergman Y. Linking DNA methylation and histone modification: patterns and paradigms[J]. Nat Rev Geneti, 2009,10(5):295-304.
[6] Jones PA, Baylin SB. The epigenomics of cancer[J]. Cell, 2007,128(4):683-692.
[7] Spencer DH, Russler-Germain DA, Ketkar S, et al. CpG island hypermethylation mediated by DNMT3A is a consequence of AML progression[J]. Cell,2017,168(5):801-816.
[8] Oka M, Rodic N, Graddy J, et al. CpG sites preferentially methylated by dnmt3ain vivo[J]. J Biol Chem, 2006,281(15):9901-9908.
[9] Zhao Q, Rank G, Tan YT, et al. PRMT5-mediated methylation of histone H4R3 recruits DNMT3A, coupling histone and DNA methylation in gene silencing[J]. Nat struct Mol Biol, 2009,16(3):304-311.
[10] Chen BF, Chan WY. The de novo DNA methyltransferase DNMT3A in development and cancer[J]. Epigenetics, 2014,9(5):669-677.
[11] De Carvalho Daniel D, Sharma S, You Jueng S, et al. DNA methylation screening identifies driver epigenetic events of cancer cell survival[J]. Cancer Cell, 2012,21(5):655-667.
[12] Liu YN, Lee WW, Wang CY, et al. Regulatory mechanisms controlling human E-cadherin gene expression[J]. Oncogene, 2005,24(56):8277-8290.
[13] Lombaerts M, van Wezel T, Philippo K, et al. E-cadherin transcriptional downregulation by promoter methylation but not mutation is related to epithelial-to-mesenchymal transition in breast cancer cell lines[J]. Br J Cancer, 2006,94(5):661-671.
[14] Roll JD, Rivenbark AG, Jones WD, et al. DNMT3b overexpression contributes to a hypermethylator phenotype in human breast cancer cell lines[J]. Mol Cancer, 2008,7:15.
[15] Mátrai J, Chuah MKL, VandenDriessche T. Recent advances in lentiviral vector development and applications[J]. Mol Ther, 2010,18(5):477-490.
[16] Kang Y, Siegel PM, Shu W, et al. A multigenic program mediating breast cancer metastasis to bone[J]. Cancer Cell, 2003,3(6):537-549.
ConstructionofhumanDNMT3AlentiviralvectorandestablishmentofstaleMDA-MB-231cellline
ZHANG Huibian,WANG Yuan, YU Lin
(Tianjin Medical University, Tianjin 300070, China)
ObjectiveTo construct the lentiviral vector of human DNA methyltransferase 3A (DNMT3A) and to establish the stable breast caner MDA-MB-231 cell line.MethodsThe total RNA was extracted from MDA-MB-231 cells and cDNA containing DNMT3A was inverse transcribed. DNMT3A fragment containing EcoRⅠand BamHⅠsites was amplified by PCR and was inserted into pLVX-IRES-Hyg lentiviral vector. Then the recombinant expression vector pLVX-FLAG-DNMT3A was co-transfected into 293T cell line with packaging plasmids, and the culture supermatant containing the lentiviral particles was collected to infect MDA-MB-231 cells. After 48 h, 1 μg/μ puromycin was used to screen the infected cells, so as to obtain a cell line with stable expression. The protein and mRNA expression levels of DNMT3A were detected by Western blotting and PCR.ResultsBacteria colonies PCR, double restriction enzyme digestion, plasmid PCR identification, and DNA sequencing demonstrated the lentiviral vector pLVX-FLAG-DNMT3A was constructed. MDA-MB-231 cells were infected by the lentivirus, and the protein and mRNA expression of DNMT3A was significantly up-regulated following screening with puromycin.ConclusionsThe DNMT3A gene lentiviral vector pLVX-FLAG-DNMT3A is constructed successfully. The cell line stably expressing DNMT3A is screened in MDA-MB-231 cells, which provides an in vitro model for further study of molecular function and mechanism of DNMT3A in human breast cancer.
DNMT3A gene; lentiviral vector; MDA-MB-231 cells; breast carcinoma
10.3969/j.issn.1002-266X.2017.42.002
Q591.2;Q784
A
1002-266X(2017)42-0005-04
国家自然科学基金资助项目(81672592,81202102)。
张慧变(1991-),女,硕士研究生,主要研究方向为肿瘤分子生物学。E-mail: 13821860893@163.com
于林(1983-),男,副教授,主要研究方向为肿瘤转移相关分子生物学。E-mail: onoblivion@tmu.edu.cn
2017-07-27)

