日本血吸虫mir-125b靶向调控宿主CD276的鉴定研究
王立辉,朱丽慧,刘军涛,夏天奇,陈永军,李建军,程国锋
(1.天津农学院,天津 300384;2.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点实验室,上海 200241)
日本血吸虫mir-125b靶向调控宿主CD276的鉴定研究
王立辉1,2,朱丽慧2,刘军涛2,夏天奇2,陈永军2,李建军1,程国锋2
(1.天津农学院,天津 300384;2.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点实验室,上海 200241)
通过荧光素酶实验验证宿主CD276为日本血吸虫mir-125b的靶基因,并分析感染血吸虫后宿主CD276基因在不同组织中的表达情况。利用PCR扩增mir-125b与CD276互作的核酸序列,并将目的片段克隆至表达荧光素酶报告基因质粒的下游。将重组质粒转染到HEK293T细胞内,检测荧光素酶报告基因表达。进一步利用荧光定量PCR技术检测小鼠巨噬细胞在转染血吸虫mir-125b mimic后,靶基因CD276的表达情况,同时检测感染血吸虫不同时间段、小鼠不同组织中CD276的表达情况。荧光素酶实验表明转染mir-125b mimic和重组质粒后细胞的荧光素酶报告基因的表达极显著降低(P < 0.01),提示mir-125b可与CD276相关区域互作,抑制报告基因的表达;血吸虫mir-125b mimic转染小鼠巨噬细胞后导致其宿主CD276基因的表达降低,进一步提示宿主CD276可能为血吸虫mir-125b靶基因;荧光定量PCR分析表明感染日本血吸虫后的不同感染时期,小鼠淋巴细胞、肝脏及脾脏中的CD276的表达水平显著低于对照组(P < 0.01),进一步表明虫源性mir-125b在体内影响宿主CD276基因的表达。日本血吸虫mir-125b可能靶向调控宿主CD276基因的表达,在虫体与宿主互作中发挥重要调控功能。
日本血吸虫;mir-125b;CD276;功能
Abstract:To validate Schistosoma japonicum (S. japonicum) mir-125b targeting murine CD276 and analyze the expression of CD276 in different tissues of mice infected with S. japonicum, we predicted in our previous study that Schistosoma japonicum mir-125b might target murine CD276. Here, we used PCR to amplify the putatively interacted regions of murine CD276 and cloned the ampli fi ed fragment into the downstream of a Gaussia luciferase vector (pGluc-Basic). Then, the recombinant plasmids mir-125b mimics and anti-sense mir-125b were transfected into HEK293 T cells and the luciferase activities were measured by using a dual luciferase reporter system. In addition,the expression of CD276 in vitro cultured murine macrophages was also determined in quantitative real-time PCR upon mir-125b mimics transfection. Finally, the expression of CD276 in different tissues of mice infected with S. japonicum was also determined in quantitativereal-time PCR. The putatively interacted region of CD276 was obtained and the corresponding recombinant plasmid was successfully constructed. A significant down-regulation of luciferase reporter activity was observed upon transfection of mir-125b mimics into HEK293T cells (P < 0.05). Transfection of mir-125b mimics into murine macrophages led to the down-regulation of CD276. In addition,the expression of CD276 in lymphocytes, livers, and spleens of mice infected with S. japonicum was also down-regulated (P < 0.05). Our results indicated that S. japonicum mir-125b directly target murine CD276 during schistosome infection, suggesting that mir-125b might play an important regulatory role in parasite-host interactions.
Key words:S. japonicum; mir-125b; CD276; function
日本血吸虫病是由血吸虫感染引起的一种危害严重的人畜共患寄生虫病,主要流行于我国长江流域及其以南省市。血吸虫是一类多细胞寄生虫,有着复杂的生活史,包括虫卵、毛蚴、母胞蚴、子胞蚴、尾蚴、童虫和成虫等多个发育时期,在这一复杂的发育过程中,血吸虫需要改变自身基因表达以适应不同的寄生环境,维持其在宿主体内存活。
microRNAs又称微小RNAs(miRNAs),是一段长约20~23个核苷酸的非编码小RNAs,通过与靶mRNA的互补配对,进而在转录后水平上对基因的表达进行负调控[1,2]。研究发现miRNAs在诸多疾病的发生、发展以及多种生命活动中发挥重要的调控作用[3]。本研究根据课题组前期研究结果推测血吸虫mir-125b可能靶向调控宿主CD276基因表达,将CD276基因与mir-125b潜在的互作片段克隆到pGLuc-Basic载体上,并应用荧光素酶报告基因对mir-125b与重组质粒的互作进行鉴定。另外,将血吸虫mir-125bmimic转染至小鼠巨噬细胞中,检测小鼠巨噬细胞中CD276基因的表达变化。同时,还利用荧光定量PCR检测不同感染时期的小鼠不同组织中CD276基因的表达情况,上述研究为深入探讨血吸虫mir-125b在病原与宿主互作中的潜在调控功能奠定了初步基础。
1 材料与方法
1.1 材料pGLuc-Basic及pGL3载体购自NEB公司;BALB/c小鼠购自中国科学院上海实验动物中心;日本血吸虫中国大陆株尾蚴由中国农业科学院上海兽医研究所动物血吸虫病研究室提供。本实验所用HEK293T及小鼠巨噬细胞RAW264.7细胞株均由本实验室保存。
1.2 重组质粒构建以小鼠巨噬细胞RAW264.7的
cDNA为模版,利用RT-PCR方法扩增小鼠基因CD276(NM_133983.4)相关序列。引物序列如下:5'-TCGGGAGATCTTGGAATTCAAGTACC ATCTTCGACTTCC-3'(下划线为EcoR I位点);5'-CTCCCATGGTGGCTGGATCCCTCTTCATGCTT CTGCTGT-3'(下划线为BamH I位点)。扩增产物纯化后,经酶切连接入pGLuc-Basic载体。构建成功的质粒经测序确认后,利用TIAN Prep Mini Plasmid Kit 质粒纯化试剂盒进行纯化。
1.3 细胞转染及荧光素酶活性的检测将HEK293T细胞接种于24孔培养板中,每孔约2×105个细胞,待细胞密度接近90%时,按照LipofectamineTM2000说明书进行重组质粒转染,转染设5组,具体操作见表1,每组设4次重复。转染24 h后进行荧光素酶活性测定,收集每孔细胞置于1.5 mL EP管中,离心弃上清,每管细胞加80 μL细胞裂解液,充分混匀,室温静置20 min。取10 μL裂解的细胞上清液于新的1.5 ml EP管中,加入50 μL LARLII 检测萤火虫酶荧光值,再加入50 μl Stop & Glo®Reagent,检测Renilla荧光素酶荧光值,记录数据。
1.4 mir-125b转染小鼠巨噬细胞后CD276基因的表达为研究血吸虫mir-125b对于小鼠巨噬细胞中CD276基因表达情况的影响,将虫源性mir-125bmimic转染巨噬细胞。实验设PBS组、mir-125bmimic组、Control miRNA 组共3组,每组实验设4次重复(表1)。收集mir-125bmimic转染后的巨噬细胞,抽提细胞的总RNA,反转录得到cDNA,然后利用荧光定量PCR以GAPDH为内参,检测转染mir-125b后巨噬细胞中CD276基因的表达。荧光定量PCR扩增CD276基因的引物:上游引物为5'-GATCCAAGACAGCTCTACGGC-3';下游引物为5'-GACGACTCTGGAGGAACACC-3'。内参鼠GAPDH的引物:上游引物为5'-ACACATTGG GGGTAGGAACAC-3';下游引物为5'-CAACTTT GGCATTGTGGAAGG-3'。荧光定量PCR运行参数:94℃预变性30 s;95℃变性5 s,65℃退火15 s,72 ℃延伸 8 s,40个循环,通过2-ΔCt方法计算CD276基因的相对表达量。
1.5 荧光定量PCR检测感染血吸虫不同时期小鼠组织中CD276基因的表达情况每只小鼠采用腹部贴片法感染约100条尾蚴,分别于感染后25 d和35 d剖杀,收集小鼠血液,分离淋巴细胞,同时收集肝脏组织和脾脏组织。Trizol法提取上述细胞和组织的总RNA,反转录获得cDNA,然后利用荧光定量PCR检测分析CD276基因在感染后小鼠淋巴细胞及组织中的表达。荧光定量PCR运行参数和数据分析同1.4。
1.6 统计学分析实验数据均用SPSS统计学软件,采用Mean±SE,选择Tukey检验进行单因素方差分析。

表1 重组质粒转染细胞组别设置Table 1 Different groups of recombinant plasmid for transfection
2 结果
2.1 重组质粒构建利用生物信息学预测mir-125b的宿主靶基因CD276基因的3'UTR互作区域(图1a),克隆3'UTR的相关序列。电泳分析PCR扩增产物表明获得产物与预期(559 bp)大小相符(图1b)。然后,将PCR产物进行酶切、克隆至报告基因的下游,测序结果表明重组质粒构建成功。
2.2 细胞转染及双荧光素酶报告基因活性的检测按表1的组别分别转染HEK293T细胞。在转染24 h后测定荧光素酶报告基因的表达情况,并以Firefly荧光素酶活性值(pGL3)为内参对Gaussia荧光素酶活性值进行均一化处理(图2),结果表明转染mir-125bmimic后显著抑制pGLuc-3'UTR荧光素酶活性(P<0.01),当加入Anti-mir-125b后,mir-125bmimic对pGLuc-3'UTR荧光素酶抑制效果明显减弱(P<0.01)。

图1 mir-125b靶基因的生物信息学分析(a)及靶基因片段的PCR扩增(b)Fig. 1 Bioinformatical analysis of the target of mir-125b(a) and PCR ampli fi cation of the target fragment (b)
2.3 mir-125b转染巨噬细胞后CD276基因的表达将血吸虫mir-125bmimic转染巨噬细胞,利用荧光定量PCR检测不同时间细胞内CD276基因的表达水平。结果表明在转染后24 h时,各处理组之间差异不显著,在48 h和72 h时,细胞内CD276基因的表达水平与对照组(PBS组、Control miRNA组)相比显著降低(P< 0.05)(图3),提示血吸虫mir-125b可能靶向抑制CD276基因的表达。
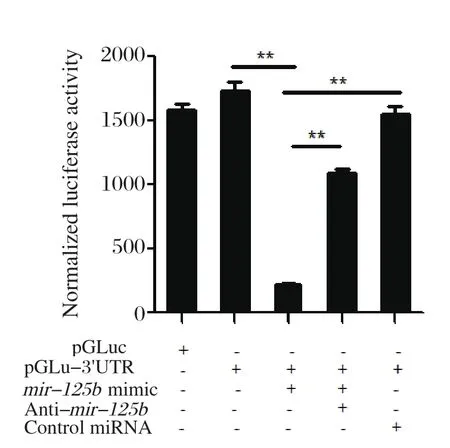
图2 转染重组质粒后各处理组荧光素酶表达情况分析Fig.2 Luciferase activities in the HEK293T cells transfected with recombinant plasmids combined with different miRNAs

图3 转染mir-125b mimic后小鼠巨噬细胞CD276基因的表达分析Fig.3 The expression of CD276 at different time points of macrophages transfected with mir-125b mimic
2.4 荧光定量PCR检测感染血吸虫不同时期小鼠的组织中CD276基因的表达情况利用荧光定量PCR检测感染日本血吸虫后小鼠淋巴细胞、肝脏及脾脏中的CD276基因表达(图4),结果显示感染日本血吸虫d25、d35的小鼠淋巴细胞、肝脏及脾脏中CD276基因的表达均极显著低于对照未感染小鼠(P< 0.01),提示日本血吸虫可能通过mir-125b靶向抑制宿主CD276基因的表达,进一步调控宿主的免疫应答反应。

图4 感染血吸虫不同时期小鼠的组织中CD276基因的表达情况Fig. 4 Real-time PCR analysis of the expression of CD276 in mice infected with Schistosoma japonicum
3 讨论
研究表明miRNAs参与多种重要生物进程的调控,如早期发育、细胞分化、细胞增殖、细胞凋亡和造血功能等[4]。本课题组前期研究提示不管是血吸虫miRNAs还是宿主源性的miRNAs均可能在日本血吸虫感染和寄生过程中发挥重要作用[5,6]。已有研究表明mir-125b是一类具有免疫调控功能的miRNA,主要参与免疫系统对病原体的免疫防御的调控[7]。此外,mir-125b在不同组织来源的恶性肿瘤细胞中功能有明显差异性,参与肿瘤细胞的调控。mir-125b在不同细胞中的功能可能取决于其所有调控靶基因的综合表达水平[8]。
最近,我们在日本血吸虫的外泌体中发现了一个血吸虫特异性的miRNA—mir-125b,且丰度较高,与宿主的mir-125b序列同源性差异大。同时,我们还发现日本血吸虫外泌体可以将其所携带的虫源性miRNAs传递至宿主细胞,调控细胞靶基因的表达[9]。既然虫源性mir-125b能够被传递至宿主细胞,那么,虫源性mir-125b是如何调控宿主细胞的功能?
根据课题组前期研究和mir-125b靶基因预测结果,筛选到宿主CD276基因的3'UTR区域存在血吸虫mir-125b的互作位点,提示CD276可能是mir-125b在宿主中的潜在靶基因。CD276,又叫B7-H3,是2001年在人树突状细胞 cDNA文库中鉴定出的B7超家族共信号分子[10]。研究表明CD276共信号分子不仅能提供T细胞活化所需的共信号分子,以促进T细胞免疫应答,在抗炎和抗肿瘤免疫应答中发挥关键作用[11],同时也可提供下调免疫应答的负性共信号分子,维持T细胞免疫耐受,在肿瘤免疫逃逸中发挥重要作用[12,13]。另有研究表明CD276通过下调I型辅助T细胞介导的免疫反应,下调机体的免疫应答[14]。Zhang[11]发现炎症患者体内髓系细胞包括单核巨噬细胞以及中性粒细胞均存在与CD276结合的膜分子,这提示体内CD276作用的对象可能是髓系细胞而非先前广泛研究的T细胞。另有研究发现CD276可以作为粘附分子介导细胞与细胞以及细胞与细胞外基质粘附,促进细胞侵袭和迁移[15,16]。
为了探究日本血吸虫mir-125b对于宿主细胞免疫效应调控作用,本研究首先扩增得到CD276基因的3'UTR相关基因片段,并将其成功克隆到荧光素酶报告基因质粒载体下游,荧光素酶报告基因活性检测实验表明虫源性mir-125b作用于目的片段并抑制了荧光素酶活性,提示CD276基因是血吸虫mir-125b的一个宿主靶基因。在体外,将mir-125bmimic转染小鼠巨噬细胞,发现mir-125b可靶向抑制小鼠巨噬细胞CD276基因的表达,提示血吸虫分泌的miRNA有可能通过调节宿主免疫,介导血吸虫免疫逃避。进一步,荧光定量PCR结果显示感染血吸虫不同时期小鼠肝脏、脾脏及淋巴细胞中CD276基因的表达均显著下调,推测感染日本血吸虫后mir-125b可能通过调控CD276基因的表达,抑制宿主免疫应答。
总之,本研究成功地扩增了与mir-125b互作的CD276基因相关区域并将其克隆到荧光素酶报告基因载体的下游,利用荧光素酶实验验证CD276基因可能是mir-125b的一个靶基因,并检测了感染日本血吸虫不同时期小鼠不同组织和外周血细胞中CD276基因的表达水平。上述研究为进一步阐述血吸虫与宿主的互作机制,筛选有效抗血吸虫候选疫苗和药物靶标奠定了初步基础。
[1] 阳青兰, 肖建华. 日本血吸虫非编码小RNA研究进展[J].微生物学免疫学进展, 2016, 44(2)∶ 93-97.
[2] 杨杰, 秦志强, 许静, 等. 非编码小RNA在血吸虫感染中的作用的研究进展[J]. 中国寄生虫学与寄生虫病杂志,2016, 34(3)∶ 277-281.
[3] 何顺伟, 魏晓星. 新型诊断标志物循环mirNA的研究进展与应用[J]. 青海医学院学报, 2016,(1)∶ 68-72.
[4] 于光远, 詹学, 张祯祯, 等. 巨噬细胞过表达mir-125b促进其凋亡[J]. 细胞与分子免疫学杂志, 2016, 32(7)∶ 958-962转967.
[5] Cheng G, Jin Y. MicroRNAs∶ potentially important regulators for schistosome development and therapeutic targets against schistosomiasis[J]. Parasitology, 2012,139(5)∶ 669-679.
[6] Zhu L, Liu J, Cheng G. Role of microRNAs in schistosomes and schistosomiasis[J]. Front Cell Infect Microbiol, 2014, 4∶165.
[7] Sun Y M, Lin K Y, Chen Y Q. Diverse functions ofmir-125family in different cell contexts[J]. J Hematol Oncol,2013, 6( 1) ∶ 1-8.
[8] 智慧, 朱伟, 王同杉, 等.mir-125b靶向抑制BCL2、MCL1表达对胃癌SGC7901/VCR细胞多药耐药性的影响[J]. 南京医科大学学报(自然科学版), 2011, (6)∶ 777-782.
[9] Zhu L H, Liu J T, Dao J W,et al. Molecular characterization ofS. japonicumexosome-like vesicles reveals their regulatory roles in parasite-host interactions[J]. Sci Rep, 2016, 6∶ 25885.
[10] Steinberger P, Majdic O, Derdak S V,et al.Molecular characterizationof human 4Ig-B7-H3, a member of B7 family with four Ig-likedomains[J]. J Immunol, 2004,172(4)∶ 2352-2359.
[11] Zhang G B. B7-H3 augments the inflammatory response and is associated with human sepsis[J]. J Immunol, 2010,185(6)∶ 3677-3684.
[12] Coyle A J, Gutierrez-Ramps J C. The expanding B7 superfanuly∶ increasing complexity in costimulatory signals regulating T cell function[J]. Nat Immunol, 2001,2(3)∶ 203-209.
[13] Chen L. Co-inhibitory molecules of the B7-CD28 family in the control of T-cell immunity[J]. Nat Immunol, 2004,4(5)∶ 336-347.
[14] Suh W K, Gajewska B U, Okada H,et al. The B7 familymember B7-H3 preferentially down-regulates T helper type 1-mediated immune responses[J]. Nat Immunol,2003, 4(9)∶ 899- 906.
[15] Chen Y W, Tekle C, Fodstad O. The immunoregulatory protein human B7H3 is a tumor-associated antigen that regulates tumor cell migration and invasion[J]. Curr Cancer Drug Targets, 2008, 8∶ 404-413.
[16] Tran C N, Thacker S G, Louie D M,et al. Interactions of T cells with fibroblast-like synoviocytes∶ role of the b7 family costimulatory ligand b7-h3[J]. J Immunol, 2008,180∶ 2989-2998.
IDENTIFICATION OF PATHOGEN mir-125b TARGETING MURINE CD276 IN MICE INFECTED WITH SCHISTOSOMA JAPONICUM
WANG Li-hui1,2, ZHU Li-hui2, LIU Jun-tao2, XIA Tian-qi2, CHEN Yong-jun2, LI Jian-jun1,CHENG Guo-feng2
(1.Tianjin Agricultural University, Tianjin 300384, China; 2. Key Laboratory of Animal Parasitology of Ministry of Agriculture, Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
S852.735
A
1674-6422(2017)04-0034-06
2017-02-21
国家自然科学基金(31502056和31672550);中国农业科学院科技创新工程
王立辉,男,硕士研究生,临床兽医学专业
程国锋,E-mail:chenggfeng@shvri.ac.cn ;李建军,E-mail:jianjunli2003@163.com

