牛传染性鼻气管炎病毒gB基因荧光定量PCR检测方法建立
王海军,王善辉,昌莉丽,陈鸿军
(1.徐州生物工程职业技术学院,徐州 221006;2.中国农业科学院上海兽医研究所,上海 200241)
牛传染性鼻气管炎病毒gB基因荧光定量PCR检测方法建立
王海军1,王善辉1,昌莉丽1,陈鸿军2
(1.徐州生物工程职业技术学院,徐州 221006;2.中国农业科学院上海兽医研究所,上海 200241)
为建立检测牛传染性鼻气管炎病毒(Bovine infectious rhinotracheitis virus,IBRV)gB基因的荧光定量 PCR 检测方法,本研究根据gB基因序列,设计1对引物和相应 的TaqMan探针。建立和优化反应体系后,以10倍稀释的病毒来检测该方法的灵敏度。同时,对伪狂犬病毒(Pseudorabies virus, PRV)、马立克病病毒(Marek’s disease virus,MDV)和鸭瘟病毒(Duck plague virus,DPV)进行特异性检测。结果表明,基于gB基因的荧光PCR检测方法可用于鉴定IBRV,该方法具有较好的灵敏度和特异性,其灵敏度为10 copies/μL,即0.02 TCID50,且与其他病毒无交叉反应。
牛传染性鼻气管炎病毒;实时荧光定量PCR
Abstract:In order to detect infectious Bovine rhinotracheitis virus (IBRV), a TaqMan fl uorescence quantitative PCR detection method was developed using speci fi cally paired primers and corresponding TaqMan probe targeting to the gB gene of IBRV. After establishing and optimizing the reaction system, the sensitivity of the method was detected by a 10-fold dilution of the virus. At the same time, speci fi c detection of Pseudorabies virus (PRV), Marek's disease virus(MDV) and Duck plague virus (DPV) was conducted. Results showed that the fl uorescence PCR detection method based on gB gene can be used to identify IBRV, which has good sensitivity and speci fi city, and the sensitivity of 10 copies/u L, namely 0.02 TCID50, and no cross reaction with other virus.
Key words:Bovine infectious rhinotracheitis virus; Real-time quantitative PCR
牛传染性鼻气管炎病毒(Bovine infectious rhinotracheitis virus,IBRV),也称为1型牛疱疹病毒(BHV-1),是引起牛的一种急性、热性、接触性传染病的病原。牛传染性鼻气管炎(infectious bovine rhinotracheitis,IBR)1950年在美国首次被发现[1],如今世界各地均有发生。我国大部分省份的奶牛、肉牛、牦牛等均有不同程度感染。危害主要是牛生长缓慢,母牛流产和产奶量降低。另外,急性病患可引起肺炎,进而导致较大经济损失。牛在自然条件下多为隐性感染,并不定期排毒。灭活疫苗不能有效阻止该病毒的持续感染,常规弱毒疫苗又易引起持续感染和排毒[2],而gE基因缺失疫苗免疫,能起到较好的预防作用[3]。
IBR在我国被列为二类动物疫病,为进境动物严格检疫的传染病。血清中和试验或酶联免疫吸附试验等检测IBR抗体技术已被广泛使用,但是IBRV可通过空气、媒介物或直接接触传播,且传播速度非常快,一旦形成感染,14 d左右机体才能产生抗体,因而上述两种方法不适用于IBRV急性感染或早期感染的诊断。病毒分离鉴定过程用时长,工作效率低,也不符合疫病快速诊断的需要。PCR技术因其高度的特异性和灵敏度在疫病诊断上倍受青睐,还可直接检测潜伏期的体内病毒[7-9]。本研究拟以IBRV的保守基因gB基因为靶序列,建立检测IBRV的实时荧光定量PCR方法,以便IBR感染的临床检测。
1 材料与方法
1.1 病毒与细胞牛传染性鼻气管炎病毒(IBRV)参考株、牛肾细胞(bovine kidney cells,MDBK)、伪狂犬病病毒(Pseudorabies virus,PRV)、马立克病病毒(Marek's disease virus,MDV)CVI988病毒和鸭瘟病毒(Duck plague virus,DPV)弱毒疫苗均由本实验室保存。
1.2 试剂和仪器TaqMan Universal PCR Master Mix购自Applied Biosystems公司;病毒核酸提取试剂盒购自QIAGEN公司;荧光定量PCR使用Applied Biosystems 7500型荧光定量仪器扩增。
1.3 引物及探针从GenBank上获取I型IBRV的gB基因序列,使用DNAStar软件中的 Clustal V进行同源性分析,在57 417 bp~57 518 bp处设计特异性引物和TaqMan探针。gB-F:5'-TTGGCGCGGAC TACGTGTA-3',gB-102R:5'-CCGTGAGGTT TAGGTCCACAA-3',探针:5'-FAM-AGTGCCCC AGGAGGACTGGGT-BHQ1。
1.4 病毒扩增及DNA提取将1×105TCID50IBRV感染1×106MDBK细胞,72 h后收获细胞培养上清,在MDBK上测定TCID50。将IBRV、PRV、MDV和DPV的病毒基因组及空白MDBK细胞的DNA按试剂盒说明书进行提取其DNA,-80℃保存备用。
1.5 TaqMan荧光定量PCR的建立扩增反应总体系为20 μL:Premix ExTaq(Probe qPCR)(2×)10 μL、ROX Reference Dye II(50×)0.2 μL、DNA模板2 μL、经优化后的上下游引物(10 μmol/mL)各0.4 μL、探针(10 μmol/mL)0.8 μL,用灭菌ddH2O补足20 μL。优化后的反应条件:95℃预变性30 s;95℃变性5 s,60℃退火延伸34 s,40个循环,每个循环结束时进行荧光信号采集。
1.6 TaqMan荧光定量PCR敏感性、特异性和重复性试验
1.6.1 敏感性试验 将1×108copies/μL IBRVgB的重组质粒进行10倍梯度稀释,使其浓度依次为1×107~1×100copies/μL,用已建立好的TaqMan荧光定量PCR测定其敏感性。
1.6.2 特异性试验 分别提取的IBRV、PRV、MDV和DPV 基因组DNA及空白MDBK细胞DNA为模板,分别进行TaqMan荧光定量PCR,验证该方法的特异性。
1.6.3 重复性试验 提取不同TCID50滴度的IBRV基因组DNA,用上述建立的荧光定量PCR方法进行扩增,每个滴度的病毒DNA均做3个重复性试验。根据获得的Ct值来检验该方法的重复性。
2 结果与讨论
2.1 TaqMan荧光定量PCR标准曲线的建立当构建的IBRVgB质粒标准品以10倍稀释,最终浓度分别在1×107~1×100copies/μL时的标准曲线见图1,可知其相关系数R2为0.9994,线性关系良好。
2.2 TaqMan荧光定量PCR敏感性、特异性和重复性
2.2.1 敏感性试验 本研究使用BHV-1保守基因gB基因设计特异性TaqMan探针引物,检测灵敏度达10 copies/μL,即最低可检测0.02 TCID50病毒。杨少华等[4]利用巢式PCR鉴定IBRV,灵敏度为10 pg/50 μL;周斌华等[5]根据gB基因设计了引物进行PCR检测,检测核酸的灵敏度为1.2 pg/25μL;陈圣军等[6]利用SYBR Green I染料法检测IBRV,灵敏度为360 copies/25 μL,表明本研究建立的IBRV检测方法有较好的灵敏度。
2.2.2 特异性试验 为了检测该方法的特异性,本研究分别对提取PRV、MDV、DPV病毒基因组DNA和MDBK细胞的DNA,通过建立的IBRVgBTaqMan荧光定量PCR检测方法扩增。除IBRV有特征性的扩增曲线外,其他病毒均没有特征性的扩增曲线,说明该方法与其他疱疹病毒均无交叉反应,特异性强。
2.2.3 重复性试验 提取不同TCID50滴度的IBRV基因组DNA,用上述建立的荧光定量PCR方法进行扩增,样品DNA批内重复3次,若Ct值大于35,视为阴性,结果见图2。结果发现其检测下限为0.02 TCID50,其中20 000 TCID50~0.02 TCID50扩增的Ct值依次为16.87、19.95、23.14、26.63、29.11、30.44和34.62,且每个滴度的3次重复的变异系数均小于0.50%。本研究结果显示,建立的IBRV TaqMan荧光定量PCR 方法中的Ct值和病毒拷贝数的对数相关性良好,具有很好的重复性。
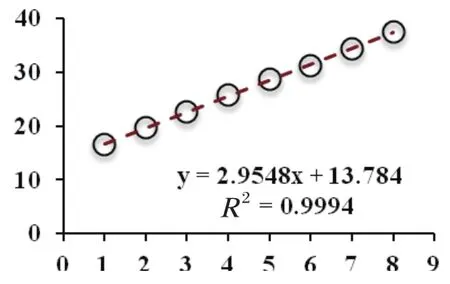
图1 IBRV gB TaqMan荧光定量PCR检测方法的标准曲线Fig. 1 Standard curve of TaqMan Real-time quantitative PCR for detection of IBRV gB
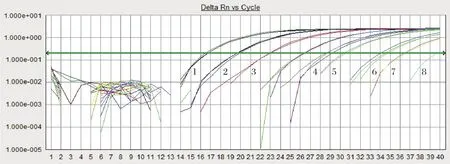
图2 IBRV gB TaqMan荧光定量PCR动力学曲线Fig.2 Dynamic curve of TaqMan Real-time quantitative PCR for detection of IBRV gB
IBRV的潜伏感染使牛成为重要的传染源,当机体受到以下因素,如日光暴晒、发热、创伤或其他微生物感染等影响后,潜伏的病毒被激活而导致发病[7]。因为IBRV可导致持续性感染,免疫并不能有效阻止野毒入侵和繁殖,防治本病的关键措施是对牛群进行定期检疫,控制传染源[8,9]。本研究建立的IBRV TaqMan荧光定量PCR 方法具有较强的敏感性性和较好的特异性、重复性,这将为IBR临床诊断和检测奠定基础。
[1] 蒋珊珊, 赵莎莎, 狄和双, 等. 牛传染性鼻气管炎病毒的荧光PCR检测方法[J]. 江苏农业科学, 2013, 41(1)∶ 45.
[2] 邓碧华, 王凯民, 唐泰山, 等. 牛传染性鼻气管炎病毒套式PCR检测方法的建立 [J]. 中国兽医学, 2008, (6)∶ 649.
[3] 季新成, 牛国辉, 员丽娟, 等. 牛传染性鼻气管炎病毒内标荧光定量PCR检测方法的建立与应用[J]. 中国兽医学报, 2010, 30(6)∶ 738-743.
[4] 杨少华, 王长法, 高运东, 等. 利用巢式PCR快速鉴定牛传染性鼻气管炎[J]. 家畜生态学报, 2007, 28(4)∶ 81-83.
[5] 周斌华. 牛传染性鼻气管炎病毒PCR检测方法的建立及在进境牛检疫中的应用[D]. 扬州∶ 扬州大学, 2006.
[6] 陈圣军, 孔繁德, 徐淑菲, 等. 牛传染性鼻气管炎和赤羽病基因芯片检测方法的建立和应用[J]. 中国预防兽医学报, 2013, 35(12)∶ 980-984.
[7] Kaashoek M J, Moerman A, Madić J,et al. A conventionally attenuated glycoprotein E2 negative strain of bovine herpesvirus type 1 is an efficacious and safe vaccine [J]. Vaccine, 1994, 12(5)∶ 439-444.
[8] Fuchs M, Hübert P, Detterer J,et al. Detection of bovine herpesvirus type 1 in blood from naturally infected cattle by using a sensitive PCR that discriminates between wild-type virus and virus lacking glycoprotein E [J]. J Clin Microbiol,1999, 37(8)∶ 2498-2507.
[9] Moeller R B Jr, Adaska J, Reynolds J,et al. Systemic Bovine herpesvirus 1 infections in neconatal dairy calves[J]. J Vet Diagn Invest, 2013, 25(1)∶ 136-141.
DEVELOPMENT OF TAQMAN PROBE REAL-TIME QUANTITATIVE PCR TO DETECT GB GENE OF BOVINE INFECTIOUS RHINOTRACHEITIS VIRUS
WANG Hai-jun1, WANG Shan-hui1, CHANG Li-li1, CHEN Hong-jun2
(1.Xuzhou Vocational College of Bioengineering, Xuzhou 221006, China; 2. Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
S852.659.1
B
1674-6422(2017)04-0064-04
2017-03-19
2014年徐州生物工程职业技术学院科研课题(2014B10)
王海军,男,兽医硕士,讲师,主要从事动物疫病的监测
陈鸿军,E-mail∶ vetchj@shvri.ac.cn

