奶牛源MRSA流行株的耐药特性SCCmecA分型研究
孟 丹,孟庆玲,乔 军,于伟伟,李重阳,才学鹏,陈创夫
(1.石河子大学动物科技学院,石河子 832003;2.中国农业科学院兰州兽医研究所,兰州 730046)
奶牛源MRSA流行株的耐药特性SCCmecA分型研究
孟 丹1,孟庆玲1,乔 军1,于伟伟1,李重阳1,才学鹏2,陈创夫1
(1.石河子大学动物科技学院,石河子 832003;2.中国农业科学院兰州兽医研究所,兰州 730046)
为了了解引起奶牛乳房炎的金黄色葡萄球菌分离株的耐药性及其分子流行病学特征,本研究采用纸片扩散法检测临床分离的71株金黄色葡萄球菌的耐药特性,并对耐甲氧西林金黄色葡萄球菌(Methicillin-resistant staphylococcus aureus,MRSA)进行判定;应用多重PCR方法对MRSA进行SCCmec分型。结果显示:在新疆地区71株金黄色葡萄球菌临床分离株中共检出13株MRSA,检出率为18.3%;金黄色葡萄球菌对呋喃妥因、利福平100%敏感,MRSA对头孢类、氟喹诺酮类和大环内酯类抗菌药物的耐药率明显高于甲氧西林敏感金黄色葡萄球菌(methicillin sensitive staphylococcus aureus,MSSA);MRSA的SCCmec基因型共以SCCmecⅠ和SCCmecⅣa型为主,均占76.9%,另外,1株MRSA仅有1种SCCmecⅢ型,1株MRSA有SCCmecⅠ、SCCmecⅢ和SCCmec Ⅳa型。本研究结果表明,MRSA耐药性多样,新疆地区MRSA主要流行株为SCCmecⅠ和SCCmec Ⅳa型。
耐甲氧西林金黄色葡萄球菌;耐药性;葡萄球菌染色体mec盒
Abstract:In order to understand antimicrobial resistant and epidemiological characteristics of Staphylococcus aureus(S.aureus) from cow mastitis, 71 clinical Staphylococcus aureus isolates were indenti fi ed and examined for their drug resistance using disk diffusion method in the present study. SCCmec genotyping was conducted using multiplex PCR method. The results show that a total of 13 methicillinresistant Staphylococcus aureus (MRSA) isolates were identified. These S. aureus isolates were 100% susceptible to Furadantin and Rifampicin. Drug resistance of MRSA isolates was signi fi cantly higher than that of methicillin-sensitive Staphylococcus aureus (MSSA)regarding cephalosporins, quinolones and macrolides tested. The SCCmecⅠand SCCmecⅣawere the predominant genotypes in the MRSA, both accounting for 76.9%. One isolate only showed SCCmecⅢ type and another isolate showed three types with SCCmecⅠ,SCCmecⅢ and SCCmecⅣa. In conclusion, that these MRSA isolates showed multiple resistance, and SCCmecⅠand SCCmecⅣawerethe predominant genotypes.
Key words:MRSA; antimicrobial resistance; SCCmec genotype
奶牛乳房炎是影响世界奶牛业发展,给乳品生产造成巨大损失的一种常见病和多发病。金黄色葡萄球菌(Staphylococcus aureus,SA)是引起奶牛乳房炎的主要病原微生物之一[1]。近年来,随着新疆奶牛养殖业的快速发展,乳房炎目前已经成为我区奶牛场危害最大、投入药费最多、防治最难的疾病之一,不仅严重影响奶牛的产乳量、降低牛奶的营养成分和品质,而且直接危害人类健康[2]。抗菌药物是防治奶牛乳房炎的一种有效手段。然而,一方面随着抗菌药的大量使用,耐药菌株也越来越多,使得常用药物疗效下降;另一方面,抗菌药物在牛奶中大量残留直接威胁着人类健康[3-5]。
耐甲氧西林金黄色葡萄球菌(MethicillinresistantStaphylococcus aureus,MRSA)是抗生素大量使用后产生的一种耐药菌株,可在人和动物之间交叉感染。近年来,耐甲氧西林金黄色葡萄球菌(MRSA)引起的感染呈不断上升趋势,且发病率和病死率高,给临床的抗感染治疗带来严峻挑战[6]。葡萄球菌染色体盒mec的结构与MRSA耐药谱密切相关,是MRSA分型的一个重要指标,也是金黄色葡萄球菌流行病学调查研究的重要工具[7-9]。本研究旨在分析金黄色葡萄球菌临床分离株的耐药性及分子流行病学特征,为临床奶牛乳房炎的合理用药治疗和保障牛奶产品的安全提供科学依据。
1 材料与方法
1.1 实验材料Baird-Parker培养基、BHI液体培养基购自青岛高科园海博生物技术有限公司;大肠杆菌(E.coli) DH5α菌种由本实验室保存;细菌基因组DNA提取试剂盒、pMD19-T载体、DNA Marker均购自TaKaRa公司;生化鉴定管购自杭州滨和微生物试剂有限公司;抗菌药物纸片购自杭州微生物试剂有限公司;质粒小量提取试剂盒和DNA凝胶回收试剂盒购自诺维森(北京)生物科技有限公司。
1.2 奶牛乳样品的采集从新疆维吾尔自治区五家渠、石河子、沙湾、玛纳斯4个地区的规模化奶牛场分别采集临床型乳房炎牛乳样品221份。通过温水清洗乳房并使用75%酒精棉球对乳头进行消毒处理,收集第3把奶后的奶样放于灭菌的试剂管中,置于冰盒中,运送实验室进行分离培养。
1.3 金黄色葡萄球菌的分离鉴定将采集的奶牛乳样接种于Baird-Parker培养基,放于37℃恒温箱培养12~48 h。挑取具有典型特征的单菌落,在营养琼脂培养基上进行纯化培养。对纯化菌进行涂片、革兰氏染色、镜检,然后随机选取分离株用金黄色葡萄球菌成套生化鉴定管测定其生化反应特性,最后根据GenBank中已公布的金黄色葡萄球菌16S rRNA的序列设计通用引物,对分离株进行16S rRNA序列比对分析,鉴定分离株为金黄色葡萄球菌。将分离的金黄色葡萄球菌在BHI肉汤中37℃培养24 h,再将500 μL 所得新鲜菌液加入到500 μL 40%甘油中震荡混合均匀制成20%甘油菌,-20℃保存备用。
1.4 药敏试验及MRSA鉴定用无菌接种环挑取单个菌落,接种于BHI培养液于37℃培养20~24 h,再用灭菌生理盐水将细菌浓度调至0.5麦氏浊度,取200 μL均匀涂布于MHA培养基,涂布均匀后贴上14种药敏纸片,放入37℃恒温培养箱中培养48 h后测量抑菌圈直径。30 μg头孢西丁抑菌环直径≤21 mm的菌株即为MRSA,进一步通过PCR方法扩增mecA来确定MRSA阳性菌。
1.5 MRSA菌株基因组DNA的提取用无菌接种环挑取单个菌落接种至无菌BHI培养液于37℃振荡过夜,取1.5 mL细菌培养液于10 800×g离心,去掉上清液,按细菌基因组DNA提取试剂盒的操作说明进行MRSA菌株基因组DNA的提取。提取的基因组DNA模板于-20℃保存,用于SCCmec分型研究。
1.6 SCCmec基因分型通过多重PCR方法和葡萄球菌染色体盒mec对MRSA进行SCCmec 的Ⅰ、Ⅱ、Ⅲ、Ⅳa、Ⅳb、Ⅳc、Ⅳd、Ⅴ 8个主要的型和亚型的检测,引物序列参考文献[10]。扩增的产物经测序分析来确定菌株的基因型。
2 结果
2.1 细菌的分离鉴定新疆维吾尔自治区4个地区的规模化奶牛场分别采集的221份临床型乳房炎牛乳样品,经分离培养基Baird-Parker培养后,分离菌株在培养基上长出灰黑色菌落(图1)。挑取的单菌落经革兰氏染色镜检后可见像葡萄样串状紫色球菌(图2)。共分离出71株金黄色葡萄球菌,生化鉴定试验结果显示,多数金黄色葡萄球菌能发酵蔗糖、乳糖、甘露糖、麦芽糖、蕈糖、果糖,缺氧环境中产酸不产气,尿素、精氨酸水解、乙酰葡糖胺、硝酸盐还原反应阳性,VP反应弱阳性,木糖、木醇、蜜二糖、山梨醇反应阴性。
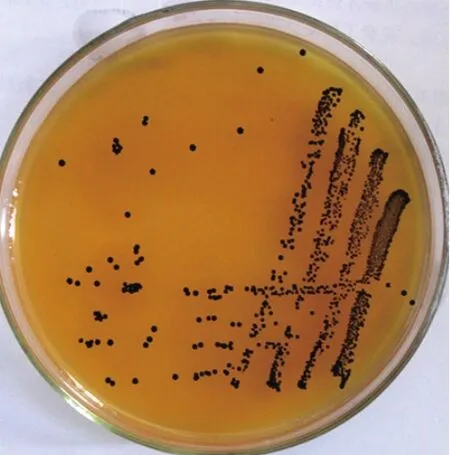
图1 金黄色葡萄球菌在Baird-Parker培养基的菌落形态Fig.1 The colony morphology of SA in Baird-Parker
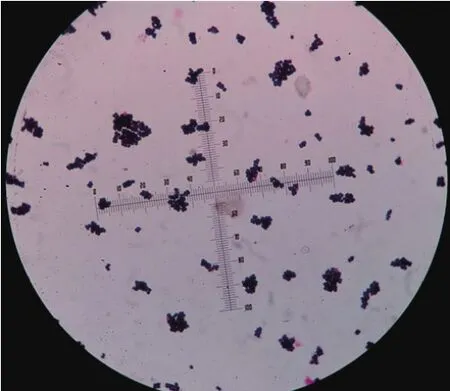
图2 金黄色葡萄球菌革兰氏染色镜检菌落形态Fig.2 The colony morphology of SA by Gram staining
2.2 16S rRNA序列比对分析对分离株SA-xj06、SA-xj10、SA-xj13、SA-xj27、SA-xj42与金黄色葡萄球菌标准株S.aureusECNU-UA1、大肠杆菌标准株E.coliATCC35496和3株链球菌标准株S.OligofermentansAS1.3089、S. cristatusPD01A5、S.australisChDCB189进行16S rRNA序列比对结果显示,分离株与金黄色葡萄球菌S.aureusECNU-UA1亲缘性最近,同源性达100%,与大肠杆菌、链球菌亲缘性相对较远(图3)。
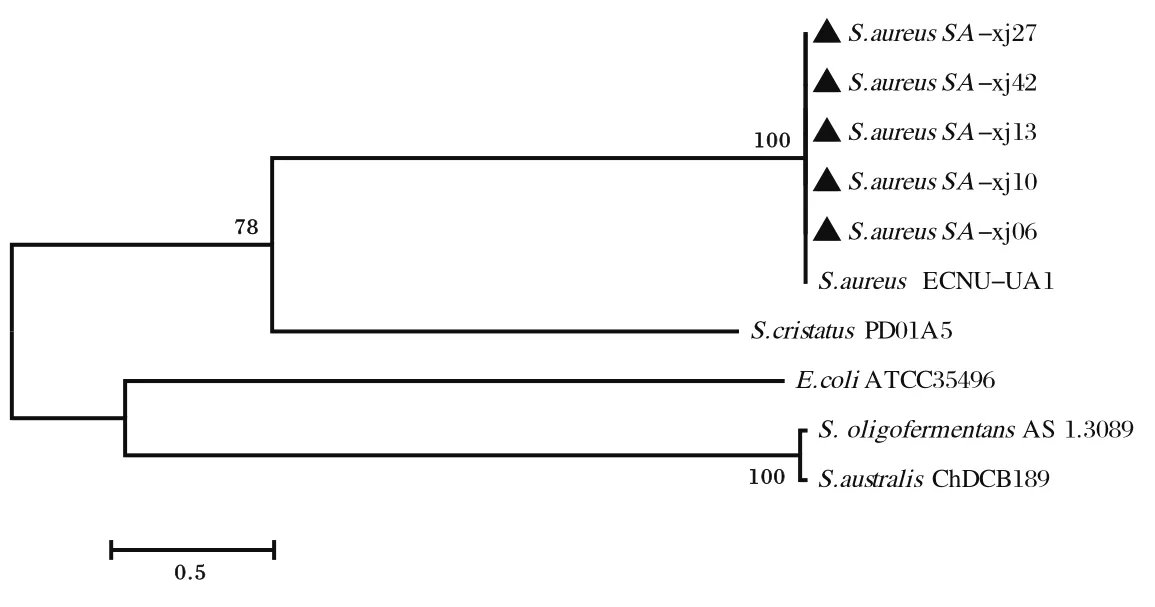
图3 16S rRNA序列比对结果Fig.3 The result of sequence alignment of 16S rRNA
2.3 MRSA检出率及药敏试验71株金黄色葡萄球菌中检出13株MRSA,MRSA检出率为18.31%,其余均为甲氧西林敏感金黄色葡萄球菌(methicillinsentive staphylococcus aureus,MSSA)流行株。综合考虑临床常用的抗金黄色葡萄球菌感染的药物、疗效、抑菌或杀菌强度以及经济因素等,选用14种抗生素进行药敏试验。结果显示:MRSA对抗菌药物的耐药表型明显多于MSSA(图4)。MRSA除了对甲氧西林耐药,对其他与甲氧西林相同结构的抗生素也会产生耐药,还可以通过改变抗生素作用靶位,对其他类抗生素产生不同程度的耐药。因此,MRSA对多种抗菌药物的耐药率也明显高于MSSA(表1)。
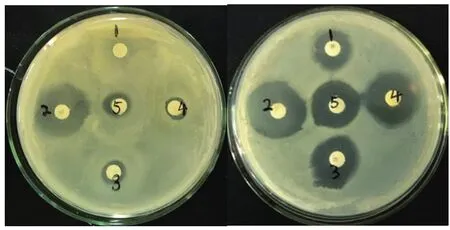
图4 MRSA(左)和MSSA(右)药敏试验结果Fig.4 The result of drug susceptibility of MRSA(Left)and MSSA(Right)
2.4 SCCmec基因多重PCR分型结果13株MRSA有11株能被分型,2株没有分型,多重PCR共检测到3种不同类型的特征性条带(图5)。其中SA-xj-13有1种分型,为SCCmecⅢ;SA-xj-14有3种分型,分别为SCCmecⅠ、SCCmecⅢ和SCCmecⅣa;其他菌株均有2种分型,分别为SCCmecⅠ和SCCmecⅣa(表2)。
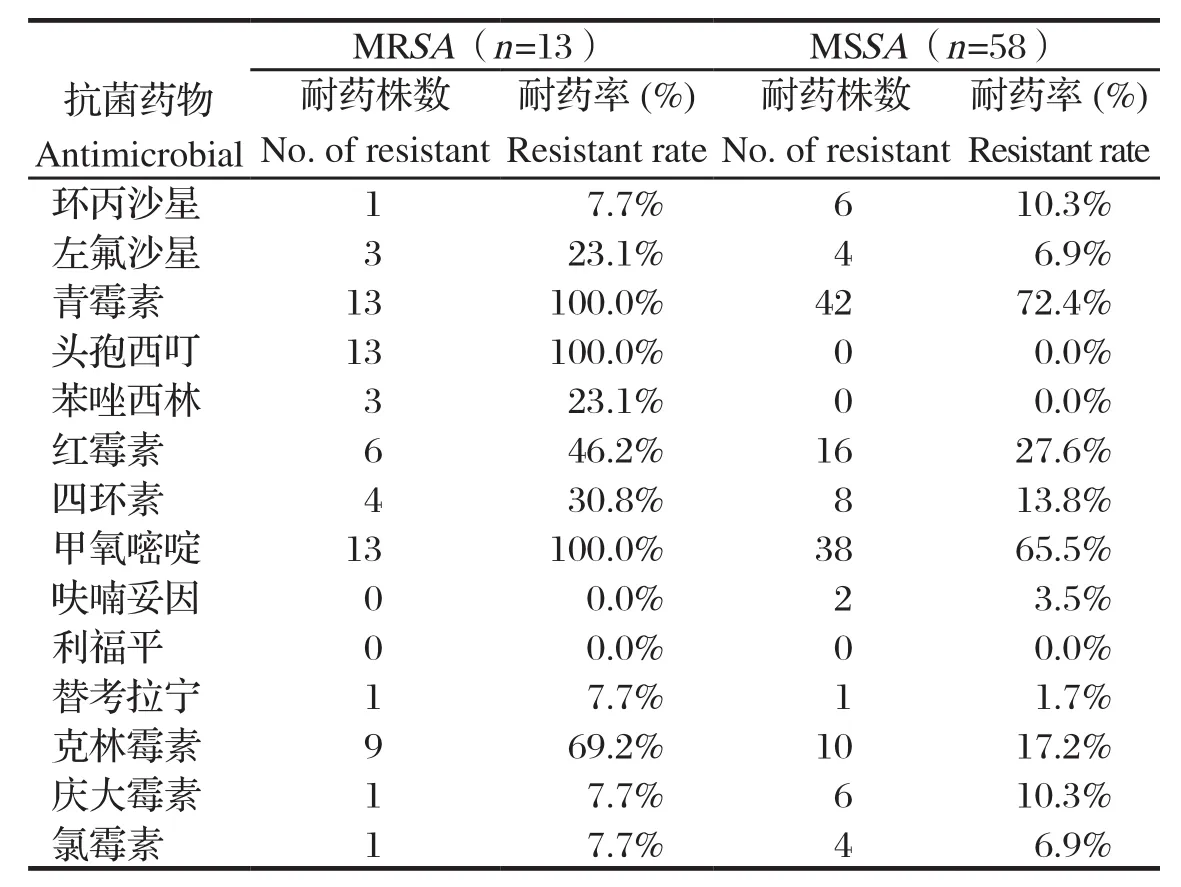
表1 MRSA与MSSA对抗菌药物的耐药率Table1 Drug resistance rates of the MRSA and MSSA

图5 13株MRSA SCCmec型结果电泳图Fig.5 PCR electrophoretogram of SCCmec genotypes of 13 MRSA strains
3 讨论
抗菌药物耐药菌株的高发病率和病死率已经严重威胁到人和动物的生命安全,并已成为全球关注的公共卫生问题[11]。世界卫生组织(world health organization,WHO)早在多年前就将耐药菌的监控作为重点研究项目[12]。我国的抗菌药物滥用现象比发达国家相对严重,而MRSA是引起动物感染疾病最难治疗的病原菌之一,针对MRSA的抗感染治疗在临床治疗中占有越来越重要的地位[13]。鉴于MRSA具有耐药性强、毒力因子多、传染性强、感染部位多、感染物种多及可能在不同物种间相互传播等特点,无疑会给人类和动物的健康带来巨大威胁[14]。本研究在奶牛临床乳房炎样品中MRSA的检出率达16.9%,与MSSA相比,13株MRSA对青霉素、甲氧嘧啶和头孢西叮的耐药率达100%,对四环素、红霉素和克林霉素的耐药率明显增加,同时还出现了对环丙沙星、氯霉素、左氟沙星、替考拉宁、庆大霉素的耐药菌株,且同一株菌出现耐多种抗生素的情况,耐药形势不容乐观。从耐药谱及基因型分析,仅SCCmecⅢ型菌株对氨基糖苷类和四环素类抗菌药物耐药,提示Ⅲ型SCCmec携带氨基糖苷类耐药基因及四环素耐药基因的质粒或转座子,如pT181质粒和Tn554转座子[15]。但随着抗生素不断加大的使用,也有可能使各耐药菌株产生了新的变化。
MRSA的耐药机制主要是产生一种新的青霉素结合蛋白(PBP),即PBP2a,编码PBP2a的mecA基因位于可移动元件SCCmec上,且不同的MRSA内的SCCmec结构存在较大差异,因此可分为不同的SCCmec基因型[16]。目前,全球主要为8种SCCmec基因型,其中又分为若干亚型[17]。本研究检出的MRSA中SCCmecⅠ型10株、SCCmecⅢ型2株,SCCmecⅣa型10株,未见其他型别。除了SA-xj-21和SA-xj-61没有检出型之外,SA-xj-13仅有SCCmecⅢ,SA-xj-14同时有SCCmecⅠ、SCCmecⅢ和SCCmecⅣa型,其他9株均同时检出有SCCmecⅠ和SCCmecⅣa型,由此可见,本研究中临床乳房炎样本检出的MRSA以SCCmecⅠ型和SCCmecⅣa为主。医学研究表明,通常认为SCCmecⅠ、SCCmecⅡ、SCCmecⅢ为医院相关性MRSA,SCCmecⅣ或SCCmecⅤ为社区相关性MRSA[18]。在本研究的动物源性MRSA中发现了SCCmecⅠ、SCCmecⅢ和SCCmecⅣa型,研究结果提示,在人源MRSA和动物源MRSA之间可能存在着相互联系,对于两者之间是否存在交叉感染,是通过怎样的传播机制发生人-畜感染尚需进一步探究。
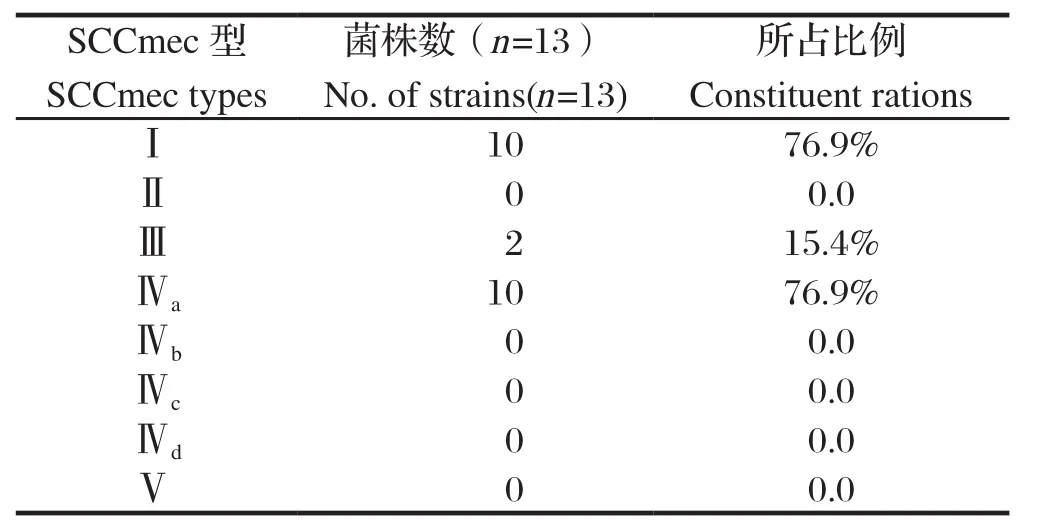
表2 13株MRSA SCCmec型检出构成比Table 2 Constituent rations of the SCCmec types and in the 13 strains of MRSA
[1] Yahaghi E, Fooladi A A I, Amin M,et al. Detection of Class I Integrons inStaphylococcus aureusIsolated From Clinical Samples[J]. Iran Red Crescent Me, 2014, 16(11)∶e16234.
[2] 简子健, 马素贞, 袁江玲, 等. 新疆克拉玛依地区奶牛隐性乳房炎病原菌的分离鉴定[J]. 动物医学进展, 2008,29(2)∶ 12-17.
[3] Stefani S, Chung D R, Lindsay J A,et al. MeticillinresistantStaphylococcus aureus(MRSA)∶ global epidemiology and harmonisation of typing methods[J]. Int J Antimicrob Ag, 2012, 39(4)∶ 273-282.
[4] 金耀忠,万世平, 姜法铭, 等. 奶牛乳房炎流行情况调查及主要病原分离与药敏试验[J]. 畜牧与兽医, 2011, 43(5)∶64-67.
[5] 徐修礼, 张鹏亮, 樊新, 等. Mohnarin2008 年度报告∶ 葡萄球菌和肠球菌耐药监测[J]. 中国抗生素杂志, 2010 (7)∶536-542.
[6] Xiao Y H, Giske C G, Wei Z Q,et al. Epidemiology and characteristics of antimicrobial resistance in China[J].Drug Resist Update, 2011, 14(4)∶ 236-250.
[7] International Working Group on the Classification of Staphylococcal Cassette Chromosome Elements(IWG-SCC). Classification of staphylococcal cassette chromosome mec (SCCmec)∶ guidelines for reporting novel SCCmec elements[J]. Antimicrob Agents Chemother, 2009, 53(12)∶ 4961-4967.
[8] 朱诗应, 戚中田. 16SrRNA扩增及测序在细菌鉴定与分类中的应用[J]. 微生物与感染, 2013, 8(2)∶ 104-109.
[9] 刘洋, 梁耀峰, 焦新安, 等. 中国部分地区猪源和牛源金黄色葡萄球菌耐药性及凝固酶分型研究[J]. 中国农业科学, 2012, 45(17)∶ 3608-3616.
[10] Zhang K, McClure J A, Elsayed S,et al. Novel multiplex PCR assay for characterization and concomitant subtyping of staphylococcal cassette chromosome mec types I to V in methicillin-resistantStaphylococcus aureus[J]. J Clin Microbiol, 2005, 43(10)∶ 5026-5033.
[11] Molton J S, Tambyah P A, Ang BSP,et al.The global spread of healthcare-associated multidrug-resistant bacteria∶ a perspective from Asia[J]. Clin Infect Dis,2013, 56(9)∶ 1310-1318.
[12] World Health Organization. WHO global strategy for containment of antimicrobial resistance[J]. 2001, 76 (38) ∶298-299 .
[13] Chao G, Zhang X, Zhang X,et al. Phenotypic and genotypic characterization of methicillin-resistantStaphylococcus aureus(MRSA) and methicillinsusceptibleStaphylococcus aureus(MSSA) from different sources in China[J]. Foodborne Pathog Dis, 2013, 10(3)∶214-221.
[14] Virdis S, Scarano C, Cossu F,et al. An-tibiotic Resistance inStaphylococcus aureusand Coagulase Negative Staphylococci Isolated from Goats with Subclinical Mastitis[J].Vet Med Int, 2010, 2010∶ 517060.
[15] Xiao M, Wang H, Zhao Y,et al. National surveillance of methicillin-resistantStaphylococcus aureusin China highlights a still-evolving epidemiology with 15 novel emerging multilocus sequence types[J]. J Clin Microbiol,2013, 51(11)∶ 3638-3644.
[16] Udo E E, Al-Sweih N, Dhar R,et al. Surveillance of antibacterial resistance inStaphylococcus aureusisolated in Kuwaiti hospitals[J]. Med Prin Pract, 2008, 17(1)∶ 71-75.
[17] Vandendriessche S, Vanderhaeghen W, Larsen J,et al. High genetic diversity of methicillin-susceptibleStaphylococcus aureus(MSSA) from humans and animals on livestock farms and presence of SCCmec remnant DNA in MSSA CC398[J]. J Antimicrob Chemother, 2014,69(2)∶ 355-362.
[18] Isobe H, Takano T, Nishiyama A,et al. Evolution and virulence of Panton-Valentine leukocidin-positive ST30 methicillin-resistantStaphylococcus aureusin the past 30 years in Japan[J]. Biomed Res, 2012, 33(2)∶ 97-109.
ANTIBIOTIC RESISTANCE AND SCCMECA GENOTYPING OF MRSA STRAINS FROM COW MASTITIS CASES
MENG Dan1, MENG Qing-ling1, QIAO Jun1, YU Wei-wei1, Li Chong-yang1, CAI Xue-peng2,CHEN Chuang-fu1
(1.College of Animal Science and Technology, Shihezi University, Shihezi 832003, China; 2. Lanzhou Veterinary Research Institute, CAAS,Lanzhou 730046, China)
S852.611
A
1674-6422(2017)04-0024-05
2016-11-29
兵团中青年科技创新领军人才计划(2016BC001);十三五国家重点研发计划子课题(2016YFD0500900);自治区科研创新项目(XJGRI2016040)
孟丹,女,硕士研究生,预防兽医学专业
乔军,E-mail∶ qj710625@163.com

