包载姜黄素纳米胶束的制备与体外抗肿瘤评价
范子梁,金冰慧,徐霞芳,蒋巧颖,徐荷林
(温州医科大学 药学院,浙江 温州 325035)
·论 著·
包载姜黄素纳米胶束的制备与体外抗肿瘤评价
范子梁,金冰慧,徐霞芳,蒋巧颖,徐荷林
(温州医科大学 药学院,浙江 温州 325035)
目的:构建载姜黄素纳米胶束,体外评价其对C6脑胶质瘤细胞的生长抑制作用。方法:合成新型十一烯酸-接枝-ε-多聚赖氨酸(ε-PLL-UNA)聚合物,并对其结构进行表征,采用芘荧光探针法对其临界胶束浓度进行测定;以ε-PLL-UNA为材料,采用透析法制备载姜黄素纳米胶束,以动态光散射和透射电镜对其粒径、形态进行表征,以动态透析法测定药物释放行为,以激光共聚焦显微镜观察体外细胞摄取性,以肿瘤球模型考察其体外抗肿瘤作用。结果:1H-NMR和FT-IR结果表明ε-PLL-UNA聚合物成功合成,其临界胶束浓度为0.19 g/L,能自发组装成胶束;载姜黄素纳米胶束载药量能达到12.22%±2.13%、包封率则高达85.12%±3.64%,平均粒径为(60.6±2.1)nm、Zeta电位为(28.2±5.6)mV,具有球形微观结构;该纳米胶束48 h释放84%的姜黄素,体外快速被C6细胞摄取;与姜黄素溶液相比,该纳米胶束能明显抑制胶质瘤细胞球的生长。结论:ε-PLL-UNA聚合物胶束对姜黄素具有较高的载药量,粒径小于100 nm、分布均匀,体外缓慢释放药物,提高了C6细胞对姜黄素的摄取,而且对C6细胞球具有有效的杀伤作用。
姜黄素;胶束;聚赖氨酸;十一烯酸;神经胶质瘤;细胞球
Abstract: Objective:To prepare a novel polymer micelles encapsulating curcumin (CUR) and evaluate its anti-tumor effect on glioma in vitro.Methods:A novel polymer, undecenoic acid-grafted-ε-polylysine (ε-PLLUNA), was synthesized, and its chemical structure was confirmed by1H-NMR and FT-IR. The CAC value of ε-PLL-UNA polymer was also detected by pyrene fluorescence probe. CUR-loaded micelle was prepared by dialysis method using ε-PLL-UNA as materials, and its particle size and morphology were also studied under dynamic light scattering (DLS) and transmission electron microscope (TEM), respectively. Furthermore, in vitro drug release profiles from CUR-Micelles were explored by dynamic dialysis method. Finally, the cellular toxicity against C6 cells spheroids and the cellular uptake of CUR-Micelles were evaluated.Results:ε-PLL-UNA polymer was successfully synthesized and able to self-assemble into micelles above its CAC value of 0.19 g/L. CUR-loaded micelle had a mean diameter of (60.6±2.1)nm, and zeta potential of (28.2±5.6)mV, exhibiting the spherical shape determined by TEM. Drug loading content and drug loading efficiency for CUR-loaded micelle were high up to 12.22%±2.13% and 85.12%±3.64%, respectively. About 84% of CUR were released from the micelles in 48 hours. CUR-loaded micelle can promote the cellular uptake of its encapsulated CUR by C6 cells, displaying a significantly higher cytotoxicity against C6 cells. Besides, the growth of C6 cells spheroids was significantly inhibited by CUR-loaded micelle.Conclusion:CUR is efficiently encapsulated in ε-PLL-UNA micelles with a particle size of less than 100 nm, which improved the cellular uptake of C6 cells. The sustained-release of CUR from CUR-loaded micelle is also observed. More importantly, CUR-Micelles has superior growth inhibition against C6 cells spheroids.
Key words:curcumin; micelles; polylysine; undecylenic acid; glioma; cells spheroids
姜黄素(curcumin,CUR)是一种天然酚类色素,广泛存在于姜黄属植物姜黄、莪术、郁金等的根茎中,是姜黄的重要活性成分。姜黄素对机体各系统作用广泛,具有较好的抗氧化、抗炎、抗动脉粥样硬化、抗肿瘤等药理作用,且毒性低、不良反应小[1]。但姜黄素存在水溶性差、难吸收、易降解等缺点,限制了其在临床上的推广应用。为克服以上不足,可将其制成磷脂复合物、固体分散体、包合物和聚合物胶束等[2]。本实验室以ε-聚赖氨酸(ε-polylysine,ε-PLL)为亲水嵌段、十一烯酸(10-Undecenoic acid,UNA)为疏水嵌段合成新型十一烯酸-接枝-ε-多聚赖氨酸(ε-PLL-UNA)聚合物。以该聚合物为纳米材料,自发组装成胶束,装载姜黄素,制备载姜黄素纳米胶束,评价其体外抗肿瘤效果。
1 材料与仪器
1.1 材料 ε-PLL-UNA(链段分子量:ε-PLL为5 000 Da,UNA为184 Da)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS)、姜黄素(98%)、芘荧光探针(分析标准品)购自上海阿拉丁公司;DMEM培养基、胎牛血清购自美国Gibco公司,2-(2-甲氧基-4-硝苯基)-3-(4-硝苯基)-5-(2,4-二磺基苯)-2H-四唑单钠盐(CCK-8)购自日本株式会社同仁化学研究所,DAPI购自美国Sigma公司。1.2 仪器 FD-1C冷冻干燥机(北京天德佑有限公司),JEOLJEM-2000EX透射电镜(transmission electron microscope,TEM)(日本JEOL公司),SpectraMax M3酶标仪(美国Molecular Devices公司),马尔文纳米粒度电位仪Zetasizer Nano ZSP(英国Malvern公司),Bruker Tensor 27红外光谱仪、Bruker AV-600核磁共振仪(德国Bruker公司),Nikon A1R/A1激光共聚焦显微镜(日本Nikon公司)。
2 方法
2.1 ε-PLL-UNA聚合物的合成与结构确证 称取2 g的聚赖氨酸溶于20 mL DMSO溶液中,超声1 h直至完全溶解。另取1 mL UNA先溶于6 mL DMSO中,加入0.750 g EDC和0.120 g NHS室温搅拌溶解,活化UNA的羧基。将UNA/DMSO溶液缓慢滴加到ε-PLL溶液中,室温搅拌反应24 h后,用1 L蒸馏水透析48 h(每隔8 h,换水1次),冻干得到固体粉末。
真空干燥的ε-PLL-UNA聚合物粉末约5 mg与200 mg KBr粉末充分研磨混合,压片制样,KBr空白片扣除背景,扫描范围4 000~400 cm-1。分辨率为4 cm-1,谱峰读数精度为0.01 cm-1。ε-PLL-UNA的核磁共振氢谱鉴定在Bruker AV-600核磁共振仪上完成,所有样品经过DMSO-d6处理。
2.2 临界胶束浓度测定 荧光探针芘标准贮备溶液的配制(6×10-6mol/L):用分析天平准确地称取0.0012 g芘,烧杯中用适量丙酮溶解后转入1 L容量瓶中,用丙酮定容并摇匀,配制得到浓度为6×10-6mol/L的芘丙酮贮备溶液,使用时在胶束水溶液中保持6×10-7mol/L的最终浓度。
胶束系列标准工作溶液的配制:分别取1 mL配制的芘丙酮溶液于8个烧瓶中,让其完全挥发备用。再称取100 mg冻干材料粉末于1 L容量瓶中,加水溶解定容,取不同量上述胶束溶液进行稀释,配制8个不同的溶液浓度,分别为0.72、0.36、0.144、0.072、0.036、0.0144、0.0072、0.0036 g/L;将不同浓度的胶束水溶液分别取10 mL,分别加入上述含芘的烧瓶中。
2.3 载姜黄素纳米胶束的制备 称取8~16 mg姜黄素以及100 mg ε-PLL-UNA聚合物,溶于6 mL DMSO中,磁力搅拌使其完全溶解;在剧烈搅拌下,将4 mL姜黄素DMSO溶液缓慢滴入聚合物溶液中,室温避光搅拌5 min,混合均匀,将混匀后液体转移至透析袋内(透析膜截留分子量为3 500 Da),对蒸馏水透析24 h,开始每隔12 h换水1次除去有机溶剂,5 000 r/min离心除去药物沉淀,得上清液,即为载姜黄素纳米胶束(CUR-Micelles)。选取不同总投药量(8、10、12、14、16 mg),固定材料每次用量为100 mg,以考察最大载药量和包封率。
2.4 载姜黄素纳米胶束的表征 聚合物纳米粒水溶液过0.45 μm膜,经适当稀释后,于常温条件下固定激光波长为632.8 nm、散射角90°,使用动态光散射激光粒度测定仪(dynamic light scattering,DLS)测定纳米胶束粒径和Zeta电位;TEM检测纳米胶束形态,取载药纳米胶束滴于铺有碳膜的铜网上,以无纤维滤纸从铜网边缘吸掉多余液体,滴入2%磷钨酸染色,自然晾干2 d,置于TEM中以100 kV加速电压检视、拍照。
2.5 载姜黄素纳米胶束体外释放 取1 mL载药量为200 μg姜黄素纳米胶束加至透析袋内(截留分子量为3 500 Da),扎紧密封两端,放置在含有0.5%吐温80的10 mL pH 7.4 PBS释放介质中,置水浴摇床于37 ℃,120 r/min震摇,不同时间点用全新的10 mL释放介质替换原有的介质,用紫外分光光度计测定姜黄素在431 nm的吸光度,代入标准曲线换算浓度,计算累积释放率,绘制释放曲线。以DMSO溶解的姜黄素溶液剂(CUR solution)作为对照,采用同样的方法进行体外释放实验。
2.6 载姜黄素纳米胶束的载药量及包封率测定
2.6.1 紫外分光光度法测定姜黄素浓度方法的建立:准确移取150 μg/mL姜黄素储备液0.1、0.2、0.3、0.4、0.5、0.7 mL于10 mL容量瓶中,用DMSO定容,摇匀,待测。用紫外分光光度计在431 nm波长下测定吸光度,根据所得的吸光度A和相应的浓度C作标准曲线。
精密量取空白纳米胶束1 mL(20 mg/mL)置于10 mL量瓶中,分别加入姜黄素储备液0.3、0.5、0.7 mL,配制成质量浓度为4.5、7.5、10.5 μg/mL的溶液,每个浓度水平3份,加DMSO超声波(240 W,40 kHz)处理20 min,DMSO稀释至刻度,摇匀,经0.22 μm微孔滤膜过滤后,紫外检测431 nm的吸光度,带入标准曲线换算成浓度。
2.6.2 载药量及包封率测定:取0.2 mL载药纳米胶束至10 mL容量瓶中,加入DMSO定容至刻度线,用紫外分光光度计在431 nm处测定吸光度。按照下列公式计算载药量及包封率:

2.7 载姜黄素纳米胶束的体外抗肿瘤效果
2.7.1 C6胶质瘤细胞的培养:C6胶质瘤细胞(上海生物化学与细胞生物学研究所)使用含有10%胎牛血清的DMEM高糖培养基,待培养皿细胞融合率达85%,用含有0.25% EDTA的胰酶至培养箱中消化30 s,进行传代培养。
2.7.2 CCK8法细胞毒性实验:将对数生长期的C6细胞消化后,用培养液稀释至4×103个/mL细胞密度,吹打后以100 μL/每孔将细胞悬液接种在96孔板中,将96孔板置细胞培养箱中孵育24 h使细胞贴壁。待贴壁后,加入100 μL含有游离药物或载药纳米胶束的新鲜培养介质以及不做任何处理的空白对照,继续培养24 h后,将96孔板取出,吸出所有培养基,用PBS清洗1次,每个孔加入100 μL新鲜培养基后再加入10 μL/每孔CCK8试剂,置培养箱中继续孵育2 h后,酶标仪测定450 nm处吸光度。按照如下公式计算细胞存活率(%)。以改良寇氏计算法计算抑制50%细胞生长时的药物浓度,即IC50值。
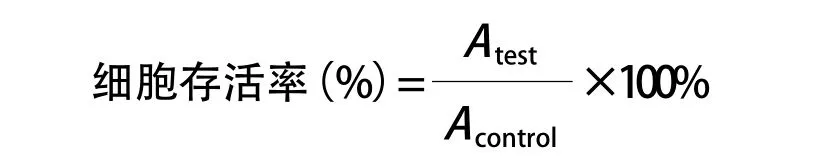
Atest为测试组的吸光度,Acontrol为对照组的吸光度
2.7.3 细胞摄取实验:C6细胞以1×105个/mL密度,接种1 mL在激光共聚焦显微镜专用培养皿中,置细胞培养箱孵育24 h使细胞贴壁后,移去培养液,加入1 mL含有游离药物或载药纳米胶束的细胞培养液(相当于2 μg/mL姜黄素),继续置细胞培养箱孵育1 h或4 h。移去含药细胞培养液,加入4 ℃的PBS终止细胞摄取,PBS冲洗细胞3次,4%多聚甲醛固定细胞20 min,PBS冲洗3次,加入100 μL DAPI试剂,避光染色细胞核10 min,PBS冲洗3次,加入100 μL抗荧光猝灭剂封闭细胞,将培养皿置于激光共聚焦显微镜中拍照。
2.7.4 肿瘤球抑制实验:取对数生长期的C6细胞,0.25%胰酶消化后吹打成单细胞悬液,用无血清培养基、含青霉素100 U/mL、链霉素100 μg/mL、EGF 20 ng/mL、bFGF 20 ng/mL以及B27添加物(1×)的DMEM/F12培养液(serum-free medium,SFM)重悬,以每孔104个细胞的浓度分别接种于低吸附塑料48孔板,于37 ℃、5% CO2恒温培养箱中培养,根据细胞生长的速度及培养液的颜色变化更换培养液。待细胞球直径生长到200 μm左右时,移除培养基,加入0.5 mL含有游离药物或载药纳米胶束的细胞培养液(相当于2 μg/mL姜黄素),观察3 d后细胞球形态变化。
2.8 统计学处理方法 采用SPSS16.0统计软件进行统计分析。计量资料以 ±s表示,2组间比较采用t检验,多组间比较采用单因素方差分析。 P<0.05为差异有统计学意义。
3 结果与讨论
3.1 ε-PLL-UNA的合成 从聚赖氨酸、十一烯酸和产物的1H-NMR谱中,可以看到在1.1 ppm和4.0 ppm之间的峰属于聚赖氨酸的专属峰,峰值在3.77、3.09、1.74和1.35~1.47 ppm分别属于聚赖氨酸骨架中次甲基[CO-CH(NH2)-]、次甲基末端(CH2NH-)和亚甲基(-CH2-CH2-)峰[3]。在十一烯酸图谱中的1.25~1.45、2.01、2.18、4.92和5.80 ppm分别是亚甲基(-CH2-CH2-),双键旁边的亚甲基(CH2=CHCH2-),羧基旁边的亚甲基(COOH-CH2-),次甲基(CH2=CH-)以及双键末端亚甲基(CH2=CH-)。除此之外还有在11.99 ppm处有明显特异性的羧基峰。见图1A。而产物中峰都能在反应物中找到相应的归属,除了十一烯酸羧基峰消失,说明十一烯酸的羧基已和聚赖氨酸的氨基进行了反应从而导致其消失[4]。
对反应前后的红外图谱进行分析,结果如图1B所示,PLL中3 238 cm-1处的强宽峰为缔合氨基(N-H)伸缩振动峰,在1 671 cm-1与1 561 cm-1的2个峰分别是酰胺I带和I I带;UNA的2 923 cm-1和1 706 cm-1处的吸收峰分别是烯烃的C-H和羧基的C=O的伸缩振动。产物中出现的2 925、1 676 cm-1吸收峰与十一烯酸的特征峰相一致,同样的3 247、1 681、1 570 cm-1这3个吸收峰也与聚赖氨酸的(N-H)伸缩振动峰、酰胺I带和I I带相对应。

图1 十一烯酸-接枝-ε-多聚赖氨酸的1H-NMR图谱(A)和红外图谱(B)
3.2 临界胶束浓度测定 芘增溶于不同浓度的胶束溶液中的荧光发射光谱结果表明,随着胶束浓度增加,芘的第一峰与第二峰荧光强度之比(I1/I2)依次降低,当浓度增大到一定值时曲线会发生突变,芘荧光特性的突变表明其所处环境极性的变化,即开始形成胶团(见图2A)。I1/I2的拟合曲线结果显示,2条拟合曲线的交点就是临界胶束浓度(critical micelle concentration,CMC)值,ε-PLL-UNA胶束的CMC值为0.19 g/L(见图2B)。
3.3 载姜黄素纳米胶束的表征
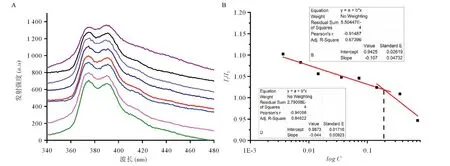
图2 芘在不同浓度胶束溶液中的荧光发射光谱(A)和I1/I2比值随胶束浓度变化图(B)
3.3.1 载药量与包封率:透析法为制备嵌段聚合物纳米胶束的经典方法,该方法制备的纳米胶束载药量和包封率等容易受处方和工艺因素的影响。通过固定工艺因素,考察嵌段聚合物的最大载药量、包封率。紫外分光光度法测定载药量与包封率,结果表明,姜黄素在1.5~10.5 μg/mL范围内,吸光度A与浓度C呈线性,曲线方程A=0.13826C-0.0021,线性相关良好(R2≥0.998)。经回收率实验表明,姜黄素低、中、高3种浓度回收率均大于95%,达到准确测定的要求。当投药量与聚合物的比例为1∶8时,可以获得最大载药量和包封率,分别高达12.22%±2.13%和85.12%±3.64%。
3.3.2 载姜黄素纳米胶束的表征:以最佳处方制备空白纳米胶束、载药纳米胶束,分别测定其粒径和Zeta电位结果。空白纳米胶束平均粒径为(53.7±3.4)nm和Zeta电位为(30.7±4.2)mV,姜黄素装载对纳米胶束粒径有一定的影响,姜黄素装载后纳米胶束粒径增大,Zeta电位基本没有变化,其粒径为(60.6±2.1)nm,呈现窄的粒径分布(见图3A),Zeta电位为(28.2±5.6)mV。
2%磷钨酸负染后,TEM观察纳米胶束形态结果表明载药纳米胶束呈白色的球形粒子且分布均匀,TEM测量的粒径为55 nm,比DLS测定的水合直径稍有偏低(见图3B)。这是因为TEM测定前需对样品进行干燥、脱水和抽真空等处理,使载药纳米胶束水化层皱缩,纳米胶束粒径缩小[5]。
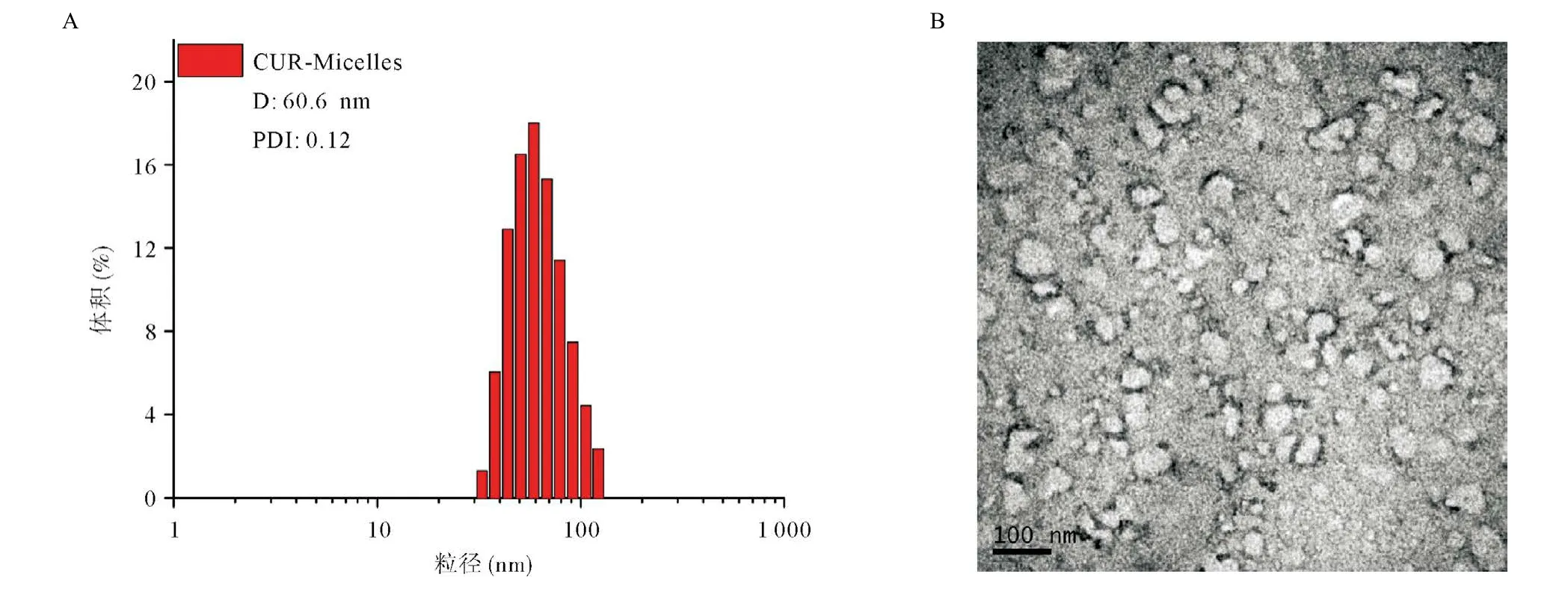
图3 载姜黄素纳米胶束的粒径分布(A)和透射电镜观察(B,×100 000)
3.4 体外药物释放 在pH 7.4条件下,姜黄素从CUR solution和CUR-Micelles中的释放曲线结果可以看出姜黄素从纳米胶束制剂中释放的速率明显比溶液剂缓慢,其在溶液剂中于12 h内释放达98%,而在纳米胶束制剂中需延长至48 h释放才到84%,见图4。3.5 细胞毒性和细胞摄取 空白材料(ε-PLL-UNA)、CUR solution和CUR-Micelles的细胞生长抑制结果表明,ε-PLL-UNA组在整个测试浓度范围内细胞存活率大于90%,表明其不影响细胞存活;CUR solution组在测试浓度范围内,细胞生存率大于89%,IC50为(21.5±0.43)μg/mL;而CUR-Micelles组对C6细胞的存活率随着姜黄素浓度的升高而下降,其IC50为(1.95±0.12)μg/mL,明显低于CUR solution组,差异有统计学意义(t=8.46,P<0.05),见图5A。据报道包裹在聚合物纳米胶束中药物,一般是以内吞机制进入细胞,因而使得药物更有效的作用在细胞内,杀伤肿瘤细胞[3]。这一假设从细胞摄取结果中得到进一步确证。
在CUR浓度为2 μg/mL时,C6细胞与CUR solution和CUR-Micelles孵育1 h和4 h后,细胞摄取结果表明CUR solution组不管是在1 h还是4 h,细胞内的荧光都明显比CUR-Micelles组低;除此之外CUR-Micelles组荧光甚至分布在细胞核内,细胞核DAPI荧光也可以发现CUR-Micelles组的细胞核有很多明显的皱缩[6]。见图5B。以上两个方面也解释了CUR-Micelles杀伤作用显著的原因。

图5 ε-PLL-UNA、CUR solution和CUR-Micelles对C6细胞的毒性(A)和C6细胞对不同制剂的摄取结果(B,×200)
3.6 肿瘤球生长抑制 近年来有研究发现肿瘤组织的无限增殖与自我更新可能与肿瘤组织内部的肿瘤干细胞有关,研究报道细胞成球培养能使肿瘤干细胞富集[7]。姜黄素被报道具有肿瘤干细胞抑制作用[8]。因此我们进一步构建了3D胶质瘤细胞球,以空白对照组和CUR solution组对比,体外考察了CUR-Micelles组对肿瘤球生长的抑制作用。结果表明,相比CUR solution,CUR-Micelles培育3 d后,与0 d对比,肿瘤球体积显著下降,差异有统计学意义(t=6.74,P<0.05),见图6,表明纳米胶束制剂能够有效地增加姜黄素对肿瘤干细胞的杀伤作用,其具体机制可能与增加药物的穿透有关[9]。

图6 空白对照组、CUR solution组和CUR-Micelles组处理3 d后,胶质瘤细胞球的显微图(A,×200)和肿瘤球体积大小(B)比较
4 结论
本研究利用十一烯酸为疏水基,聚赖氨酸为亲水骨架构建一个新型接枝聚合物ε-PLL-UNA,实现对疏水性姜黄素装载,初步探索其对C6脑胶质瘤细胞的抑制效果。结果表明该接枝聚合物胶束实现对姜黄素具有一定的载药量和包封率。载药纳米胶束能显著延缓药物的释放,延长药物作用时间。药物摄取实验表明,该聚合物胶束有效促进姜黄素被C6细胞摄取,甚至能深入到细胞核,有效杀伤肿瘤细胞。体外肿瘤球实验也表明这种新型胶束能有效地抑制C6肿瘤细胞球的生长。为了进一步确定该载药纳米胶束对动物模型的效果,接下来需要进行体内药动学以及药效学的研究。
[1] 肖长坤. 姜黄属植物的化学成分研究进展[J]. 中国实验方剂学杂志, 2 0 1 2, 1 8(2 1): 3 3 9-3 4 7.
[2] MAITI K, MUKHERJEE K, GANTAIT A, et al. Curcuminphospholipid complex: preparation, therapeutic evaluation and pharmacokinetic study in rats[J]. Int J Pharm, 2007,330(1-2): 155-163.
[3] XU H L, MAO K L, LU C T, et al. An injectable acellular matrix scaffold with absorbable permeable nanoparticles improves the therapeutic effects of docetaxel on glioblastoma[J]. Biomaterials, 2016, 107: 44-60.
[4] XU H, CAI C, GOU J, et al. Self-assembled monomethoxy (polyethylene glycol)-b-P (D, L-lactic-co-glycolic Acid)-b-P (L-glutamic acid) hybrid-core nanoparticles for intracellular pH-triggered release of doxorubicin[J]. J Biomed Nanotechnol, 2015, 11(8): 1354-1369.
[5] XU H, YANG D, CAI C, et al. Dual-responsive mPEGPLGA-PGlu hybrid-core nanoparticles with a high drug loading to reverse the multidrug resistance of breast cancer: an in vitro and in vivo evaluation[J]. Acta Biomater,2015, 16: 156-168.
[6] ZHANG B, ZHANG Y, LIAO Z, et al. UPA-sensitive ACPP-conjugated nanoparticles for multi-targeting therapy of brain glioma[J]. Biomaterials, 2015, 36: 98-109.
[7] KANTARA C, O’CONNELL M, SARKAR S, et al. Curcumin promotes autophagic survival of a subset of colon cancer stem cells, which are ablated by DCLK1-siRNA[J].Cancer Res, 2014, 74(9): 2487-2498.
[8] LIANG D S, SU H T, LIU Y J, et al. Tumor-specific penetrating peptides-functionalized hyaluronic acid-d-α-tocopheryl succinate based nanoparticles for multi-task delivery to invasive cancers[J]. Biomaterials, 2015, 71: 11-23.
[9] ZUO Z Q, CHEN K G, YU X Y, et al. Promoting tumor penetration of nanoparticles for cancer stem cell therapy by TGF-β signaling pathway inhibition[J]. Biomaterials, 2016,82: 48-59.
(本文编辑:贾建敏)
Preparation and in vitro antitumor evaluation of curcumin-loaded micelles
FAN Ziliang, JIN Binghui,XU Xiafang, JIANG Qiaoying, XU Helin. School of Pharmaceutical Sciences, Wenzhou Medical University,Wenzhou, 325035
R94
A
10.3969/j.issn.2095-9400.2017.09.001
2017-03-10
国家自然科学基金青年基金资助项目(81603036);浙江省医药卫生科技计划项目(2016KYA136);浙江省大学生科技创新活动计划暨新苗人才计划项目(2017R413059)。
范子梁(1994-),男,安徽合肥人,硕士生。
徐荷林,硕士生导师,Email:xhlpharm1214@126.com。

