丹酚酸A对大鼠脑缺血再灌注后细胞凋亡的保护作用及其机制
彭潇,方世记,郑丽云,邱伟文
(1.温州医科大学附属第五医院 神经内科,浙江 丽水 323000;2.温州医科大学附属第五医院 介入科,浙江 丽水 323000;3.温州医科大学附属第六医院 神经内科,浙江 丽水 323000)
丹酚酸A对大鼠脑缺血再灌注后细胞凋亡的保护作用及其机制
彭潇1,方世记2,郑丽云1,邱伟文3
(1.温州医科大学附属第五医院 神经内科,浙江 丽水 323000;2.温州医科大学附属第五医院 介入科,浙江 丽水 323000;3.温州医科大学附属第六医院 神经内科,浙江 丽水 323000)
目的:探讨丹酚酸A(Sal A)对大鼠脑缺血再灌注后细胞凋亡的保护作用及其机制。方法:采用线拴法构建大脑中动脉缺血再灌注(MCA-IR)模型。将正常SD大鼠随机分为假手术组(对照组)、MCA-IR模型组(MCA-IR组)、Sal A+MCA-IR组(Sal A组);Sal A组于建模前1周每日腹腔注射1.0、2.5、5.0 mg/kg Sal A。于再灌注后24 h取梗死脑组织用TUNEL法检测脑细胞凋亡,Western blot检测磷酸化Akt(p-Akt)和Akt的表达,免疫组织化学法检测海马区胞浆型磷脂酶A2(cPLA2)的表达。结果:Sal A组海马CA1区细胞凋亡率和MDA含量较MCA-IR组降低,而SOD量较MCA-IR组显著增加(P<0.05),MCA-IR组海马区p-Akt表达较对照组显著下降(P<0.05),而cPLA2较对照组显著增高(P<0.05),1.0、2.5、5.0 mg/kg Sal A预处理后,MCA-IR模型大鼠海马区cPLA2表达显著降低(P<0.05),而p-Akt表达显著增加(P<0.05)。结论:Sal A降低缺血再灌注损伤后细胞凋亡,起到损伤保护作用,其机制与其降低cPLA2表达,激活Akt信号通路有关。
丹酚酸A;细胞凋亡;蛋白激酶B;脑缺血再灌注;大鼠
Abstract: Objective:To investigate the protective effect of salvianolic acid A (Sal A) against apoptosis in cerebral ischemia-reperfusion model and its mechanism.Methods:SD rats were randomly divided into sham operation group (sham group), middle cerebral artery ischemia reperfusion model (MCA-IR) group (MCA-IR group), Sal A pretreatment and MCA-IR group (Sal A+MCA-IR group). MCA-IR was established in MCA-IR group and Sal A+MCA-IR group in which rats were pre-treated with 1.0, 2.5, 5.0 mg/kg Sal A via intraperitoneal injection daily for 1 week. The artery were reperfused for 24 h and rats were sacrificed. TUNEL was used to assayed the cell apoptosis, immunohistochemistry was implied to test the expression of cPLA2 and Western blot was undergone to analyzed p-Akt and total Akt. Immunohistochemistry was used to analyze the expression of cPLA2.Results:The apoptosis rate and MDA level in Sal A+MCA-IR group was lower, but SOD was higher than that in MCA-IR group (P<0.05). The expression of p-Akt in Hippocampus of MCA-IR model decreased, while the expression of cPLA2 increased significantly compared with control group. 1.0, 2.5, 5.0 mg/kg Sal A pretreatment reversed the decrease of p-Akt and increase of cPLA2.Conclusion:Sal A inhibits the apoptosis through decreasing the expression of cPLA2 and activating Akt pathway signaling in MCA-IR model.
Key words:salvianolic acid A; apoptosis; protein kinase B; ischemia-reperfusion; rats
脑缺血再灌注引起的细胞凋亡和氧自由基的释放是脑缺血严重临床症状的主要原因[1-2]。研究证实胞浆型磷脂酶A2(cytosolic phospholipase A2,cPLA2)通过调节细胞内脂质分子的代谢,参与脑缺血再灌注诱导的细胞凋亡[3-4]。丹酚酸A(sal-vianolic acid A,Sal A)是丹参药物重要提取成分之一,是一种氧自由基清除剂,对氧化应激引起的细胞损伤具有保护作用[5-6]。但Sal A对脑缺血再灌注过程细胞凋亡的影响及其机制仍未明确。因此,本研究采用大脑中动脉缺血再灌注(middle cerebral artery ischemia reperfusion,MCA-IR)模型,研究Sal A对MCA-IR模型海马区细胞凋亡的影响及其机制。
1 材料和方法
1.1 材料
1.1.1 主要试剂:Sal A购买于美国Sigma公司,TUNEL凋亡试剂盒购于上海碧云天生物技术有限公司,p-Akt、Akt、β-Actin单克隆抗体购买于美国CST公司。超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)及考马斯亮兰蛋白测定试剂盒均购自南京建成生物研究所。
1.1.2 实验动物及分组:雄性SD大鼠25只,饲养于温州医科大学实验动物中心,动物许可证号:SCXK(浙)2015-0009,体质量(200±20)g。随机分为3组:假手术组(对照组)5只,MCA-IR模型组(模型组)5只,Sal A+MCA-IR组(Sal A组)各15只。Sal A组又随机分为3组,每组5只,于建模前1周分别每日腹腔注射1.0、2.5、5.0 mg/kg Sal A,模型组和对照组于建模前给予等量的0.9%氯化钠溶液腹腔注射。
1.2 方法
1.2.1 MCA-IR模型建立:按照文献[7]方法,采用线栓法制作MCA-IR模型,用10%水合氯醛3 mL/kg腹腔注射麻醉后仰卧位固定,取正中切口,分离左颈总动脉、颈内动脉和颈外动脉,插入涂有肝素的尼龙线栓(直径为0.25 mm),沿颈内动脉入颅至大脑前动脉起始处、阻断大脑中动脉。术后大鼠苏醒时出现右前肢屈曲和前进时(右侧划圈状),证明左侧大脑中动脉阻塞成功。线栓插入深度为(20.0±0.5)mm,扎紧备线,缝合皮肤。缺血2 h后轻提预留线头,使线栓头端退至切口。大脑中动脉继续从Willis环获得血供即为再灌注。对照组仅插入栓子15 mm,其余步骤同上。
1.2.2 大脑标本收集:模型组、Sal A组中大鼠于再灌注24 h用10%水合氯醛3 mL/kg腹腔麻醉,立即置于无菌冰台上断头处死;对照组假处理后,迅速开颅取脑组织,将一半脑组织置于PBS溶液中,再用液氮迅速冷冻保存用于Western blot方法检测p-Akt/Akt表达及生化指标检测;另一半脑组织则置于4%中性甲醛溶液中固定,24 h后石蜡包埋、切片、备用。
1.2.3 TUNEL法检测细胞凋亡:脑片常规脱蜡处理后,滴加20 μg/mL不含DNase的蛋白酶K,37 ℃下作用15 min,PBS洗涤3次;再用0.3%甲醇-过氧化氢溶液室温孵育20 min,以灭活切片内源的过氧化物酶。随后用PBS洗涤3次,按照说明书方法配制TUNEL检测液,在样品上加50 μL TUNEL检测液,37 ℃避光孵育60 min,用PBS洗涤1次,滴加0.1~0.3 mL标记反应终止液,室温孵育10 min,PBS洗涤3次;用50 μL Streptavidin-HRP工作液和0.2~0.5 mL DAB显色液进行样品显色。苏木精复染,脱水、透明和封固,光镜下观察细胞凋亡,并统计TUNEL阳性细胞数量。
1.2.4 免疫组织化学检测脑组织cPLA2:脑片常规脱蜡处理后,置于0.3%甲醇-过氧化氢溶液中灭活内源性过氧化酶,用0.1 mol/L枸橼酸盐缓冲液进行抗原修复。10%山羊血清37 ℃湿盒内孵育30 min。加cPLA2一抗抗体(1∶500),4 ℃过夜。PBS漂洗2次,加入二抗抗体(抗鼠l∶500),湿盒内37 ℃孵育1 h。PBS漂洗2次,加入DAB显色液避光显色15 min,流水冲洗终止反应;苏木精对比染色、脱水、透明、封固、光镜观察,阳性反应为细胞质呈棕黄色,并统计每个样本单个视野下TUNEL阳性细胞数,取3个或3个以上视野,求平均值。
1.2.5 生化指标检测:按照文献[8]方法,将脑组织用0.9%氯化钠溶液制成质量体积比为1∶9匀浆,4 ℃ 3 000 r/min离心10 min,取上清液,按试剂盒说明书测定脑组织中SOD、MDA,计算出MDA和SOD的含量。
1.2.6 Western blot法检测p-Akt/Akt表达:将脑组织均匀匀浆后,随后加入组织裂解液冰上裂解15 min,12 000 r/min离心15 min,吸取上清。采用BAC法进行蛋白定量。取20 μg总蛋白用4%~12%聚丙烯酰胺梯度凝胶电泳分离,电转至PVDF膜上,3%脱脂牛奶室温封闭1 h。加入一抗4 ℃孵育过夜,随后PBST缓冲液洗PVDF膜3次,每次8 min,加入HRP标记的二抗室温孵育1~2 h,再用PBST缓冲液洗PVDF膜3次,每次8 min,ECL试剂发光、显影和定影,以对照组为参照,计算p-Akt/Akt相对表达量。
1.3 统计学处理方法 采用SPSS22.0统计软件进行统计学处理。计量资料以 ±s表示,组间均数比较采用单因素方差分析,两两比较采用SNK法分析。P<0.05为差异有统计学意义。
2 结果
2.1 Sal A抑制大鼠缺血再灌注模型中脑组织细胞凋亡 模型组海马CA l区TUNEL阳性细胞百分比和MDA含量较对照组明显增高(P<0.05),而SOD较对照组明显降低(P<0.05);Sal A组海马CA l区凋亡细胞百分比和MDA含量较模型组明显降低(P<0.05),而SOD含量较模型组明显增高(P<0.05)。见表1。
2.2 Sal A抑制大鼠缺血再灌注脑组织中cPLA2表达 对照组大脑切片可见少许cPLA2表达,模型组与对照组比,脑切片中海马CA 1区cPLA2表达量明显增高(P<0.05);1.0、2.5、 5.0 mg/kg Sal A组大脑切片中海马CA 1区cPLA2表达量均较模型组明显降低(P<0.05),但仍高于对照组。见表2。
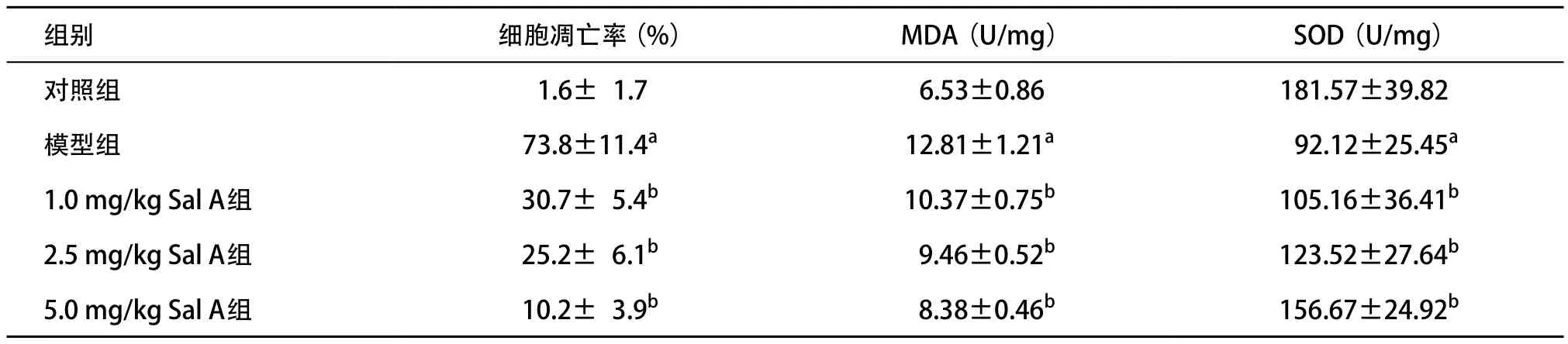
表1 各组脑组织TUNEL阳性细胞数、MDA和SOD含量比较(n=5, ±s)
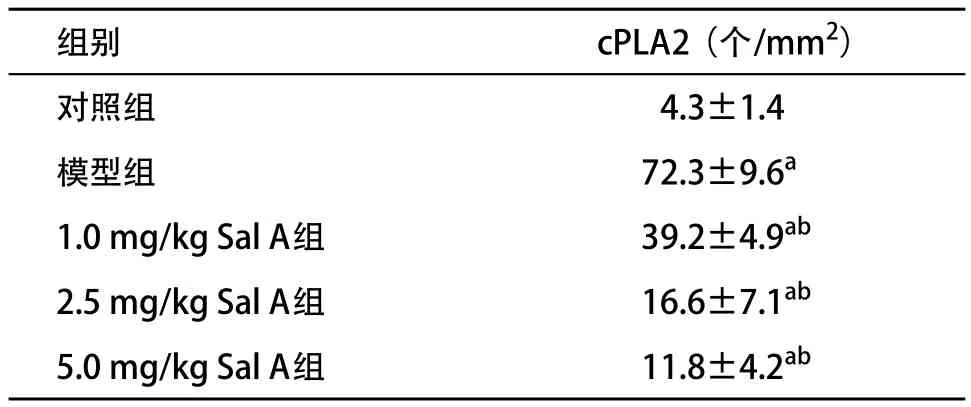
表2 各组海马CA 1区cPLA2表达量的比较(n=5, ±s)
2.3 p-Akt在Sal A治疗缺血再灌注脑组织中的表达 对照组海马CA 1区中p-Akt有表达,模型组海马CA 1区p-Akt相对表达量较对照组明显降低(P<0.05),1.0、2.5、5.0 mg/kg Sal A组海马CA 1区p-Akt相对表达量较模型组明显增高(P<0.05)。见图1。
3 讨论
丹酚酸为唇型科植物丹参的干燥根及根茎的提取物,在临床上应用广泛,可用于治疗心脑血管疾病等缺血缺氧性疾病,其主要活性成分包括丹酚酸和丹参酮两大类[5-6,9]。研究证实总丹酚酸和丹参酮类活性物质可显著降低心肌缺血再灌注损伤过程中的细胞凋亡[9],也有研究证实丹酚酸B抑制了缺血再灌注导致的海马区组织损伤,减少细胞凋亡,而减少海马区神经元丢失[10]。但是Sal A对脑缺血再灌注损伤的保护作用仍鲜有相关报道,因此,本研究重点分析Sal A对脑缺血再灌注损伤细胞凋亡的影响,阐明其可能的分子机制,为临床应用Sal A治疗缺血性再灌注损伤性疾病提供循证医学根据。本研究结果发现,Sal A预处理1周,可显著减少MCA-IR模型SD大鼠海马区细胞凋亡,降低MDA含量,增加SOD含量,对脑组织细胞具有保护作用。
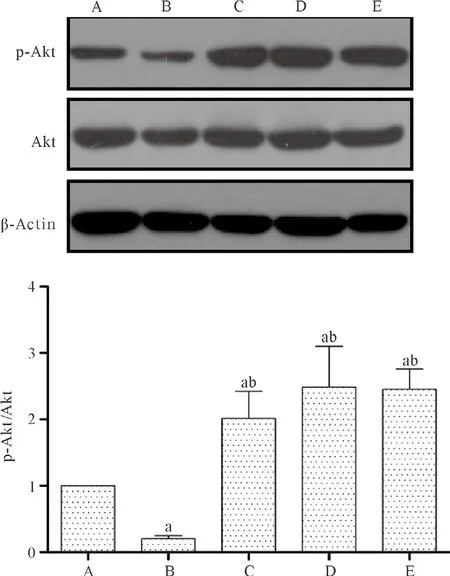
图1 各组p-Akt/Akt的相对表达量比较
cPLA2能将膜甘油水解成花生四烯酸和溶血磷脂酶,具有广泛的生物活性,在缺血再灌注损伤过程中发挥重要作用[3-4]。研究发现缺血再灌注时,cPLA2增加,促使血脑屏障功能紊乱[11]。有研究认为,缺血再灌注损伤过程中,增高的cPLA2参与细胞凋亡,阻断或敲低cPLA2表达,可显著降低细胞的凋亡[12]。本研究亦证实大鼠MCA-IR模型海马区cPLA2表达增加,而Sal A可显著降低cPLA2的表达水平,提示Sal A降低海马区细胞凋亡可能与抑制cPLA2表达有关。
Akt是细胞内重要蛋白激酶,参与调节细胞的增殖、分化、凋亡以及迁移等功能[13-14]。已有研究证实Sal A通过激活Akt信号通路,抑制细胞凋亡[5-6,14]。本研究结果亦证实,MCA-IR模型脑组织Akt活化水平较对照组显著降低,而Sal A预处理后,MCA-IR模型海马区Akt活化水平显著提高,提示Akt作为细胞内重要信号分子,在Sal A保护海马区缺血再灌注损伤中扮演重要角色。
本研究相关结果作为初步研究结果证实了Sal A作为丹酚酸的重要活性成分,抑制缺血再灌注损伤过程中海马区细胞凋亡作用,具有保护作用,其具体分子机制可能与抑制cPLA2表达,激活Akt信号通路有关;但其分子机制仍需进一步证实。我们将通过药物阻断或者基因敲除的方法,进一步分析cPLA2和Akt信号通路在Sal A抑制缺血再灌注损伤过程中细胞凋亡的作用,并明确Akt和cPLA2两者之间的相互关系,最终明确Sal A抑制缺血再灌注损伤脑细胞凋亡的分子机制。
[1] ANZELL A R, MAIZY R, PRZYKLENK K, et al. Mitochondrial quality control and disease: insights into ischemiareperfusion injury[J]. Mol Neurobiol,2017. DOI: 10.1007/s12035-017-0503-9. [Epub ahead of print]
[2] SANDERSON T H, REYNOLDS C A, KUMAR R, et al.Molecular mechanisms of ischemia-reperfusion injury in brain: pivotal role of the mitochondrial membrane potential in reactive oxygen species generation[J]. Mol Neurobiol,2013, 47(1): 9-23.
[3] SUN G Y, CHUANG D Y, ZONG Y, et al. Role of cytosolic phospholipase A2 in oxidative and inflammatory signaling pathways in different cell types in the central nervous system[J]. Mol Neurobiol, 2014, 50(1): 6-14.
[4] LESLIE C C. Cytosolic phospholipase A2: physiological function and role in disease[J]. J Lipid Res, 2015, 56(8):1386-1402.
[5] MAHMOOD Q, WANG G F, WU G, et al. Salvianolic acid A inhibits calpain activation and eNOS uncoupling during focal cerebral ischemia in mice[J]. Phytomedicine, 2017, 25:8-14.
[6] LI X L, FAN J P, LIU J X, et al. Salvianolic acid A protects neonatal cardiomyocytes against hypoxia/reoxygenation-induced injury by preserving mitochondrial function and activating Akt/GSK-3beta signals[J]. Chin J Integr Med,2017. DOI: 10.1007/s11655-016-2747-z.[Epub ahead of print]
[7] 姜义娜, 田福荣, 林倩, 等. b F G F经鼻给药对大鼠缺血再灌注脑损伤的保护作用[J]. 温州医科大学学报, 2 0 1 5, 4 5(8): 5 6 0-5 6 5.
[8] 郭丰, 陆晓微, 徐秋萍. 醒脑静与血塞通联合应用对大鼠脑缺血再灌注损伤的保护作用[J]. 中华医学杂志, 2 0 1 0,9 0(2 3): 1 6 4 5-1 6 4 7.
[9] HO J H, HONG C Y. Salvianolic acids: small compounds with multiple mechanisms for cardiovascular protection[J]. J Biomed Sci, 2011, 18: 30.
[10] WANG Y, CHEN G, YU X, et al. Salvianolic acid B ameliorates cerebral ischemia/reperfusion injury through inhibiting TLR4/MyD88 signaling pathway[J]. Inflammation, 2016, 39(4): 1503-1513.
[11] NITO C, KAMADA H, ENDO H, et al. Role of the p38 mitogen-activated protein kinase/cytosolic phospholipase A2 signaling pathway in blood-brain barrier disruption after focal cerebral ischemia and reperfusion[J]. J Cereb Blood Flow Metab, 2008, 28(10): 1686-1696.
[12] ZHANG J, BARASCH N, LI R C, et al. Inhibition of cytosolic phospholipase A(2) alpha protects against focal ischemic brain damage in mice[J]. Brain Res, 2012, 1471: 129-137.
[13] YAO H, HAN X, HAN X. The cardioprotection of the insulin-mediated PI3K/Akt/mTOR signaling pathway[J]. Am J Cardiovasc Drugs, 2014, 14(6): 433-442.
[14] ZHANG H, LIU Y Y, JIANG Q, et al. Salvianolic acid A protects RPE cells against oxidative stress through activation of Nrf2/HO-1 signaling[J]. Free Radic Biol Med, 2014,69: 219-228.
(本文编辑:赵翠翠)
The protective effect of salvianolic acid A against apoptosis in middle cerebral artery ischemia reperfusion model and its mechanism
PENG Xiao1, FANG Shiji2, ZHENG Liyun1, QIU Weiwen3. 1.Department of Neu-rology, the Fifth Affiliated Hospital of Wenzhou Medical University, Lishui, 323000; 2.Department of Intervention, the Fifth Affiliated Hospital of Wenzhou Medical University, Lishui, 323000; 3.Department of Neurology, the Sixth Affiliated Hospital of Wenzhou Medical University, Lishui, 323000
R285;R743.1
A
10.3969/j.issn.2095-9400.2017.09.010
2017-01-15
浙江省医药卫生科技计划项目(2017KY170);丽水市公益性技术应用项目(2016GYX39、2016GYX25)。
彭潇(1983-),男,浙江丽水人,主治医师。
邱伟文,主任医师,Email:weiwenq@hotmail.com。

