转录因子SOX7对前列腺癌PC-3细胞生物学活性的影响及其机制
郑斌,吴齐全,周克文,王钢,任雨,祁洪刚,朱伟智,翁国斌
(宁波市鄞州第二医院 泌尿外科,浙江 宁波 315100)
转录因子SOX7对前列腺癌PC-3细胞生物学活性的影响及其机制
郑斌,吴齐全,周克文,王钢,任雨,祁洪刚,朱伟智,翁国斌
(宁波市鄞州第二医院 泌尿外科,浙江 宁波 315100)
目的:探讨转录因子SOX7对前列腺癌PC-3细胞增殖、细胞周期、迁移和侵袭能力的影响及其机制。方法:采用脂质体法转染高表达SOX7重组质粒(pCDNA3.1-SOX7),以转染空质粒(Vector)作为对照,检测SOX7对PC-3细胞株增殖、细胞周期、迁移及侵袭的影响,并用Western blot法检测相关蛋白表达水平。结果:pCDNA3.1-SOX7显著抑制PC-3细胞增殖能力,并且诱导细胞周期发生G1期阻滞,同时,使Cylcin D1、E表达量明显下调。此外,pCDNA3.1-SOX7转染后,PC-3细胞迁移距离显著减少,穿透基质胶的细胞数量也显著降低,并且伴随着间质表型标记物MMP-2、MMP-9和N-cadherin蛋白表达减少,上皮标记物E-cadherin蛋白表达增加。结论:SOX7抑制前列腺癌PC-3细胞的增殖、周期、迁移及侵袭能力,其机制可能与调控这些细胞行为的相关蛋白表达有关。
SOX7;前列腺癌;增殖;迁移;侵袭
Abstract: Objective:To investigate the effects and mechanisms of transcription factor SOX7 on PC-3 cells proliferation, cell cycle, cell migration and invasion.Methods:PC-3 cells were transfected with highexpressed SOX7 recombinant plasmid (pCDNA3.1-SOX7) and further detected the changes of cell proliferation,cell cycle, migration, invasion, and related protein expressions.Results:After transfection with pCDNA3.1-SOX7, significant inhibition effects was shown in the PC-3 cell proliferation and G1/S cell cycle arrest, which were accompanied with decreased expressions of cyclin D1 and E. Furthermore, transfection of pCDNA3.1-SOX7 markedly decreased the cell migration distances and invasion capacity, with a reduction of the mesenchymal markers (MMP-2, MMP-9 and N-cadherin), however, the epithelial marker E-cadherin was increased.Conclusion:SOX7 inhibits PC-3 cell proliferation, cell cycle, migration and invasion through regulation of its related protein expressions.
Key words:SOX7; prostate cancer; proliferation; migration; invasion
前列腺癌为西方男性人群最常见的恶性肿瘤之一,近年来在我国的发病率与病死率呈逐年上升趋势[1-2]。临床上一般采取手术切除和放射疗法为主,然而肿瘤复发与转移问题已成为目前治疗的难点。上皮间质转化(epithelial-mesenchymal transition,EMT)过程是肿瘤侵袭和转移的关键环节。在此过程中,上皮细胞表型转化为成纤维细胞的间质表型,上皮细胞间紧密连接相关蛋白表达下调,细胞外基质增多,抗凋亡能力增强,从而促进细胞迁移与侵袭[3]。SOX7作为转录调控因子SOX家族成员,特异性识别并结合靶基因5’-(A/T)(A/T)CAA(A/T)G-3’序列,影响基因转录水平,在调控胚胎发育过程中起重要作用[4]。近年研究表明,SOX7在肿瘤的发生发展过程中扮演重要角色[5-6]。SOX7在不同组织或细胞中具有表达差异性,在食管癌、胃癌以及胰腺癌中呈高表达状态,而在乳腺癌、前列腺癌、肺癌、肾癌和结直肠癌中呈现低表达[7-11],在HeLa、HL60、S3、Raji、SW480、K562、MOLT-4、A549细胞株中呈不表达或低表达状态[7]。本课题组前期研究发现,相对于正常前列腺组织,SOX7在前列腺癌组织中呈低表达状态,并且与Gleason评分密切相关[12]。预实验结果表明,前列腺癌细胞株PC-3、DU145的SOX7表达量显著低于前列腺正常细胞株RWPE-1。为进一步研究SOX7对前列腺癌细胞生物学活性的影响及其机制,本研究用携带人过表达SOX7基因的重组载体(pCDNA3.1-SOX7)转染前列腺癌PC-3细胞,观察SOX7基因对PC-3细胞体外增殖、周期、侵袭及迁移能力的影响。
1 材料和方法
1.1 材料 人前列腺癌PC-3细胞株购自中国科学院上海细胞研究所。RMPI 1640无血清培养基、胎牛血清均购自美国Gbico公司;细胞周期蛋白E(Cyclin E)、细胞周期蛋白依赖性激酶2(cyclin dependent kinase 2,CDK2)、CDK4、CDK6、E-钙黏附蛋白(E-cadherin)、N-钙黏附蛋白(N-cadherin)鼠抗人单克隆抗体以及细胞周期蛋白D1(Cyclin D1)、GAPDH兔抗人单克隆抗体购自美国Cell Signaling Technology公司;基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)、MMP-9、SOX7、波形蛋白(vimentin)、纤维连接蛋白(fibronectin)兔抗人单克隆抗体购自英国Abcam公司;羊抗小鼠IgG二抗与羊抗兔IgG二抗购自武汉博士德生物科技有限公司。
1.2 细胞培养及分组 PC-3细胞接种于含10%胎牛血清的培养基中,37 ℃、5% CO2培养箱中饱和湿度培养。预实验结果发现,相对于Control未处理组,空质粒pCDNA3.1组(Vector组)对PC-3细胞SOX7蛋白表达量及细胞生物学活性均无显著性影响,因此,本研究仅比较pCDNA3.1-SOX7重组质粒组(pCDNA3.1-SOX7组)和空质粒pCDNA3.1组(Vector组)相关指标。
1.3 pCDNA3.1-SOX7质粒转染 根据GeneBank中SOX7基因的CDS碱基序列(NM_031439),委托上海吉玛生物科技有限公司合成pCDNA3.1-SOX7重组质粒。待PC-3细胞生长至50%~60%融合度时,按1∶3比例将质粒和脂质体混合液加入无血清培养基中进行转染,待6 h后更换为含10%胎牛血清的普通培养基。转染24 h后用于其他实验。
1.4 MTT增殖实验 60 mm培养皿中细胞汇合到80%~90%后,胰酶消化,完全培养基重悬细胞,计数并调整浓度至2×104个/mL,将稀释好的细胞悬液加到5块96孔板中,每孔100 μL,做5个复孔。在37 ℃、5% CO2培养箱中分别培养24、48、72、96 h后,每孔加入10 μL MTT溶液(5 mg/mL),在培养箱中继续培养4 h后,吸弃上清,加入150 μL DMSO溶液,于490 nm测各孔吸光度值并记录结果。
1.5 细胞周期检测 将PC-3细胞以1×105个/mL浓度接种于培养皿中,待细胞融合度达60%左右,脂质体法转染pCDNA3.1-SOX7质粒,24 h后用胰蛋白酶消化分装,离心,70%的冰乙醇沉淀后-20 ℃保存24 h,置于流式管中,避光加入400 μL PI/RNase染色液并混匀,30 min后置于流式细胞仪中检测细胞周期。
1.6 细胞划痕实验 将PC-3细胞以2.5×105个/mL浓度接种于6孔板中,待细胞长至融合度大于90%后,用200 μL枪头小心垂直于6孔板划一直线,37 ℃PBS清洗2次,24 h后倒置显微镜观察拍照,并计算迁移距离。
1.7 Transwell实验 PC-3细胞转染24 h后,消化,无血清培养基调整浓度至4×104个/mL,取200 μL加入铺有基质胶的Transwell小室上层,下室内加入600 μL含10%胎牛血清的培养基,待培养24 h后,取出上层小室,用消毒棉签擦除小室背面的基质胶及未穿膜细胞,置于甲醇固定10 min,0.1%结晶紫染色,PBS清洗2次。倒置显微镜下拍照,并计算穿膜数量。
1.8 Western blot实验 待细胞转染质粒后再培养24 h,37 ℃ PBS清洗2次,RIPA裂解,离心取上清,BCA法测蛋白浓度。电泳后湿转印至PVDF膜中,5%脱脂奶粉封闭60 min,4 ℃冰箱中孵育一抗过夜,TBST洗涤5次,二抗孵育60 min,显影曝光。
1.9 统计学处理方法 应用SPSS18.0软件将数据进行统计学分析。计量资料用 ±s表示,2组样本均数比较采用t检验。P <0.05为差异有统计学意义。
2 结果
2.1 SOX7抑制前列腺癌PC-3细胞的增殖作用 转染pCDNA3.1-SOX7高表达质粒于PC-3细胞,经Western blot验证pCDNA3.1-SOX7重组质粒转染后其SOX7蛋白表达水平显著上调(见图1)。MTT实验显示,转染48 h后pCDNA3.1-SOX7组显著抑制了PC-3细胞的增殖能力(见图2);流式细胞术检查发现,pCDNA3.1-SOX7组诱导PC-3细胞发生G1期阻滞(见图3);Cyclin D1、E表达量下调,CDK2、4、6表达量无显著性改变(见表1)。
2.2 SOX7抑制前列腺癌细胞的迁移与侵袭作用划痕实验检测结果发现,转染pCDNA3.1-SOX7重组质粒24 h后,pCDNA3.1-SOX7组PC-3细胞的迁移距离显著性低于Vector组(见图4、表2);Transwell试验结果发现,pCDNA3.1-SOX7组穿透基质胶的细胞数量也显著性低于Vector组(见图5、表2);间质表型标记物MMP-2、MMP-9和N-cadherin蛋白表达减少,上皮标记物E-cadherin蛋白表达增加(见表1)。
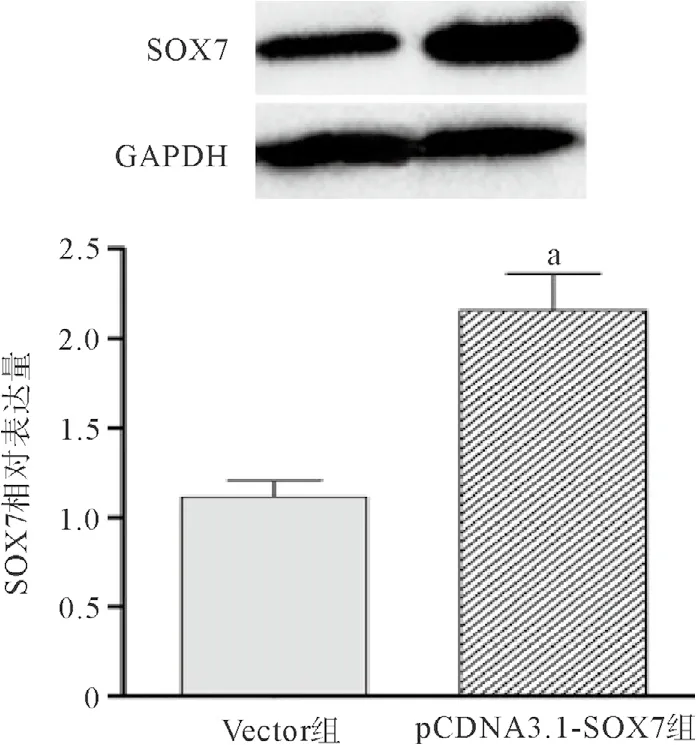
图1 pCDNA3.1-SOX7重组质粒转染后SOX7蛋白表达水平变化
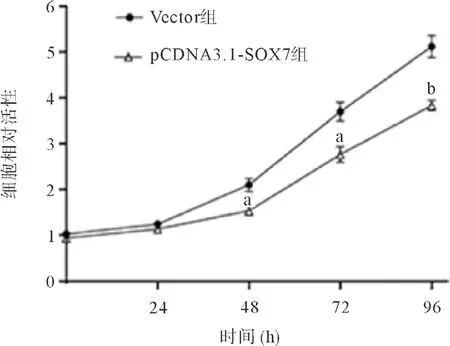
图2 pCDNA3.1-SOX7重组质粒转染后PC-3细胞增殖能力变化
3 讨论
近年来,关于高迁移率族蛋白结构域SOX家族基因与肿瘤发生发展的关系已成为研究热点。
已有研究发现,SOX7是wnt/β-catenin通路的负性调控因子,发挥着抑癌基因的作用。ZHAO等[13]发现,转染SOX7质粒后,细胞增殖受抑制,wnt/β-catenin转录水平降低,同时Cyclin D1和c-Myc蛋白表达下调,但转染缺失HMG-box结构域SOX7突变质粒后,并不能引起上述现象,因此认为,SOX7通过其本身的HMG-box结构域结合β-catenin并抑制其活性,从而下调β-catenin介导的增殖活性,扮演着抑癌基因的作用。此外,在人子宫内膜癌、卵巢癌、肝癌和乳腺癌的研究[8,14-17]中均有类似的报道。
细胞周期变化与细胞周期蛋白改变有关。其中Cyclin D/CDK4和Cyclin E/CDK2复合物促进细胞周期G1/S期的转换,Cyclin A/CDK2复合物调控G1/S和G2/M期的转换,而Cyclin B/CDK2复合物调控G2晚期进入有丝分裂期。据报道[18],SOX7通过调控wnt/β-catenin通路活性,从而控制Cyclin D1和c-myc的表达,调控细胞增殖过程。本研究通过流式细胞术检测细胞周期,结果发现,SOX7抑制前列腺癌细胞的增殖能力,并且诱导细胞发生G1期阻滞,伴随着Cyclin D1、E的显著性下调,而CDK2与CDK4未见明显改变,由此可见,SOX7抑制的CylcinD1/CDK4、Cyclin E/CDK2复合物水平下调与细胞周期结果一致。因此,我们认为SOX7通过抑制Cyclin D1、E表达量,从而诱导细胞周期发生G1期阻滞,抑制细胞增殖。
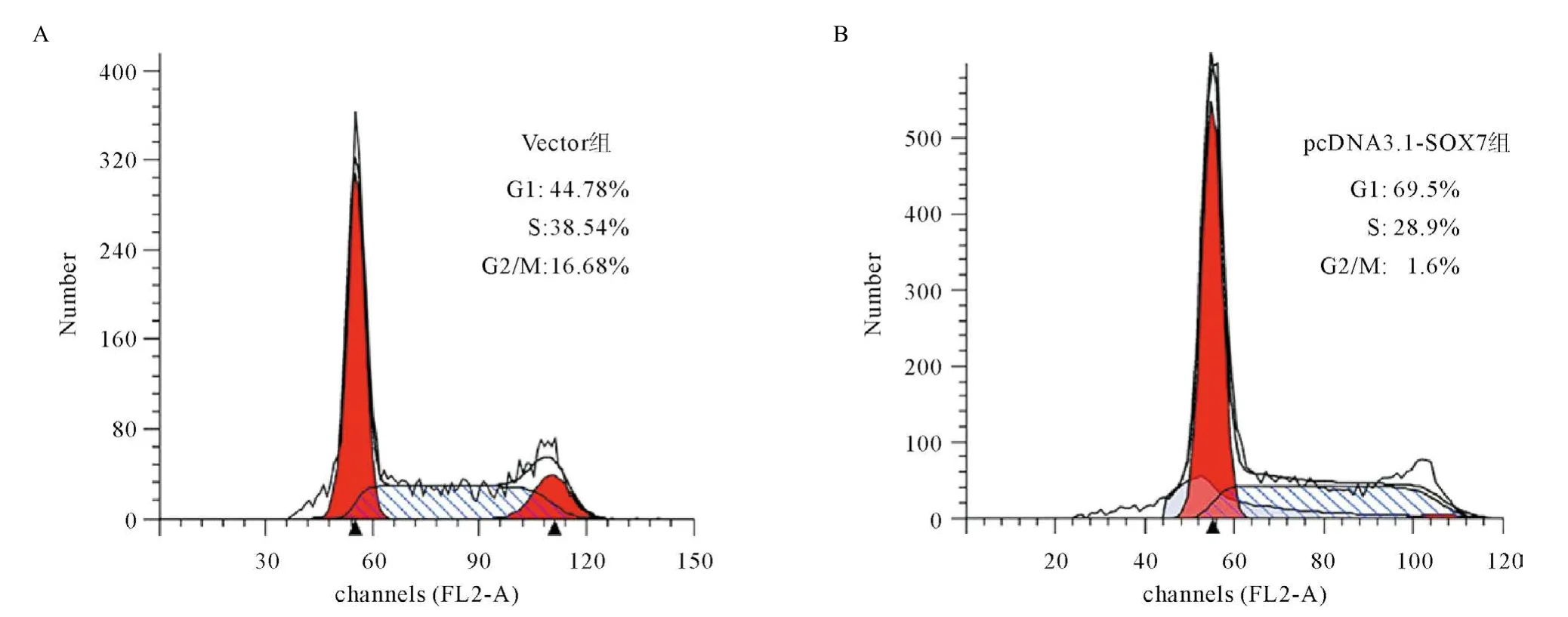
图3 pCDNA3.1-SOX7重组质粒转染后PC-3细胞周期变化
SOX7抑制前列腺癌的转移过程可能与抑制肿瘤血管生成及EMT发生有关。有研究报道,在斑马鱼发育过程中,敲除SOX7与SOX18表达导致血管功能缺失[19]。新近研究发现,SOX7联合SOX17反馈调节于血管内皮生长因子信号,从而调控血管功能[20]。另外,EMT与恶性肿瘤的转移与侵袭密切相关[21]。CUI等[22]在胃癌的研究中也发现,SOX7水平与细胞浸润程度、淋巴结转移、TNM分期均具有相关性,认为SOX7在胃癌转移与浸润过程中扮演重要角色。ZHONG等[23]在研究SOX7与前列腺癌患者生存率的相关性时发现,SOX7在血清前列腺特异性抗原水平小于4 ng/mL的前列腺癌患者中有较高的表达量,并且在发生转移的患者中SOX7表达量显著性低于未发生转移的患者,因此认为,SOX7蛋白表达与肿瘤转移呈负相关。本课题组前期研究也发现了类似的现象。SOX7在前列腺癌组织中呈现低表达状态,而Gleason<7的前列腺癌组织表达量大于Gleason≥7,说明SOX7表达量与前列腺癌浸润程度有关[12]。此外,我们发现高表达SOX7重组质粒转染后显著性抑制了细胞迁移与侵袭过程,伴随着间质表型标记物MMP-2、MMP-9和N-cadherin蛋白的减少和上皮标记物E-cadherin蛋白增加,这也说明SOX7转染后对于前列腺癌EMT过程具有抑制作用。
综上所述,SOX7抑制前列腺癌PC-3细胞的增殖、周期、迁移及侵袭能力,其机制可能与调控这些细胞行为的相关蛋白表达有关。
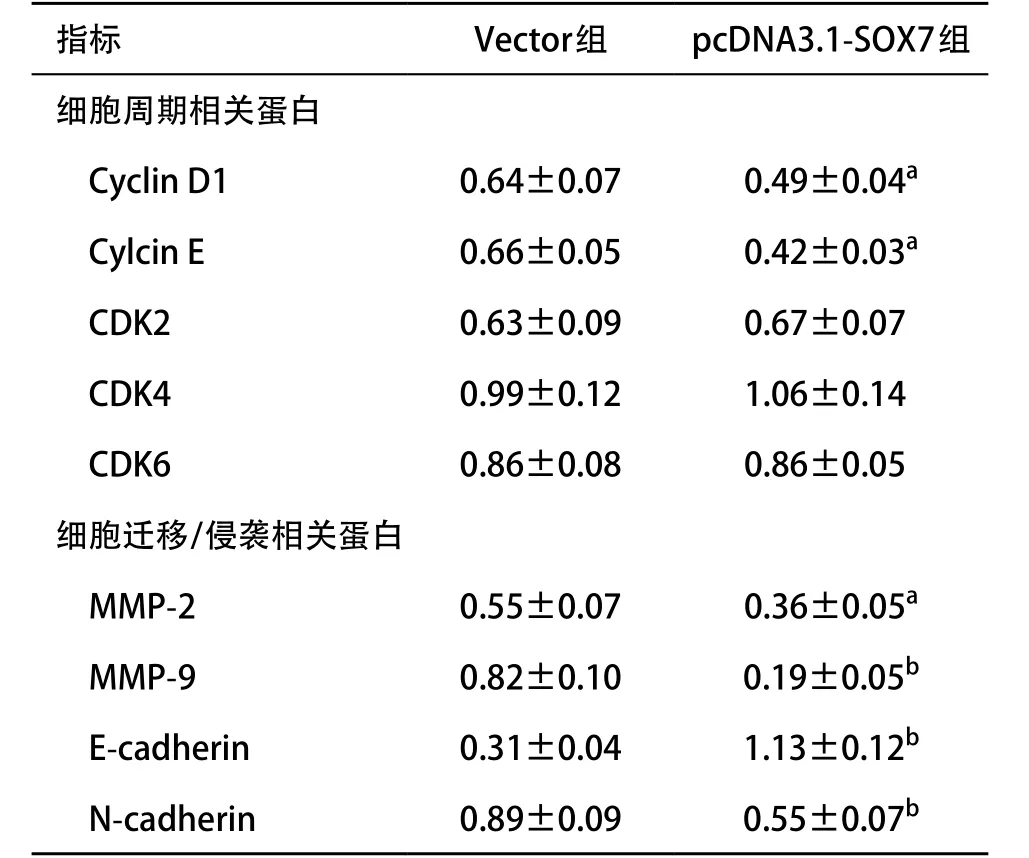
表1 pCDNA3.1-SOX7重组质粒转染后PC-3细胞周期相关蛋白和迁移/侵袭相关蛋白表达变化(n=3, ±s)
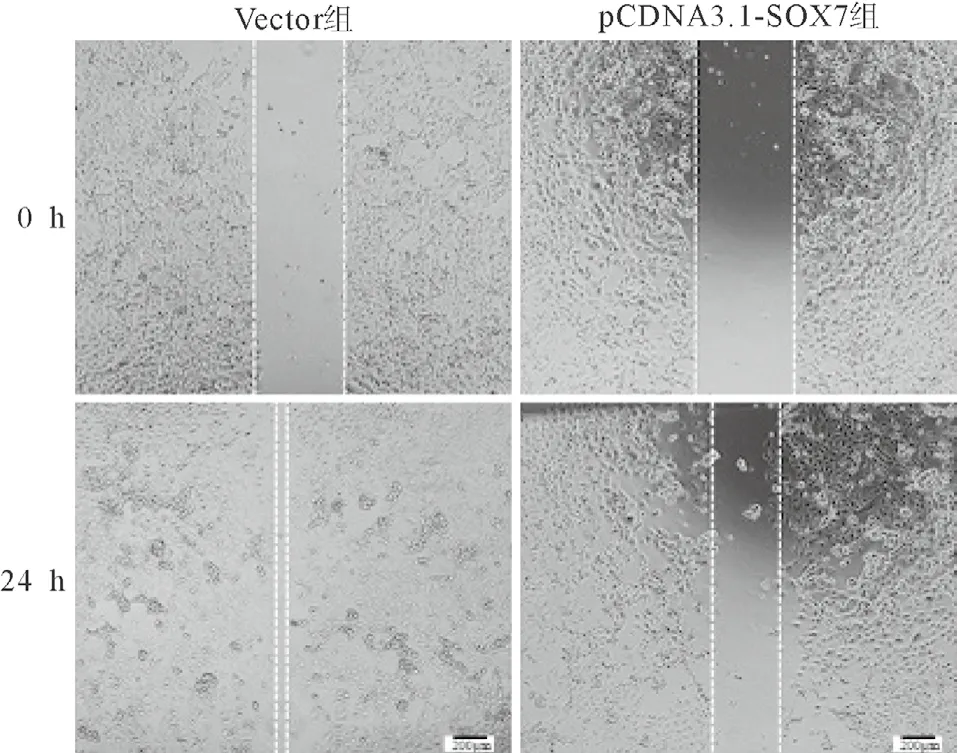
图4 pCDNA3.1-SOX7重组质粒转染后PC-3细胞迁移能力变化(×40)
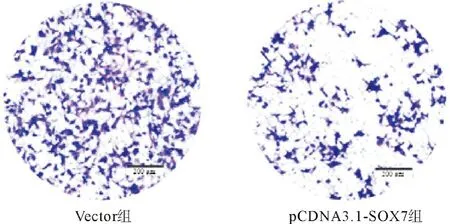
图5 pCDNA3.1-SOX7重组质粒转染后PC-3细胞侵袭能力变化(×100)
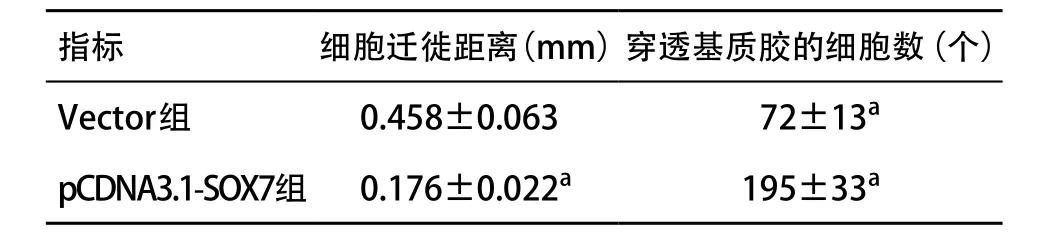
表2 pCDNA3.1-SOX7重组质粒转染后PC-3细胞迁移及侵袭能力的变化(n=3, ±s)
[1] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[2] TORRE L A, SAUER A M, CHEN M S JR, et al. Cancer statistics for Asian Americans, Native Hawaiians, and Pacific Islanders, 2016: Converging incidence in males and females[J]. CA Cancer J Clin, 2016, 66(3): 182-202.
[3] KALLURI R. EMT: when epithelial cells decide to become mesenchymal-like cells[J]. J Clin Invest, 2009, 119(6):1417-1419.
[4] LIOUBINSKI O, MULLER M, WEGNER M, et al. Expression of Sox transcription factors in the developing mouse pancreas[J]. Dev Dyn, 2003, 227(3): 402-408.
[5] STOVALL D B, CAO P, SUI G. SOX7: from a develop-mental regulator to an emerging tumor suppressor[J]. Histol Histopathol, 2014, 29(4): 439-445.
[6] WAT J J, WAT M J. Sox7 in vascular development: review,insights and potential mechanisms[J]. Int J Dev Biol, 2014,58(1): 1-8.
[7] KATOH M. Expression of human SOX7 in normal tissues and tumors[J]. Int J Mol Med, 2002, 9(4): 363-368.
[8] STOVALL D B, WAN M, MILLER L D, et al. The regulation of SOX7 and its tumor suppressive role in breast cancer[J]. Am J Pathol, 2013, 183(5): 1645-1653.
[9] LI B, GE Z, SONG S, et al. Decreased expression of SOX7 is correlated with poor prognosis in lung adenocarcinoma patients[J]. Pathol Oncol Res, 2012, 18(4): 1039-1045.
[10] GUO L, ZHONG D, LAU S, et al. Sox7 is an independent checkpoint for beta-catenin function in prostate and colon epithelial cells[J]. Mol Cancer Res, 2008, 6(9): 1421-1430.
[11] MA Y, SHE X G, MING Y Z, et al. MiR-24 promotes the proliferation and invasion of HCC cells by targeting SOX7[J]. Tumour Biol, 2014, 35(11): 10731-10736.
[12] 陈特磊, 王钢, 朱伟智. S O X 7基因在前列腺癌组织中的表达及其与临床特征的关系[J]. 现代实用医学, 2 0 1 3, 2 5(1 1):1 2 4 7-1 2 4 8.
[13] ZHAO T, YANG H, TIAN Y, et al. SOX7 is associated with the suppression of human glioma by HMG-box dependent regulation of Wnt/beta-catenin signaling[J]. Cancer Lett,2016, 375(1): 100-107.
[14] LIU H, YAN Z Q, LI B, et al. Reduced expression of SOX7 in ovarian cancer: a novel tumor suppressor through the Wnt/beta-catenin signaling pathway[J]. J Ovarian Res, 2014, 7(87): 1-9.
[15] WU G G, LI W H, HE W G, et al. Mir-184 post-transcriptionally regulates SOX7 expression and promotes cell proliferation in human hepatocellular carcinoma[J]. PLoS One,2014, 9(2): e88796.
[16] WANG C, GUO Y, WANG J, et al. The suppressive role of SOX7 in hepatocarcinogenesis[J]. PLoS One, 2014, 9(5):e97433.
[17] CHAN D W, MAK C S, LEUNG T H, et al. Down-regulation of Sox7 is associated with aberrant activation of Wnt/b-catenin signaling in endometrial cancer[J]. Oncotarget,2012, 3(12): 1546-1556.
[18] 孙余省, 朱冠保, 金劲激, 等. 查尔酮类似物A 5 9促人结肠癌细胞凋亡及其机制[J]. 温州医科大学学报, 2 0 1 5, 4 5(6):4 2 1-4 2 9.
[19] CERMENATI S, MOLERI S, CIMBRO S, et al. Sox18 and Sox7 play redundant roles in vascular development[J]. Blood,2008, 111(5): 2657-2666.
[20] KIM K, KIM I K, YANG J M, et al. SoxF transcription factors are positive feedback regulators of VEGF signaling[J]. Circ Res, 2016, 119(7): 839-852.
[21] OSANTO S, VAN POPPEL H. Emerging novel therapies for advanced prostate cancer[J]. Ther Adv Urol, 2012, 4(1):3-12.
[22] CUI J, XI H, CAI A, et al. Decreased expression of Sox7 correlates with the upregulation of the Wnt/beta-catenin signaling pathway and the poor survival of gastric cancer patients[J]. Int J Mol Med, 2014, 34(1): 197-204.
[23] ZHONG W D, QIN G Q, DAI Q S, et al. SOXs in human prostate cancer: implication as progression and prognosis factors[J]. BMC Cancer, 2012, 12(248): 1-11.
(本文编辑:丁敏娇)
Mechanisms and effects of transcription factor SOX7 on the biological activity of the prostate cancer PC- 3 cells
ZHENG Bin, WU Qiquan, ZHOU Kewen, WANG Gang, REN Yu, QI Honggang, ZHU Weizhi, WENGGuobin. Department of Urologic Surgery, Ningbo Yinzhou No.2 Hospital, Ningbo, 315100
R73-37;R737.25
A
10.3969/j.issn.2095-9400.2017.09.011
2016-12-27
鄞州区科技计划项目;宁波市科技惠民项目(2017C50 058)。
郑斌(1982-),男,浙江宁波人,主治医师,硕士。
翁国斌,主任医师,教授,Email:ddwgb@aliyun.com。

