DMOG稳定缺血/再灌注心肌组织低氧诱导因子-1α表达时间规律的研究
王丽月 刘艳 薛晋红 王文香 贺忠梅
基础研究
DMOG稳定缺血/再灌注心肌组织低氧诱导因子-1α表达时间规律的研究
王丽月 刘艳 薛晋红 王文香 贺忠梅
目的 观察二甲氧乙二酰甘氨酸(DMOG)预处理对大鼠缺血再灌注(I/R)心肌组织中低氧诱导因子-1α(HIF-1α)表达的影响,探讨DMOG稳定HIF-1α表达的时间规律。方法 雄性Wistar大鼠随机分为假手术组(Sham组)、心肌缺血再灌注组(MI/R组)、DMOG+MI/R组、YC-1+MI/R组(YC-1为HIF-1α抑制剂)。建立心肌缺血/再灌注模型,心肌缺血45 min,再灌注0 h、3 h、6 h、9 h四个时间点。留取心脏左室前壁标本,分别采用Western blot和Real-time PCR法检测心肌组织中HIF-1α蛋白与mRNA表达水平。结果
①再灌注相同时间点,D+MI/R组的HIF-1α蛋白表达量均明显高于MI/R组;在观察时间内,D+MI/R组的HIF-1α蛋白表达量呈现出先增高、后降低的趋势,并且在再灌注3 h时达峰值(P<0.05)。②HIF-1α的mRNA表达量在不同组间及再灌注各个时间点均无明显差异(P>0.05)。结论 DMOG预处理能够稳定心肌I/R时HIF-1α的蛋白表达量,峰值出现于再灌注3 h,而对HIF-1α的mRNA表达量无明显影响,表明这种作用主要发生于蛋白合成过程,而非基因转录水平。
低氧诱导因子-1α; 二甲氧乙二酰甘氨酸; 心肌缺血/再灌注损伤
缺血性心脏病(ischaemic heart disease,IHD)即心肌供血发生障碍而引起的心脏病,其发病率和死亡率居全球首位[1]。临床上主要采取溶栓、冠脉搭桥、经皮冠状动脉介入等再灌注疗法恢复缺血心肌的血运重建[2],然而由此带来的再灌注损伤是造成心肌梗死、心肌细胞丢失的重要原因,并且可使20%的患者发生心力衰竭[3]。近年来研究发现,缺血预处理和后处理等机械性调控措施对心肌缺血/再灌注损伤(myocardial ischemia-reperfusion injury,MI/RI)具有保护作用,并且是通过上调低氧诱导因子-1(hypoxia inducible factor-1,HIF-1)表达来实现的[4]。
HIF-1广泛存在于哺乳动物组织细胞中,是对氧敏感的一种核转录因子,能促进机体对缺氧刺激作出适应性反应,且HIF-1的生理活性主要取决于受氧浓度调节的α亚基[5]。HIF-1α可通过调控下游靶基因的转录激活来促进细胞的存活[6]。然而,在常氧环境中,胞浆中HIF-1α易被脯氨酸羟化酶(Proline Hydroxylase,PHD)羟化修饰,经泛素化途径降解失活,使HIF-1α在再灌注时期难以发挥心肌保护作用。因此,研究者多采用PHD抑制剂二甲基乙二酰基甘氨酸(Dimethyloxalyglycine,DMOG)稳定HIF-1α表达,使HIF-1α对心肌的保护效应得以持续[7]。但是目前对心肌缺血/再灌注模型中HIF-1α的表达变化特点及DMOG稳定HIF-1α表达的时间规律尚不清楚,因此,本研究拟对这一问题进行探讨,以确定HIF-1α表达的最佳时间点,为实验中取材时间点的选择及后续HIF-1α的功能研究提供基础实验依据。
1 材料与方法
1.1 实验材料 选取8周龄,健康雄性Wistar大鼠78只,体重220~260 g(山西医科大学动物实验中心提供)。DMOG购自Sigma-Aldrich公司;YC-1购自 Cayman Chemical公司;HIF-1α一抗购于Santa Cruz公司;SDS-PAGE凝胶配制试剂盒购于上海碧云天技术有限公司;Real-Time PCR试剂盒购于Thermo Fisher Scientific公司;HX-200动物呼吸机(成都泰盟科技有限公司);Mx3005P型荧光定量PCR仪(吉泰生物科技有限公司);电泳仪、半干转膜仪、PTC-100型PCR仪(BIO-RAD)。
1.2 实验分组和再灌注方案 将78只健康雄性Wistar大鼠随机分为4组:①假手术组(Sham,n= 6);②心肌I/R组(MI/R,n=24);③DMOG+心肌I/ R组(D+MI/R,n=24),术前24 h腹腔注射DMOG(40 mg/kg);④YC-1+心肌I/R组(YC-1+MI/R,n= 24,YC-1为HIF-1α抑制剂),缺血前30 min尾静脉注射YC-1(2 mg/kg)。再灌注方案:Sham组除外,其余三组均心肌缺血45 min再灌注0 h、3 h、6 h和9 h。
1.3 实验方法
1.3.1 制备大鼠心肌缺血/再灌注模型 采用我们曾报道的方法建立模型[8],心电图示ST段明显抬高,左心室前壁由红色明显变暗,说明缺血成功。45 min后松开止血钳冠脉血流恢复后,心电图示ST段回落明显,提示心肌再灌注成功。达到再灌注时间后处死动物,留取心脏左室前壁组织标本。
1.3.2 Western blot法检测心肌组织HIF-1α蛋白表达量 组织匀浆提取心肌组织总蛋白,BCA法蛋白定量后,上样待测样品50μg进行电泳,120min后半干转膜(15 V,15min),封闭2 h,孵育一抗(1∶1000),4℃过夜,洗涤后孵育二抗(1∶500)1 h,洗涤后采用化学发光法显影拍摄,曝光条带。采用Image J软件分析,以HIF-1α的灰度值与β-actin的灰度值的比值表示HIF-1α蛋白的相对含量。
1.3.3 Real-time PCR法检测心肌组织中HIF-1α的mRNA表达量 ①提取心肌组织总RNA:用Trizol总RNA提取试剂盒提取并纯化置于-20℃备用。②cDNA的合成:采用Oligo(dT)18 primer反转录反应液,65℃孵育5min,冰上冻存。采用10Mm dNTPMix,根据说明书在20μl RT反应体系中进行转录,仪器参数设置为42℃、60min,70℃、5 min。③心肌组织中HIF-1αmRNA表达量的检测:应用Maxima SYBR Green/ROX Qpcr Master Mix(2×)12.5μl,上、下游引物各0.3μM,Template DNA≤500 ng,Water nuclease-free配制成25μl PCR反应液,50℃2 min,95℃10min,1个循环;95℃15 s,60℃60 s,40个循环。置于荧光定量PCR仪中进行扩增及定量分析。引物序列 HIF-lα(NM_024359):Forward:5′-ACT GAT TGC ATC TCC ACC TTC T-3′;Reverse:5′-TCG CTT CCT CTG AGC ATT CT-3′。引物序列 β-actin(NM_031144):Forward:5′-GGC TAC AGC TTC ACC ACC AC-3′;Reverse:5′-TCA GGA GGA GCA ATG ATC TTG-3′。
2 结果
2.1 心肌I/R后HIF-1α蛋白表达变化趋势
HIF-1α的蛋白表达量在MI/R组0 h时明显高于Sham组(1.55±0.17比1.0±0.11,P<0.01),之后的再灌注各时间点则呈逐渐降低趋势;再灌注0 h的HIF-1α蛋白表达量最高,分别为3 h、6 h、9 h的1.3倍、13.2倍、10.4倍(P<0.01)。见图1。

图1 M I/R组再灌注各时间点HIF-1α蛋白表达量
2.2 DMOG预处理对大鼠心肌I/R后HIF-1α蛋白表达量的影响 与MI/R组相比,D+MI/R组在再灌注各个时间点的HIF-1α蛋白表达量均明显增加,0 h增加1.35倍(P<0.05),3 h、6 h、9 h时分别为3.9倍、7.7倍、5.0倍(P<0.01),提示DMOG预处理能够稳定再灌注时HIF-1α的蛋白表达。D+ MI/R组各时间点的HIF-1α蛋白表达量在再灌3 h时为峰值,分别为0 h、6 h、9 h的1.5倍、1.2倍、1.4倍(P<0.05)。见图2。
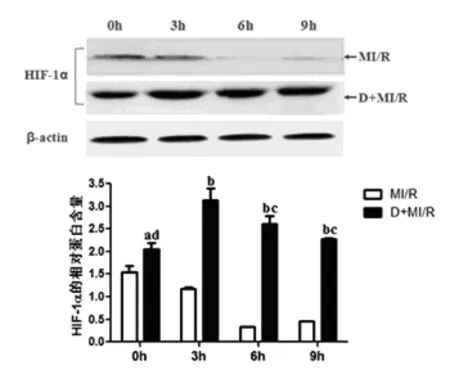
图2 D+M I/R组不同时间点HIF-1α的表达量均增高,且3 h达峰值
2.3 各种处理因素对HIF-1α蛋白表达量的影响
与Sham组同一时间点的HIF-1α蛋白表达量相比,MI/R组表现为先高后低的趋势,而采用DMOG预处理则使HIF-1α的蛋白表达量明显增加,HIF-1α抑制剂YC-1则明显阻止了缺血/再灌注所致的HIF-1α表达。见图3。
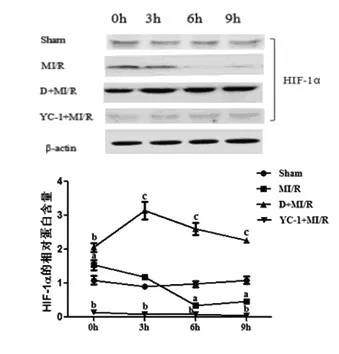
图3 各种处理因素对HIF-1α蛋白表达水平的影响
2.4 各组不同时间点HIF-1αmRNA的表达水平比较 与Sham组相同时间点的HIF-1αmRNA表达量相比,MI/R组、D+MI/R组及YC-1+MI/R组均无显著差异(P>0.05),且各组内任意两个时间点间也无明显差异(P>0.05)。见表1。
表1 各组不同时间点HIF-1αm RNA的表达水平(±s)

表1 各组不同时间点HIF-1αm RNA的表达水平(±s)
组别 例数 HIF-1αmRNA 0 h 3 h 6 h 9 h Sham 6 1.05±0.04 1.02±0.03 1.00±0.08 1.03±0.04 MI/R 6 1.05±0.07 0.99±0.06 1.03±0.09 0.99±0.07 D+MI/R 6 1.00±0.07 1.02±0.07 1.00±0.04 1.02±0.09 YC-1+MI/R 6 1.09±0.07 0.98±0.06 1.03±0.01 1.04±0.03
3 讨论
本研究观察了DMOG预处理对I/R心肌组织中HIF-1α表达量的影响及时间规律,结果发现,在再灌注0~9 h时间内,DMOG可稳定HIF-1α的蛋白表达,表现为先增高后降低的趋势,并且在再灌注3 h时为峰值;而HIF-1α的mRNA表达量在同样时间内无明显变化,说明DMOG稳定HIF-1α的表达主要发生于蛋白合成过程,而非基因转录水平。本实验结果与Bruick等[9]的报道一致。DMOG为PHD的非特异性抑制剂,作用于已合成的HIF-1α,避免其受PHD羟化降解,但并不促进HIF-1α的合成。
HIF-1α作为对氧敏感的转录因子,在常氧环境中可被泛素化后快速降解,而缺氧条件下降解减少并大量积聚并转运至胞核,诱导下游与葡萄糖代谢、细胞增殖、新生血管生成等新陈代谢功能密切相关的基因,如VEGF、GLU1等的转录激活来介导组织细胞在缺血缺氧时的能量和代谢改变,从而促进机体对缺氧环境的适应[10]。鉴于这种生理特性,HIF-1α在缺血再灌注心肌组织中呈低表达状态,再灌注时难以发挥心肌保护作用。Ockaili等[7]首次采用DMOG稳定HIF-1α的蛋白表达,并观察到心肌梗死面积明显减小,从而为HIF-1α的研究开辟了一条新途径。
已有研究表明,使用DMOG可以抑制心肌细胞凋亡,改善心肌纤维化,该心肌保护作用依赖于HIF-1α对下游因子NF-κB的激活[11]。同时有报道DMOG预处理可稳定心肌组织中HIF-1α的蛋白表达,通过对HIF-1α下游基因如HO-1的激活,进而抑制炎症反应,改善左室功能,减轻MI/R损伤[12]。既往研究多采用DMOG稳定HIF-1α的表达来探究HIF-1α对心肌的保护机制,但在不同研究中,DMOG在实验对象体内的半衰期和作用时效有所不同,尚无统一定论,因此给实验中取材时间点的选择带来困扰。本研究发现,DMOG稳定HIF-1α蛋白表达的最佳时间点为再灌注3 h,可为HIF-1α功能研究中取材时间点的选择提供实验依据。
心肌缺血再灌注损伤所致的心肌细胞死亡和心功能障碍,是诱发心律失常、心衰和患者死亡的主要原因。近年的研究表明,缺血预处理能够减少心肌细胞凋亡和心梗面积,改善MI/R损伤,该心肌保护作用有赖于HIF-1α的激活[13],在细胞水平上的研究也表明HIF-1α为介导缺血预适应心肌保护效应的关键因子[14]。而外源性给予DMOG稳定HIF-1α的表达可明显减轻心肌I/R损伤[15],从而提示DMOG可能作为缺血性心脏病经临床治疗后的辅助药物来减轻再灌注损伤。尤为重要的是HIF-1α为机体内源性物质,药物干预容易对其浓度进行调控,有利于探究HIF-1α对机体的保护作用,因此本研究可为以HIF-1α为靶点的心脏保护药物的研发提供基础的实验数据。
[1]Zhang XY,Shu L,Si CJ,et al.Dietary Patterns,Alcohol Consumption and Risk of Coronary Heart Disease in Adults:A Meta-Analysis.Nutrients,2015,7:6582-6605.
[2]Karabulut A,Cakmak M.Treatment strategies in the left main coronary artery disease associated with acute coronary syndromes. JSaudi Heart Assoc,2015,27:272-276.
[3]Go AS,Mozaffarian D,Roger VL,et al.American Heart Association Statistics C,Stroke Statistics S.Heart disease and stroke statistics——2013 update:a report from the American Heart Association.Circulation,2013,127:e6-245.
[4]Eckle T,Kohler D,Lehmann R,et al.Hypoxia-inducible factor-1 is central to cardioprotection:a new paradigm for ischemic preconditioning.Circulation,2008,118:166-175.
[5]Semenza GL.HIF-1 and mechanisms of hypoxia sensing.Curr Opin Cell Biol,2001,13:167-171.
[6]Semenza GL.Hypoxia-inducible factor 1:regulator ofmitochondrial metabolism and mediator of ischemic preconditioning. Biochim Biophys Acta,2011,1813:1263-1268.
[7]Ockaili R,Natarajan R,Salloum F,et al.HIF-1 activation attenuates postischemic myocardial injury:role for heme oxygenase-1 in modulating microvascular chemokine generation.Am JPhysiol Heart Circ Physiol,2005,289:H542-H548.
[8]刘艳,李玲萍,张红霞,等.HIF-1α稳定表达抑制缺血再灌注大鼠心肌细胞凋亡的作用研究.中国心血管病研究,2016,14:277-280.
[9]Bruick RK,McKnight SL.A conserved family of prolyl-4-hydroxylases thatmodify HIF.Science,2001,294:1337-1340.
[10]Pampin JB,Garcia Rivero SA,Otero Cepeda XL,et al. Immunohistochemical expression of HIF-la in response to early myocardial isehemia.JForensic sci,2006,51:120-124.
[11]Zhang S,Ma K,Liu Y,et al.Stabilization of Hypoxiainducible Factor by DMOG Inhibits Development of Chronic Hypoxia-Induced Right Ventricular Remodeling.J Cardiovasc Pharmacol,2016,67:68-75.
[12]Dawn B,Bolli R.HO-1 induction by HIF-1:a new mechanism for delayed cardioprotection.Am J Physiol Heart Circ Physiol,2005,289:H522-H524.
[13]Tekin D,Dursun AD,Xi L.Hypoxia inducible factor 1(HIF-1)and cardioprotection.Acta Pharmacologica Sinica,2010,31:1085-1094.
[14]Date T,Mochizuki S,Belanger AJ,et al.Expression of constitutively stable hybrid hypoxia-inducible factor-1alpha protects cultured rat cardiomyocytes against simulated ischemiareperfusion injury.Am JPhysiol Cell Physiol,2005,288:C314-320.
[15]Loor G,Schumacker PT.Role of hypoxia-inducible factor in cell survival during myocardial ischemia-reperfusion.Cell Death and Differentiation,2008,15:686-690.
The time regularity of hypoxia inducible factor-1αexpression after DMOG pretreatment in m yocardial ischem ic/reperfusion model
WANG Li-yue,LIU Yan,XUE Jin-hong,et al.Department of Physiology,School of Basic Medical Sciences,Shanxi Medical University,Taiyuan 030001,China
HE Zhong-mei,E-mail:hezmei@126.com
ObjectiveTo explore the time regularity of hypoxia inducible factor-1α(HIF-1α)expression after pretreatment with DMOG by observing the dynamic expression changes at HIF-1αprotein and mRNA levels in myocardial ischemia/reperfusion model.Methods A total of 78 male Wistar rats were randomly divided into 4 groups:Sham,MI/R,DMOG+MI/R,YC-1+MI/R(YC-1,inhibitor of HIF-1α).The I/R model was established by 45 min of left anterior descending artery(LAD)occlusion with the subsequent reperfusion at four different time points:0 h,3 h,6 h,9 h.Left ventricular anterior wall specimens were collected,and Real-time PCR and Western blot were used to detect the expression level of HIF-1αmRNA and protein in myocardium.Results⑴The protein expression of HIF-1αin D+MI/R group was significantly higher than that of MI/R group at the same time point after-reperfusion,the protein expression of HIF-1αin D+MI/R group was increased at first and then decreased,and reached the peak in the I/R 3 h(P<0.05).⑵There were no significant differences among themRNA expression of HIF-1αin any two groups and at four time points after I/R in each group(P>0.05).ConclusionDMOG pretreatment could stabilize the protein expression of HIF-1αafter MI/R,and it reach the peak at 3 h after I/R,but has no obvious influence on themRNA expression of HIF-1α,indicate that the effect occursmainly in the protein synthesis level rather than gene transcription level.
Hypoxia inducible factor-1α; DMOG; Myocardial Ischemic/reperfusion injury
山西省自然科学基金(项目编号:2016011115、2012011040-7);
030001 山西省太原市,山西医科大学基础医学院生理学系,细胞生理学山西省重点实验室
贺忠梅,E-mail:hezmei@126.com
10.3969/j.issn.1672-5301.2017.01.023
Q95-33;R542.2
A
1672-5301(2017)01-0082-04
2016-07-09)
山西医科大学科技创新基金(项目编号:01201501)

