无创心排量监测联合被动抬腿预测小儿先天性心脏病术后容量反应性的研究
骆德强 陈自力 戴巍 谢永玉
作者单位:33002 江西省南昌市,中国人民解放军第九四医院重症医学科(骆德强、陈自力);江西省上饶市第五人民医院重症医学科(戴巍);南昌大学医学院研究生院(谢永玉)
无创心排量监测联合被动抬腿预测小儿先天性心脏病术后容量反应性的研究
骆德强 陈自力 戴巍 谢永玉
作者单位:33002 江西省南昌市,中国人民解放军第九四医院重症医学科(骆德强、陈自力);江西省上饶市第五人民医院重症医学科(戴巍);南昌大学医学院研究生院(谢永玉)
目的 探讨无创心排量监测联合被动抬腿预测小儿先天性心脏病患儿术后容量反应性的作用。方法 选择2015年5月至2016年4月入住解放军第九四医院ICU的小儿先天性心脏矫治术后需要扩容的患儿纳入本研究,按四步进行。第一阶段,45°半卧位;第二阶段,躯体平躺脚45°位;第三阶段,45°半卧位;第四阶段,45°半卧位进行10 min内静脉输注10 ml/kg 6%羟乙基淀粉进行扩容。通过床旁超声连续进行四阶段心输出量(CO)和每搏输出量(SV)监测,根据扩容后SV的变化值△SV是否≥10%分为反应组和无反应组,受试者工作特征曲线(ROC curve)评价PLR所致△SV预测容量反应性的价值。结果 48例需要扩容的患儿纳入本研究,8例因不能得到满意的床旁超声多普勒信号被排除,26例(65.0%)患儿PLR所致△SV≥10%为反应组,△SV曲线下面积AUC为0.85±0.06,△SV≥10%预测容量反应性的敏感度和特异度分别为80.77%和64.29%,阳性预测值和阴性预测值分别是80.77%和64.29%。结论 通过无创心排量监测联合被动抬腿所致△SV对评估小儿先天性心脏术后患儿容量反应性具有一定的指导意义。
无创心排量监测; 被动抬腿实验; 容量反应性; 每搏输出量; 先天性心脏病
【Key words】Ultrasonic cardiac outputmonitor; Passive leg raising test; Fluid responsiveness; Stroke volume; Congenital heart disease
小儿先天性心脏病矫治术后充分的容量治疗尤为重要。容量不足会引起脏器功能损伤、乳酸代谢紊乱甚至循环衰竭。然而,过量的液体会造成左心衰竭和急性肺水肿。相对成人来说,小儿血容量监测比较困难。脉搏压变异率(PPV)和每搏量变异率(SVV)相对传统的中心静脉压(CVP)都非常适合测量成人的容量反应[1-4]。有研究表明,这些指标预测小儿容量反应性存在局限性,甚至可能出现相互矛盾的结果[5,6]。先天性心脏病矫治术后由于患儿肺动脉高压、呼吸末正压使用、左心室发育等因素影响,以往反映心脏前负荷的指标如中心静脉压(CVP)、肺动脉楔压(PAWP)预测小儿先天性心脏病矫治术后容量反应性结果较为局限,评价患儿容量反应性仍是一个临床难题[7,8]。本研究采用无创心排量监测技术(USCOM)联合被动抬腿试验(PLR)评估小儿先天性心脏病矫治术后患儿容量反应性的能力。
1 对象与方法
1.1 研究对象 2015年5月至2016年4月我院ICU收治的1~13岁无自主呼吸需呼吸机辅助的先天性心脏矫治术后需要扩容补液的患儿。患儿需要扩容补液的标准至少符合下列一项:①平均动脉压比基础值下降>30%,或需要中等剂量以上血管升压药物;②心率比基础心率上升>10%;③组织低灌注的表现,包括肾功能障碍(尿量<0.5 ml·kg-1·h-1在2 h以上,或出现急性肾损伤的生化指标变化),动脉血乳酸基础值增加1.5倍以上;④皮肤出现花斑。排除标准:①不能进行PLR的患儿;②左室射血分数<0.45;③气体干扰不能获得满意的多普勒超声信号的患儿。本研究通过医院伦理委员会的审核,所有治疗均得到患儿家属的知情同意。
1.2 研究方法
1.2.1 技术方案 第一阶段:患儿45°半卧位;第二阶段:PLR,患儿平躺位,下肢抬高45°进行PLR 5 min;第三阶段:回到45°半卧位;第四阶段:液体扩容,10 min内静脉输注10 ml/kg 6%羟乙基淀粉进行扩容。见图1。
1.2.2 血流动力学数据测量 采用 USCOM(PtyLtd,CoffSHarbour,NSW,Australia)进行测量。所有患儿血流动力学数据测量均由同一名操作熟练的医师进行,超声探头置于胸骨上窝获取满意的升主动脉血流多普勒信号,记录获取最佳信号的部位,测算3次取平均值。整个试验中测量均以此为准,测得每搏输出量(SV)和心排量(CO),经挠动脉或股动脉持续监测有创动脉血压(SBP),经颈内静脉中心置入4.5~5.5 F深静脉导管呼吸末监测CVP。每次测量前让患儿充分镇静,分别于PLR开始前、PLR过程中、PLR结束后和扩容结束后进行监测并记录HR、MAP、SV、CO、CVP。每次测量均在体位变动2 min后开始,阶段3和阶段4患儿体位没有变化,试验期间不调整患儿的血管活性药物剂量和呼吸机参数设置。
1.2.3 分组 根据扩容补液后SV增加的程度将患儿分为有反应组和无反应组,即与第1阶段相比,第4阶段扩容补液后SV增加≥10%为反应组,<10%为无反应组。
1.3 统计学方法 采用SPSS 19.0统计软件进行统计分析。连续变量以±s表示,如HR、CVP、MAP、CO、SV、血管活性药物评分、呼吸机参数和年龄,两组之间采用独立t检验,计数资料如性别构成采用χ2检验。受试者工作特征曲线(ROC曲线)分析PLR所致△SV预测容量反应性的价值。P<0.05为差异有统计学意义。
2 结果
2.1 两组基线资料比较 48例患儿入选本研究,8例因为不能获得满意的多普勒信号被排除,共40例患儿进行统计学分析。两组患儿的年龄、性别构成、体表面积、血管活性药物评分、呼吸机参数设置、疾病构成等一般资料比较均未见统计学差异(P均>0.05),见表1。
2.2 PLR和扩容(VE)前后血流动力学参数变化PLR和VE引起患儿SV的变化,反应后SV明显高于反应前(P均<0.05)。反应组和无反应组的HR在PLR前后和VE前后都无明显变化(P均>0.05)。40例患儿中26例(65.0%)患儿为反应组,14例(35.0%)为无反应组。PLR后反应组和无反应组患儿的SV、CO均明显增加(P均<0.05)。在阶段3,SV、CO有所下降,当进行补液扩容后,上述血流动力学指标再次明显增加(P均<0.01),而无反应组则增加不明显(P<0.05)。MAP在反应组患儿PLR前后及无反应组患儿中轻度增加(P>0.05),仅在补液反应组显示差异有统计学意义(P<0.05),无法准确评判是否容量反应。见表2~5。
表1 两组患儿基线资料比较[±s,例数及百分率(%)]

表1 两组患儿基线资料比较[±s,例数及百分率(%)]
注:VSD:室间隔缺损;ASD:房间隔缺损;TOF:法洛四联症。1 cm H2O=0.098 kPa,1mm Hg=0.133 kPa
组别 例数 年龄(岁)性别体表面积(m2)机械通气 先心手术类男性 女性 潮气量(m l/kg)PEEP(cm H2O)入住ICU时间(d)血管药物评分 VSD ASD VSD+ ASD TOF无反应组 14 4.75±2.54 6(45.0) 8(45.0) 0.56±0.19 7.64±0.63 4.64±1.21 12.73±4.27 4.07±2.67 6(42.9) 3(21.4) 4(28.6) 1(7.1)反应组 26 5.76±3.57 12(45.0) 14(45.0) 0.63±0.22 7.50±0.51 5.19±2.02 14.62±6.35 5.69±2.42 12(46.2) 8(30.8) 3(11.5) 3(11.5)P值 0.36 0.82 0.32 0.44 0.55 0.33 0.06 0.84 0.53 0.18 0.66
表2 先心矫治术后患儿反应组PLR前后血流动力学指标的变化比较(±s)

表2 先心矫治术后患儿反应组PLR前后血流动力学指标的变化比较(±s)
注:PLR:被动抬腿试验;HR:心率;CVP:中心静脉压;MAP:平均动脉压;CO:心排血量;SV:每搏量。1 cm H2O=0.098 kPa,1mm Hg=0.133 kPa
组别 例数 HR(次/min) CVP(cm H2O) MAP(mm Hg) CO(L/min) SV(m l)反应组PLR前 26 131.15±15.67 9.46±1.61 65.89±5.37 3.16±0.47 21.27±7.07反应组PLR后 26 130.59±11.26 10.28±1.00 66.39±3.98 3.58±0.51 27.96±7.00 t值 0.15 2.22 0.39 3.10 3.43 P值0.88 0.31 0.70 0.00 0.00
表3 先心矫治术后患儿无反应组PLR前后血流动力学指标的变化比较(±s)
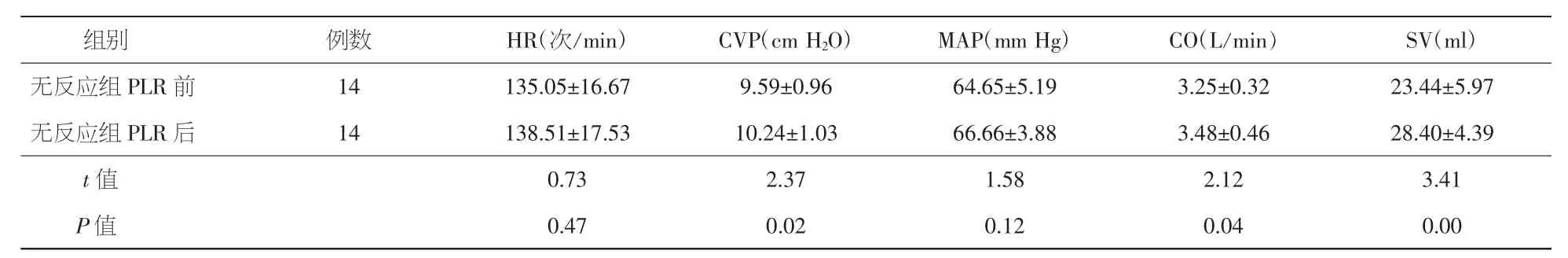
表3 先心矫治术后患儿无反应组PLR前后血流动力学指标的变化比较(±s)
注:PLR:被动抬腿试验;HR:心率;CVP:中心静脉压;MAP:平均动脉压;CO:心排血量;SV:每搏量。1 cm H2O=0.098 kPa,1mm Hg=0.133 kPa
组别 例数 HR(次/min) CVP(cm H2O) MAP(mm Hg) CO(L/min) SV(ml)无反应组PLR前 14 135.05±16.67 9.59±0.96 64.65±5.19 3.25±0.32 23.44±5.97无反应组PLR后 14 138.51±17.53 10.24±1.03 66.66±3.88 3.48±0.46 28.40±4.39 t值 0.73 2.37 1.58 2.12 3.41 P值0.47 0.02 0.12 0.04 0.00
表4 先心矫治术后患儿反应组VE前后血流动力学指标的变化比较(±s)
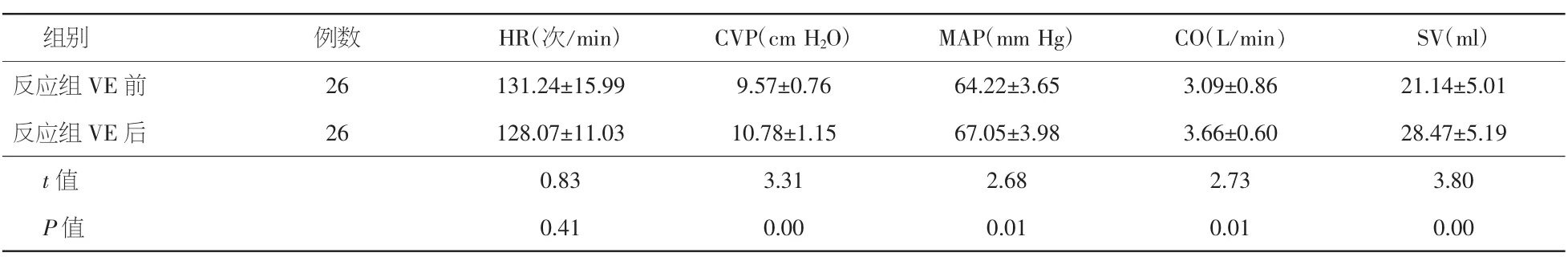
表4 先心矫治术后患儿反应组VE前后血流动力学指标的变化比较(±s)
注:VE:容量负荷试验;HR:心率;CVP:中心静脉压;MAP:平均动脉压;CO:心排血量;SV:每搏量。1 cm H2O=0.098 kPa,1mm Hg=0.133 kPa
组别 例数 HR(次/min) CVP(cm H2O) MAP(mm Hg) CO(L/min) SV(m l)反应组VE前 26 131.24±15.99 9.57±0.76 64.22±3.65 3.09±0.86 21.14±5.01反应组VE后 26 128.07±11.03 10.78±1.15 67.05±3.98 3.66±0.60 28.47±5.19 t值 0.83 3.31 2.68 2.73 3.80 P值0.41 0.00 0.01 0.01 0.00
表5 先心矫治术后患儿无反应组VE前后血流动力学指标的变化比较(±s)

表5 先心矫治术后患儿无反应组VE前后血流动力学指标的变化比较(±s)
注:VE:容量负荷试验;HR:心率;CVP:中心静脉压;MAP:平均动脉压;CO:心排血量;SV:每搏量。1 cm H2O=0.098 kPa,1mm Hg=0.133 kPa
组别 例数 HR(次/min) CVP(cm H2O) MAP(mm Hg) CO(L/min) SV(m l)无反应组VE前 14 136.94±6.85 9.48±1.74 65.55±4.11 3.03±0.72 21.65±1.72无反应组VE后 14 132.99±11.85 10.36±1.38 67.00±5.41 3.36±0.69 24.06±3.24 t值 1.08 2.03 0.30 1.23 2.41 P值0.29 0.05 0.77 0.23 0.02
2.3 PLR和VE对两组患者试验后每搏量增加值(△SV)和试验后中心静脉压增加值(△CVP)的影响及其相关性分析 两组PLR和VE后的SV均较基线值有所增加,且反应组△SV明显高于无反应组(P均<0.01)。PLR和VE后反应组与无反应组△CVP比较均未见统计学差异(P均>0.05)。相关性分析显示,△SVPLR与△SVVE呈正相关(r=0.628,P<0.01),△CVPPLR与△SVVE呈负相关(r=-0.187,P= 0.248)。见表6。
2.4 △SVPLR和△CVPPLR预测患儿容量反应性的ROC曲线分析 △SVPLR预测患儿的容量反应性ROC曲线下面积(AUC)为0.852±0.060[95%可信区间(95%CI)0.734~0.970,P<0.01];△SVPLR≥10.0%的敏感度为80.77%,特异度为64.29%。△CVPPLR预测患儿的容量反应性AUC为0.462±0.095(95%CI 0.276~0.647,P=0.691);△CVPPLR≥10.0%的敏感度为80.77%,特异度为14.29%。说明△SVPLR预测容量反应性的能力优于△CVPPLR。见图2。
表6 P LR和VE对不同容量反应性两组先心矫治术后患儿△SV和△CVP的影响(±s)
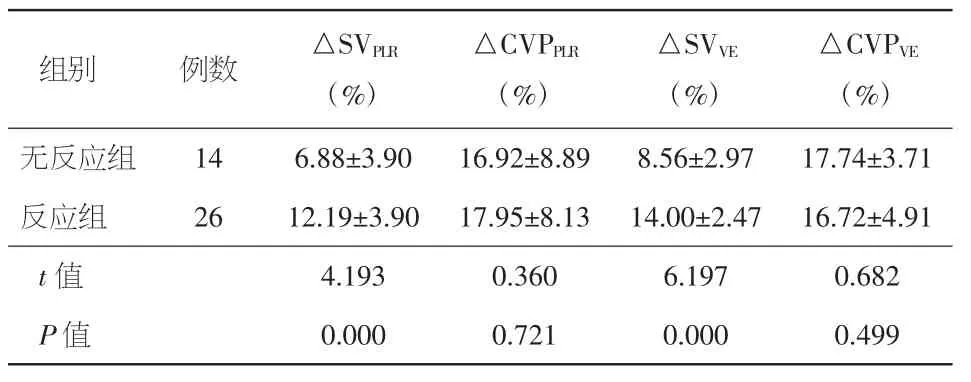
表6 P LR和VE对不同容量反应性两组先心矫治术后患儿△SV和△CVP的影响(±s)
注:PLR:被动抬腿试验;VE:容量负荷试验;△SV:试验后每搏量增加值;△CVP:试验后中心静脉压增加值
组别 例数 △SVPLR(%)△CVPPLR(%)△SVVE(%)△CVPVE(%)无反应组 14 6.88±3.90 16.92±8.89 8.56±2.97 17.74±3.71反应组 26 12.19±3.90 17.95±8.13 14.00±2.47 16.72±4.91 t值 4.193 0.360 6.197 0.682 P值 0.000 0.721 0.000 0.499
3 讨论
最优化的容量治疗对先天性心脏矫治术后患儿保持最佳心功能和稳定的血流动力学至关重要。小儿先天性心脏病矫治术后由于心脏切口、术前左心室发育不良、体外循环引起炎性反应、心肌水肿、右室流出道疏通的程度、左右肺动脉的发育及呼吸末正压等多因素影响,容量评估相对比较复杂。Swan-Gans导管目前无小儿型号,传统评估容量变化指标如MAP、HR和CVP,因心脏病矫治术后受到心功能、肺动脉发育、心室顺应性、胸腔压力及机械通气等众多因素的影响而无法准确预测容量反应性[9,10]。近年脉搏指示连续心排血量(PICCO)作为心脏矫治术后指导小儿容量调整的工具应用十分普遍,但是其有创性、材料昂贵、操作不便、数据解读等不利因素限制其推广应用[11]。随着ICU主导无创超声监测技术的开展,结合PLR操作简单、无创、实时监测等特点便于临床指导扩容补液。
床旁无创超声采用连续多普勒超声波技术,无创、准确、床旁实时测量经主动脉和肺动脉的CO和SV。国内外多项研究证实,床旁超声与PICCO所测得的CO及SV有高度相关性。同时超声对SV及SVV测量具有较高的敏感度,多普勒在体外对超声波流量传输时间探测的精确度可达到97%[12,13]。USCOM流量探针比较绵羊与以上相关的6倍CO范围正性肌力药物和血管活性药物治疗对5%SV变化具有敏感性[14]。人类这个敏感度为7.5%~10.0%,但仍具有很高的敏感度。对SV变化监测的高敏感度为临床指导补液提供参考,低SV和高SVV也指导我们当SV不再增加时结束补液。Renner等[15]分别用连续温度稀释法和床旁超声监测26例先天性心脏病矫治术后患儿的CO、CI、SVV、PPV,结果显示,两种方法所测得的CO、CI、SVV、PPV均具有显著相关性。Cavallaro等[16]用床旁超声联合PLR测量成人患者的CO值,其在PLR后变化非常明显且相关性很强(敏感度89.4%,特异度91.4%)。武宇辉等[17]应用PLR和USCOM观察40例自主呼吸脓毒症患儿容量反应性的敏感度为80.0%,特异度为88.9%。Angappan等[18]应用床旁无创超声联合PLR预测△SV增加≥13%的敏感度为78%,特异度为89%。上述研究结果显示,小儿心脏术后无创超声结合PLR对容量的判定具有较高的价值,同时小儿心脏术后信号较少受影响,可以取得满意的测量信号,且床旁超声完全无创、准确、实时监测且操作简单,临床上值得推广使用。
本研究采用床旁无创超声监测对小儿心脏术后患儿PLR及扩容补液过程中血流动力学参数进行监测,测算变化每搏量与原始每搏量的比值是否≥10%,从而评价预测容量反应性的能力,评估扩容补液的终点,更好地优化心脏矫治术后患儿的心功能。将△SV≥10%定义为具有容量反应性截点,是结合本研究疾病特点及小儿腿较短、PLR回心血量有限,同时结合国内外研究选定的[19,20]。本研究中,传统的HR和MAP在预测心脏术后的容量反应性意义不大(P>0.05),这可能与心脏矫治术后血管活性药物的应用对心率的影响所致,而MAP则是PLR和VE前后短时间对循环的影响较小所致。床旁超声通过测量PLR所致△SV预测心脏术后患儿容量反应性具有80.77%敏感度,但是特异度仅为64.29%。相关性分析显示,△SVPLR与△SVVE呈正相关(r=0.628,P<0.01)。分析特异度不高可能与以下原因有关:①本研究选取的心脏矫治术后的患儿心功能变化较大,对补液和PLR引起的容量分布可能存在差异。②术后心功能不全患儿血管活性药物评分较高,下肢血管收缩,PLR的影响可能被减弱,例如体外循环时间较长致高腹压患者因下肢静脉回流受限及严重低血容量状态,使回心血量减少,均可降低PLR的预测能力[21]。③由于应用无创床旁超声测量技术有误差,使检测结果可能与实际存在差别。而△CVP在PLR和VE前后预测容量反应性的敏感度同样为80.77%,而特异度只有14.29%。相关性显示,△CVPPLR与△SVVE呈负相关(r=-0.187,P=0.248)。分析主要原因是CVP受体位、呼吸机使用、心脏发育、肺水肿及心脏矫治后的结构、测量准确性等因素影响,变异度较大,故评价容量反应的特异度不高,再次验证了△SV预测容量反应性优于△CVP。
本研究的不足之处:①样本含量比较小,需要纳入更多的样本量验证此结论。②先天性心脏病由于疾病不同,矫治术后心脏结构也不相同,因此对容量反应性也不相同。
综上所述,经胸壁无创床旁超声监测联合PLR所致△SV对评估小儿先天性心脏病矫治术后患儿容量反应性具有指导意义,可用于小儿先天性心脏病矫治术后机械通气患儿容量性反应性评估。
(本文图片见后插三)
[1]Renner J,Broch O,Duetschke P,et al.Prediction of fluid responsiveness in infants and neonates undergoing congenital heart surgery.Brit JAnaesth,2011,108:108-115.
[2] Marik PE,Cavallazzi R,Vasu T,et al.Dynamic changes in arterial waveform derived variables and fluid responsiveness in mechanically ventilated patients:a systematic review of the literature.Crit Care Med,2009,37:2642-2647.
[3]Fabian V,Havlik J,Dvorak J,et al.Differences in mean arterial pressure of young and elderly people measured by oscilometry during inflation and deflation of the arm cuff.Biomed Tech(Berl),2016 Mar 4.[Epub ahead of print]
[4]Lee CK,Rinehart J,Canales C,et al.Comparison of automated vs.manual determination of the respiratory variations in the EKG R wave amplitude for the prediction of fluid responsiveness during surgery.JCompu Surg,2014,1:1-12.
[5]Byon HJ,Lim CW,Lee JH,et al.Prediction of fluid responsiveness in mechanically ventilated children undergoing neurosurgery. Brit JAnaesth,2012,110:586-591.
[6]de Souza Neto EP,Grousson S,Duflo F,et al.Predicting fluid responsiveness in mechanically ventilated children under general anaesthesia using dynamic parameters and transthoracic echocardiography.Brit JAnaesth,2011,106:856-864.
[7]Sasai T,Tokioka H,Fukushima T,et al.Reliability of central venous pressure to assess left ventricular preload for fluid resuscitation in patients with septic shock.J Intens Care,2014,2:1-7.
[8]Molnár Z.Individualized goal directed perioperative care-the way to go!Front Med,2015,2:22.
[9]Begot E,Dalmay F,Etchecopar C,et al.Hemodynamic assess ment of ventilated ICU patients with cardiorespiratory failure using a miniaturized multiplane transesophageal echocardiography probe.Intens Care Med,2015,41:1886-1894.
[10]关晶,李建民.机械通气中呼气末正压对中心静脉压的影响.湖南师范大学学报:医学版,2014,11:33-34.
[11]王助衡,张静,李玉伟,等.严重脓毒症液体复苏中全心舒张期末容积指数与中心静脉压的相关性研究.中国中西医结合急救杂志,2013,20:248-249.
[12]Guinot PG,De BB,Bernard E,et al.Respiratory stroke volume variation assessed by oesophageal Doppler monitoring predicts fluid responsiveness during laparoscopy.Brit JAnaesth,2014,112:660-664.
[13]Guinot PG,Broca B,De Arab O,et al.Ability of stroke volume variation measured by oesophageal Dopplermonitoring to predict fluid responsiveness during surgery.Brit J Anaesth,2013,110:28-33.
[14]Phillips RA,Hood SG,Jacobson BM,et al.Pulmonary Artery Catheter(PAC)Accuracy and Efficacy Compared with Flow Probe and Transcutaneous Doppler(USCOM):An Ovine Cardiac Output Validation.Crit Care Res Pract,2012,2012:621496.
[15]Renner J,Broch O,Duetschke P,et al.Prediction of fluid responsiveness in infants and neonates undergoing congenital heart surgery.Brit JAnaesth,2012,108:108-115.
[16]Cavallaro F,Sandroni C,Marano C,et al.Diagnostic accuracy of passive leg raising for prediction of fluid responsiveness in adults:systematic review and meta-analysis of clinical studies. Intens Care Med,2010,36:1475-1483.
[17]武宇辉,刘晓红,李成荣,等.无创心排血量监测技术联合被动抬腿试验预测脓毒性休克患儿容量反应性的临床研究.中华危重病急救医学,2014,26:46-50.
[18]Angappan S,Parida S,Vasudevan A,et al.The comparison of stroke volume variation with central venous pressure in predicting fluid responsiveness in septic patients with acute circulatory failure.Indian J.Crit Care Med,2015,19:394-400.
[19] Monnet X,Marik P,Teboul JL.Passive leg raising for predicting fluid responsiveness:a systematic review and metaanalysis.Intens Care Med,2016,3:1-13.
[20]Soliman RA,Samir S,Naggar AE,et al.Stroke volume variation compared with pulse pressure variation and cardiac index changes for prediction of fluid responsiveness in mechanically ventilated patients.Egypt J Crit Care Med,2015,121:9-16.
[21]Préau S,Saulnier F,Dewavrin F,et al.Passive leg raising is predictive of fluid responsiveness in spontaneously breathing patients with severe sepsis or acute pancreatitis.Crit Care Med, 2010,38:819-825.
Clinical observation of non-invasive cardiac outputmonitoring combined w ith passive leg raising to predict fluid responsiveness in infants undergoing congenital heart surgery
LUO De-qiang*,CHEN Zi-li,DAIWei,et al.*Department of Intensive Care Unit,Chinese People′s Liberation Army No.94 Hospital,Nanchang 330002,China
CHEN Zi-li,E-mail:chenzili710@163.com
ObjectiveTo explore the value of non-invasive cardiac outputmonitoring combined with passive leg raising to predict fluid responsiveness in infants undergoing cardiac surgery.M ethodsFrom May 2015 to May 2016,48 infants undergoing cardiac surgery requiring fluid expansion were studied in four phases:Step 1:with upper body parts being 45°higher,Step 2:the upper parts of the body were then lowered to achieve a horizontal position with the lower limbs being raised 45°,Step 3:the patientwas then placed back in the initial position(the upper parts being 45°higher)for 10 min,Step 4:a bolus of intravenous fluid challenge was given to the patient using 10 ml/kg of 6%Hydroxyethyl starch.Measuring stoke volume(SV)and output(CO)by using bedside Doppler echocardiography device.Patients with an increase of SV≥10%and SV<10%induced by capacity fluid expansion were classified as responders and non-responders respectively.The role of PLR in predicting volume responsiveness were evaluated by receiver operating characteristic curve(ROC curve).Results48 infants of congenital heart disease need fluid expansion were included,8 patients were excluded because satisfactory Doppler signals could not been obtained.26(65.0%)patientswere responders with an increase of SV≥10%,by using ROC curve analysis,the area under the curve was 0.85±0.06 for SV≥10%induced by PLR.An increase in SV≥10%during PLR predictive volume responsiveness with a sensitivity of 80.77%and a specificity of 64.29%,positive predictive value of 80.77%and negative predictive value of 64.29%.ConclusionSV of PLR-induced changes in real time monitoring by non-invasive cardiac outputmonitoring device may be useful to predict volume responsiveness in infants undergoing cardiac surgery.
陈自力,E-mail:chenzili710@163.com
10.3969/j.issn.1672-5301.2017.01.011
R654.2
A
1672-5301(2017)01-0037-05
2016-05-23)

