p38 MAPK在MRP8/14诱导小鼠胚胎成纤维细胞凋亡中的作用
王娟,陈小欢,李磊,卢夏英,姜勇
(南方医科大学病理生理学教研室 广东省蛋白质组学重点实验室,广州510515)
·基础研究·
p38 MAPK在MRP8/14诱导小鼠胚胎成纤维细胞凋亡中的作用
王娟,陈小欢,李磊,卢夏英,姜勇
(南方医科大学病理生理学教研室 广东省蛋白质组学重点实验室,广州510515)
目的 探讨p38丝裂原活化蛋白激酶(p38 MAPK)对髓样相关蛋白8(MRP8)/髓样相关蛋白14(MRP14)诱导小鼠胚胎成纤维细胞凋亡的影响。方法 制备MRP8、MRP14、MRP8/14备用。分别取p38+/+和p38-/-细胞,随机分为空白对照组、MRP8组、MRP14组、MRP8/14组。MRP8组、MRP14组、MRP8/14组分别加入50 μg/mL MRP8、MRP14和MRP8/14。空白对照组加入等体积的DMEM培养液。各组干预24、48 h,采用MTT法检测p38+/+和p38-/-细胞活力。采用流式细胞术检测空白对照组及MRP8/14干预24、48 h组p38+/+和p38-/-细胞凋亡率。采用MTT法检测空白对照组、MRP8/14组以及TLR4受体抑制剂TAK242或RAGE中和抗体处理的MRP8/14(分别设为MRP8/14+TAK242组、MRP8/14+RAGE组)干预24 h p38+/+细胞活力。采用MTT法和流式细胞术检测空白对照组、MRP8/14组以及p38激酶抑制剂SB203580处理的MRP8/14(设为MRP8/14+SB203580组)干预24 h p38+/+细胞活力和凋亡率。采用Western blotting法检测MRP8/14干预0、1、2、4、6、8 h p38+/+细胞p38 MAPK磷酸化。结果 MRP8组、MRP14组、MRP8/14组干预24、48 h p38+/+、p38-/-细胞活力均低于空白对照组(P均<0.05),但无论MRP8/14组干预24 h还是48 h,p38-/-细胞活力明显高于p38+/+细胞(P均<0.05)。MRP8/14干预24、48 h组p38+/+细胞凋亡率均高于空白对照组,且MRP8/14干预48 h组细胞凋亡率更高(P均<0.05);而MRP8/14干预24、48 h组p38-/-细胞凋亡率均未见明显变化(P均>0.05)。MRP8/14组、MRP8/14+RAGE组干预24 h p38+/+细胞活力低于空白对照组、MRP8/14+TAK242组干预24 h(P均<0.05)。MRP8/14+SB203580组干预24 h p38+/+细胞活力较MRP8/14组干预24 h明显升高,细胞凋亡率较MRP8/14组干预24 h明显降低(P均<0.05)。MRP8/14干预2、4、6 h p38+/+细胞p38 MAPK磷酸化水平明显高于干预0、1、8 h(P均<0.05)。结论 p38 MAPK能促进MRP8/14诱导的小鼠成纤维细胞凋亡,其机制可能与TLR4-p38 MAPK信号通路激活有关。
胚胎成纤维细胞;髓样相关蛋白8;髓样相关蛋白14;p38丝裂原活化蛋白激酶;细胞凋亡;小鼠
髓样相关蛋白8(MRP8)、髓样相关蛋白14(MRP14)是S100蛋白家族的重要成员,被认为是机体重要的内源性损伤相关模式分子,可参与众多炎症相关疾病的发生、发展[1~3]。S100蛋白通常以同源或异源二聚体的形式发挥生物学功能[4]。一般认为,MRP8/14以异源二聚体的形式发挥生物学功能[5]。成纤维细胞可参与机体损伤修复及瘢痕形成,最近研究发现,成纤维细胞还可作为“岗哨细胞”启动机体炎症反应[6,7],而MRP8、MRP14均能够活化成纤维细胞,进而介导组织器官的损伤和纤维化过程[8,9]。关于MRP8、MRP14是否参与成纤维细胞的凋亡过程,目前尚不清楚。p38丝裂原活化蛋白激酶(p38 MAPK)是MAPK家族的重要成员之一,参与多种信号通路引起的级联反应[10,11]。有研究显示,MRP8/14介导的细胞凋亡可能与p38 MAPK信号通路有关[12]。2015年3月~2016年12月,本研究观察了p38 MAPK对MRP8/14诱导小鼠胚胎成纤维细胞凋亡的影响,现分析结果并探讨其可能的作用机制。
1 材料与方法
1.1 材料E.coliDE3感受态细胞由本实验室保存。小鼠胚胎成纤维细胞p38+/+和p38-/-细胞系,由美国斯克利普斯研究所韩家淮博士馈赠,本实验室保存。主要仪器:流式细胞仪,美国BD公司;垂直电泳仪,美国Bio-Rad公司;KodakIS4000R图像工作站,美国Kodak公司。主要试剂:pET14b-MCS-MRP8、pET14b-MCS-MRP14原核表达载体,由本实验室构建、保存;DMEM培养液、FBS,美国Gibco公司;LB培养基,美国Affymetrix公司;Ni2+-NTA-Resin,德国Qiagen公司;噻唑蓝(MTT),美国Sigma-Aldrich公司;异硫氰酸荧光素(FITC)标记的膜联蛋白V(Annexin V)细胞凋亡检测试剂盒,南京凯基生物科技发展有限公司;Bradford蛋白定量试剂盒,北京雷根生物技术有限公司;total-p38和磷酸化p38抗体及辣根过氧化物酶(HRP)偶联的抗兔IgG,美国Cell Signaling Technology公司;p38 MAPK抑制剂SB203580,德国Merck公司;Toll样受体4(TLR4)抑制剂TAK242,美国ApexBio公司;晚期糖基化终产物受体(RAGE)中和抗体,美国R&D公司。
1.2 MRP8/14制备 热休克法将融合蛋白重组载体转化E.coliDE3感受态细胞:取E.coliDE3感受态细胞悬液100 μL,加入pET14b-MCS-mMRP8或pET14b-MCS-mMRP14质粒50 ng,混匀,冰上放置30 min;42 ℃热激90 s,冰上放置5 min;加入LB培养基900 μL,37 ℃孵育1.5 h;1 000 r/min离心5 min,吸弃上清700 μL;剩余液体均匀涂布于含氨苄青霉素的培养板上,37 ℃倒置培养过夜。蛋白纯化:待培养板长出转化菌斑,挑取单菌落,接种于5 mL氨苄西林阳性的LB培养基中过夜;按1∶100稀释在LB培养基中扩大培养,待菌液光密度(OD)值达到0.6时,加入适量IPTG(终浓度为1 mmol/L),25 ℃摇床500 r/min继续培养10 h;4 ℃ 5 000 r/min离心5 min,收集沉淀;将沉淀重悬于5 mL结合缓冲液(10 mmol/L咪唑,0.5 mol/L NaCl,20 mmol/L Tris-HCl),冰上超声波裂解,4 ℃ 39 000×g离心20 min,收集上清。将上清置于含Ni2+-NTA-Resin的层析柱中,分别用10倍体积的结合缓冲液和6倍体积的冲洗缓冲液(20 mmol/L咪唑,0.5 mol/L NaCl,20 mmol/L Tris-HCl)洗涤,500 μL洗脱缓冲液(250 mmol/L咪唑,0.5 mol/L NaCl,20 mmol/L Tris-HCl)洗脱重组蛋白,经PBS透析、0.22 μm微孔滤膜过滤除菌,SDS-PAGE纯化His-MRP8和His-MRP14融合蛋白。根据文献[13]将MRP8与MRP14等摩尔比混合,室温孵育30 min,即为MRP8/14。
1.3 MRP8/14对小鼠胚胎成纤维细胞活力影响的观察 采用MTT法。分别取p38+/+和p38-/-细胞,接种于96孔板中,每孔1×104个;加入含10% FBS的DMEM培养液培养24 h,待细胞充分贴壁后,吸净旧培养基,加入不含FBS的DMEM培养液,继续培养6 h。随机将细胞分为4组:空白对照组、MRP8组、MRP14组、MRP8/14组,每组设5个复孔。MRP8组、MRP14组、MRP8/14组每孔加入50 μg/mL MRP8、MRP14和MRP8/14,空白对照组加入等体积的DMEM培养液。各组分别干预24、48 h,吸净旧培养基,加入适量MTT,使其终浓度为0.5 mg/mL,继续培养4 h。小心吸去孔内培养液,终止反应。然后加入DMSO 100 μL,摇床上低速振荡10 min。在多光谱微孔板阅读器上观察各孔490 nm波长处的OD值。以OD490值代表细胞活力。
1.4 MRP8/14对小鼠胚胎成纤维细胞凋亡影响的观察 采用流式细胞术。取p38+/+和p38-/-细胞分别按5×105个/皿接种于60 mm细胞培养皿中,随机将细胞分为空白对照组、MRP8/14干预24 h组、MRP8/14干预48 h组。当细胞生长至约90%融合时,MRP8/14干预24 h组、MRP8/14干预48 h组分别加入50 μg/mL MRP8/14干预24、48 h,空白对照组加入等体积的DMEM培养液。干预结束,用不含EDTA的胰酶消化细胞,1 000 r/min离心5 min,收集细胞。每组各取1×106个细胞,用冰冷的PBS漂洗2次,重悬于500 μL结合缓冲液中,然后加入2 μL Annexin V-FITC和5 μL碘化丙啶,室温避光孵育15 min。PBS漂洗1次,并重悬于适量流式鞘液中,上机检测细胞凋亡率。
1.5 TLR4、RAGE抑制剂对MRP8/14干预后p38+/+细胞活力影响的观察 取p38+/+细胞按5×105个/皿接种于60 mm细胞培养皿中,随机将细胞分为空白对照组、MRP8/14组、MRP8/14+TAK242组、MRP8/14+RAGE组,MRP8/14+TAK242组、MRP8/14+RAGE组分别用TAK242或RAGE中和抗体封闭1 h。当细胞生长至约90%融合时,MRP8/14组、MRP8/14+TAK242组、MRP8/14+RAGE中和抗体组分别加入50 μg/mL MRP8/14干预24 h,空白对照组仅加入等体积的DMEM培养液。按1.3中的方法收集细胞并检测细胞活力。
1.6 p38 MAPK抑制剂对MRP 8/14干预后p38+/+细胞活力影响的观察 取p38+/+细胞按5×105个/皿接种于60 mm细胞培养皿中,随机将细胞分为空白对照组、MRP8/14组、MRP8/14+SB203580组,其中MRP8/14+ SB203580组预先用20 μmol/L SB203580处理1 h。当细胞生长至约90%融合时,MRP8/14组、MRP8/14+ SB203580组分别加入50 μg/mL MRP8/14干预24 h,空白对照组加入等体积的DMEM培养液。分别按1.3、1.4中的方法收集细胞并检测细胞活力和凋亡率。
1.7 MRP8/14对p38+/+细胞p38 MAPK磷酸化影响的观察 采用Western blotting法。取p38+/+细胞按5×105个/皿接种于60 mm细胞培养皿中,常规培养。当细胞生长至约90%融合时,加入50 μg/mL MRP8/14干预,分别于干预0、1、2、4、6、8 h时收集细胞,加入150 μL细胞裂解液,冰上裂解20 min。利用细胞刮刮取细胞裂解物,4 ℃、12 000 r/min离心10 min,收集上清。Bradford蛋白定量试剂盒进行蛋白定量后,每时间点取总蛋白40 μg,行SDS-PAGE,采用半干转移法将凝胶蛋白转印至PVDF膜。用含5%脱脂奶粉的1×TBST缓冲液(20 mmol/L Tris-base,137 mmol/L NaCl,0.1% 吐温-20)室温封闭1 h,TBST缓冲液漂洗5 min×3次;一抗(1∶1 000)4 ℃孵育过夜,TBST缓冲液漂洗5 min×3次;HRP偶联的抗兔IgG二抗(1∶2 000)室温孵育1 h,TBST缓冲液漂洗5 min×3次。ECL化学发光显色,采用KodakIS4000R图像工作站取像分析。
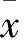
2 结果
2.1 各组干预24、48 h p38+/+及p38-/-细胞活力比较 见表1。
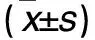
表1 各组干预24、48 h p38+/+及p38-/-细胞活力比较
注:与空白对照组干预24 h比较,*P<0.05;与空白对照组干预48 h相比,#P<0.05;与同组同干预时间p38+/+细胞比较,△P<0.05。
2.2 各组干预后p38+/+、p38-/-细胞凋亡率比较 见表2。
2.3 TLR4、RAGE抑制剂对MRP8/14干预后p38+/+细胞活力的影响 空白对照组p38+/+细胞
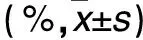
表2 各组干预后p38+/+、p38-/-细胞凋亡率比较
注:与空白对照组比较,*P<0.01。活力为0.63±0.14,MRP8/14组为0.28±0.07,MRP8/14+TAK242组为0.59±0.11,MRP8/14+RAGE组为0.31±0.04。MRP8/14组、MRP8/14+RAGE组p38+/+细胞活力低于空白对照组、MRP8/14+TAK242组(P均<0.05),而MRP8/14组与MRP8/14+RAGE组、空白对照组与MRP8/14+TAK242组比较差异均无统计学意义(P均>0.05)。
2.4 p38 MAPK抑制剂对MRP8/14干预后p38+/+细胞活力和细胞凋亡率的影响 见表3。

表3 各组干预后p38+/+细胞活力和凋亡率比较±s)
注:与空白对照组比较,*P<0.05,**P<0.01;与MRP8/14组比较,#P<0.05。
2.5 MRP8/14干预后p38+/+细胞p38 MAPK磷酸化水平变化 MRP8/14干预0、1、2、4、6、8 h,p38+/+细胞p38 MAPK磷酸化水平分别为2.77±0.25、2.80±0.20、22.1±2.52、34.71±2.02、46.00±2.18、2.50±0.50。MRP8/14干预2、4、6 h p38+/+细胞p38 MAPK磷酸化水平明显高于干预0、1、8 h(P均<0.05)。
3 讨论
MRP8和MRP14作为S100蛋白家族的成员,具有丰富的生物学功能,在多种疾病中高表达,近年来受到广泛关注[1,2,13~16]。MRP8/14的生物学功能极其丰富,可参与细胞骨架重塑、蛋白质磷酸化、钙离子稳态调节、中性粒细胞NADPH氧化酶调节等,对维持细胞稳态至关重要[17~19]。生理状态下,MRP8/14表达于中性粒细胞和单核细胞。病理状态下,细胞内MRP8/14可被活化,释放到细胞外,参与细胞多种生物学功能,包括启动炎症反应、介导细胞增殖与分化等[1,20]。已有研究证实,低浓度MRP8/14可促进细胞生长,而高浓度时(50~250 μg/mL)则诱导细胞凋亡,具有双重作用[21,22]。
成纤维细胞是机体细胞外基质的重要组成部分,主要参与机体创伤修复、瘢痕形成等过程[6,7]。某些亚群的成纤维细胞能被细菌产物、损伤组织释放产物及促炎性细胞因子等激活,通过促进细胞因子和趋化因子的合成与分泌,调动白细胞杀灭细菌[23,24]。说明成纤维细胞可参与机体的炎症反应过程。Zhang等[25]研究发现,MRP8、MRP14可通过促进表皮成纤维细胞的活化导致真皮纤维化;Zhong等[8]研究发现,心肌细胞释放的MRP8、MRP14能够诱导心肌成纤维细胞活化,从而参与心脏疾病过程中心肌细胞的炎症反应和纤维化;Wu等[26]研究亦发现,MRP8/14通过活化心肌成纤维细胞介导高血压中心脏的炎症和损伤。以上研究说明,MRP8/14能够诱导多种疾病状态下成纤维细胞的活化。但目前关于MRP8/14诱导成纤维细胞增殖和凋亡的报道相对较少。本研究结果显示,MRP8组、MRP14组、MRP8/14组干预24、48 h p38+/+、p38-/-细胞活力均低于空白对照组,但无论MRP8/14组干预24 h还是48 h,p38-/-细胞活性明显高于p38+/+细胞。本研究结果还显示,MRP8/14干预24、48 h组p38+/+细胞凋亡率均高于空白对照组,且MRP8/14干预48 h组细胞凋亡率更高;而MRP8/14干预24、48 h组p38-/-细胞凋亡率均未见明显变化。提示MRP8/14能诱导成纤维细胞凋亡。
MRP8/14发挥功能依赖于与靶细胞表面特异性受体的结合。已有报道,MRP8/14的特异性受体包括RAGE、TLR4等[13,21,27]。本研究结果显示,MRP8/14组、MRP8/14+RAGE组p38+/+细胞活力低于空白对照组、MRP8/14+TAK242组,而MRP8/14组与MRP8/14+RAGE组、空白对照组与MRP8/14+TAK242组比较差异无统计学意义。说明MRP8/14主要通过与细胞膜表面的TLR4结合影响成纤维细胞活性。
p38 MAPK是MAPKs通路中的重要分支,可参与多种信号通路引起的级联反应[10]。p38 MAPK在介导细胞凋亡中的作用机制尚不明确。有研究表明,p38 MAPK特异性抑制剂SB203580可通过调节脂多糖干预ERK信号通路活化,继而促进中性粒细胞凋亡[28]。也有研究发现,活化的p38 MAPK能够增强化疗药物引起的细胞凋亡,从而发挥抗肿瘤效应[29]。Lee等[12]研究发现,MRP14通过诱导炎性细胞因子的释放,进而激活下游的信号分子,如p38 MAPK,继而发挥抗细胞凋亡作用。本研究结果显示,MRP8/14+SB203580组p38+/+细胞活力较MRP8/14组明显升高,细胞凋亡率较MRP8/14组明显降低。说明p38 MAPK在MRP8/14诱导小鼠成纤维细胞凋亡中具有重要作用。进一步研究发现,MRP8/14干预p38+/+细胞2 h,p38 MAPK磷酸化水平明显升高,6 h达到高峰,8 h基本恢复正常水平。说明MRP8/14能够以时间依赖性模式诱导p38 MAPK磷酸化。
综上所述,p38 MAPK能促进MRP8/14诱导的小鼠成纤维细胞凋亡,这一效应可能是通过TLR4-p38 MAPK信号通路激活实现的。
[1] Ehrchen JM, Sunderkötter C, Foell D, et al. The endogenous Toll-like receptor 4 agonist S100A8/S100A9 (calprotectin) as innate amplifier of infection, autoimmunity, and cancer[J]. J Leukoc Biol, 2009,86(3):557-566.
[2] Foell D, Wittkowski H, Vogl T, et al. S100 proteins expressed in phagocytes: a novel group of damage-associated molecular pattern molecules[J]. J Leukoc Biol, 2007,81(1):28-37.
[3] Stríz I, TrebichavskI. Calprotectin-a pleiotropic molecule in acute and chronic inflammation[J]. Physiol Res, 2004,53(3):245-253.
[4] Schäfer BW, Heizmann CW. The S100 family of EF-hand calcium-binding proteins: functions and pathology[J]. Trends Biochem Sci, 1996,21(4):134-140.
[5] Leukert N, Vogl T, Strupat K, et al. Calcium-dependent tetramer formation of S100A8 and S100A9 is essential for biological activity[J]. J Mol Biol, 2006,359(4):961-972.
[6] 聂小蒙,何晓文,卢建.成纤维细胞在炎症反应中具有“岗哨细胞”的作用[J].中国病理生理杂志,2000,16(4):368-370.
[7] Mescher AL. Macrophages and fibroblasts during inflammation and tissue repair in models of organ regeneration[J]. Regeneration (Oxf), 2017,4(2): 39-53.
[8] Zhong A, Xu W, Zhao J, et al. S100A8 and S100A9 are induced by decreased hydration in the epidermis and promote fibroblast activation and fibrosis in the dermis[J]. Am J Pathol, 2016,186(1):109-122.
[9] Xu X, Chen H, Zhu X, et al. S100A9 promotes human lung fibroblast cells activation through receptor for advanced glycation end-product-mediated extracellular-regulated kinase 1/2, mitogen-activated protein-kinase and nuclear factor-κB-dependent pathways[J]. Clin Exp Immunol, 2013,173(3):523-535.
[10] Sui X, Kong N, Ye L, et al. p38 and JNK MAPK pathways control the balance of apoptosis and autophagy in response to chemotherapeutic agents[J]. Cancer Lett, 2014,344(2):174-179.
[11] Salvador-Bernáldez M, Mateus SB, Del Barco Barrantes I, et al. p38α regulates cytokine-induced IFNγ secretion via the Mnk1/eIF4E pathway in Th1 cells[J]. Immunol Cell Biol, 2017.doi:10.1038/icb.2017.51.[Epub ahead of print]
[12] Lee NR, Park BS, Kim SY, et al. Cytokine secreted by S100A9 via TLR4 in monocytes delays neutrophil apoptosis by inhibition of caspase 9/3 pathway[J]. Cytokine, 2016(86):53-63.
[13] Wang J, Vodovotz Y, Fan L, et al. Injury-induced MRP8/MRP14 stimulates IP-10/CXCL10 in monocytes/macrophages[J]. FASEB J, 2015,29(1):250-262.
[14] 胡兵荣,王娟,罗海华,等.MRP8/MRP14对宫颈癌细胞增殖的影响及机制[J].山东医药,2016,56(22):24-26.
[15] Ulas T, Pirr S, Fehlhaber B, et al. S100-alarmin-induced innate immune programming protects newborn infants from sepsis[J]. Nat Immunol, 2017,18(6):622-632.
[16] Hurnakova J, Zavada J, Hanova P, et al. Serum calprotectin (S100A8/9): an independent predictor of ultrasound synovitis in patients with rheumatoid arthritis[J]. Arthritis Res Ther, 2015(17):252.
[17] Vogl T, Ludwig S, Goebeler M, et al. MRP8 and MRP14 control microtubule reorganization during transendothelial migration of phagocytes[J]. Blood, 2004,104(13):4260-4268.
[18] Dale CS, Altier C, Cenac N, et al. Analgesic properties of S100A9 C-terminal domain: a mechanism dependent on calcium channel inhibition[J]. Fundam Clin Pharmacol, 2009,23(4):427-438.
[19] Kerkhoff C, Nacken W, Benedyk M, et al. The arachidonic acid-binding protein S100A8/A9 promotes NADPH oxidase activation by interaction with p67phox and Rac-2[J]. FASEB J, 2005,19(3):467-469.
[20] 杨红振,蔡文锋,胡卓伟.损伤相关模式分子与慢性疾病[J].生理科学进展,2009,40(3):234-240.
[21] Huttunen HJ, Kuja-Panula J, Sorci G, et al. Coregulation of neurite outgrowth and cell survival by amphoterin and S100 proteins through receptor for advanced glycation end products (RAGE) activation[J]. J Biol Chem, 2000,275(51):40096-40105.
[22] Ghavami S, Chitayat S, Hashemi M, et al. S100A8/A9: a janus-faced molecule in cancer therapy and tumorgenesis[J]. Eur J Pharmacol, 2009,625(1-3):73-83.
[23] Smith RS, Smith TJ, Blieden TM, et al. Fibroblasts as sentinel cells. Synthesis of chemokines and regulation of inflammation[J]. Am J Pathol, 1997,151(2):317-322.
[24] Díaz-Araya G, Vivar R, Humeres C, et al. Cardiac fibroblasts as sentinel cells in cardiac tissue: receptors, signaling pathways and cellular functions[J]. Pharmacol Res, 2015(101):30-40.
[25] Zhang W, Lavine KJ, Epelman S, et al. Necrotic myocardial cells release damage-associated molecular patterns that provoke fibroblast activation in vitro and trigger myocardial inflammation and fibrosis in vivo[J]. J Am Heart Assoc, 2015,4(6):e001993.
[26] Wu Y, Li Y, Zhang C, et al. S100a8/a9 released by CD11b+Gr1+ neutrophils activates cardiac fibroblasts to initiate angiotensin II-Induced cardiac inflammation and injury[J]. Hypertension, 2014,63(6):1241-1250.
[27] Vogl T, Tenbrock K, Ludwig S, et al. MRP8 and MRP14 are endogenous activators of Toll-like receptor 4, promoting lethal, endotoxin-induced shock[J]. Nat Med, 2007,13(9):1042-1049.
[28] Sheth K, Friel J, Nolan B, et al. Inhibition of p38 mitogen activated protein kinase increases lipopolysaccharide induced inhibition of apoptosis in neutrophils by activating extracellular signal-regulated kinase[J]. Surgery, 2001,130(2):242-248.
[29] Deacon K, Mistry P, Chernoff J, et al. p38 Mitogen-activated protein kinase mediates cell death and p21-activated kinase mediates cell survival during chemotherapeutic drug-induced mitotic arrest[J]. Mol Biol Cell, 2003,14(5):2071-2087.
Role of p38 MAPK on apoptosis of mouse embryo fibroblasts induced by MRP8/14
WANGJuan,CHENXiaohuan,LILei,LUXiaying,JIANGYong
(DepartmentofPathophysiology,SouthernMedicalUniversity,Guangzhou510515,China)
Objective To explore the role of p38 MAPK on the apoptosis of mouse embryo fibroblasts induced by myeloid-related protein 8 (MRP8)/myeloid-related protein 14 (MRP14). Methods MTT assay was performed to detect the cell viability of p38+/+and p38-/-cells in the control group and groups in which cells were treated with 50 μg/mL MRP8, MRP14, and MRP8/14 for 24 h and 48 h; flow cytometry was applied to detect the apoptosis rate of p38+/+and p38-/-cells in the control group and groups in which cells were treated with 50 μg/mL MRP8/14 for 24 h and 48 h; MTT assay was performed to detect the cell viability of p38+/+cells in the control group, MRP8/14 group, MRP8/14+TAK242(TLR4 inhibitor) group and MRP8/14+RAGE neutralized antibody group for 24 h; MTT and flow cytometry were used to analyze the cell viability and the apoptosis rate of p38+/+cells in the control group, MRP8/14 group, MRP8/14+SB203580 (p38 MAPK inhibitor) group for 24 h; Western blotting was used to detect the phosphorylation changes of p38 MAPK in p38+/+cells treated with MRP8/14 for 0, 1, 2, 4, 6, and 8 h, respectively. Results The cell viability of p38+/+and p38-/-cells in the groups treated with MRP8, MRP14, and MRP8/14 for 24 h and 48 h was lower than that of the control group (P<0.05). At the same time, the cell viability of p38-/-cells was significantly higher than that of p38+/+cells in the MRP8/14 group at 24 and 48 h (P<0.05). The apoptosis rate of p38+/+cells in the MRP8/14 group at 24 and 48 h was higher than that of the control group, especially at 48 h (allP<0.05). However, the apoptosis rate of p38-/-cells did not change after MRP8/14 treatment for 24 and 48 h. The cell viability of p38+/+cells in the MRP8/14 group and MRP8/14+RAGE neutralized antibody group was lower than that in the control group and MRP8/14 +TAK242 group (P<0.05). The cell viability of p38+/+cells in the MRP8/14+SB203580 group was higher than that of the MRP8/14 alone group, and the apoptosis rate of p38+/+cells in the MRP8/14+SB203580 group was lower than that of the MRP8/14 alone group (P<0.05). The phosphorylation level of p38 MAPK in p38+/+cells was significantly higher at 2, 4, and 6 h after MRP8/14 treatment than that at 0, 1, and 8 h (P<0.05). Conclusion MRP8/14 can induce the apoptosis of mouse embryo fibroblasts via the activation of TLR4-p38 MAPK pathway.
embryo fibroblasts; myeloid-related protein 8; myeloid-related protein 14; p38 mitogen-activated protein kinase; apoptosis; mouse
国家自然科学基金资助项目(81501691)。
姜勇(E-mail: yjiang48231@163.com)
10.3969/j.issn.1002- 266X.2017.28.008
R329.2
A
1002- 266X(2017)28- 0028- 05
2017- 02-26)

