iRoot BP对人乳牙牙髓细胞增殖、矿化的影响
战园,刘鹤
(1北京大学口腔医学院口腔医院第三门诊部,北京100081;2北京大学口腔医学院口腔医院)
iRoot BP对人乳牙牙髓细胞增殖、矿化的影响
战园1,刘鹤2
(1北京大学口腔医学院口腔医院第三门诊部,北京100081;2北京大学口腔医学院口腔医院)
目的 探讨iRoot BP对人乳牙牙髓细胞增殖、矿化的影响,为其用于乳牙活髓保存治疗提供依据。方法 将iRoot BP和三氧化矿物凝聚体(MTA)分别制成高度2 mm、直径8 mm的圆柱体,置于DMEM细胞培养基中,收集浸提液。原代培养人乳牙牙髓细胞并鉴定。随机将人乳牙牙髓细胞分为iRoot BP组、MTA组、对照组。iRoot BP组和MTA组分别加入适量iRoot BP、MTA浸提液,使其终浓度分别为10%、20%、50%、100%,对照组不予处理。采用CCK-8法检测三组培养24、72 h时细胞增殖指数,采用实时荧光定量PCR法检测三组培养48、96 h时碱性磷酸酶(ALP)mRNA表达(iRoot BP、MTA浸提液浓度均为10%)。结果 与对照组同时间点比较,含50%、100%浸提液的iRoot BP组、MTA组细胞增殖指数均降低(P均<0.05),而含10%、20%浸提液的iRoot BP组、MTA组细胞增殖指数无明显变化(P均>0.05)。与对照组同时间点比较,iRoot BP组、MTA组ALP mRNA相对表达量均升高(P均<0.05)。iRoot BP组与MTA组作用48、96 h ALP mRNA相对表达量比较差异均无统计学意义(P均>0.05)。结论 10% iRoot BP浸提液对人乳牙牙髓细胞增殖无明显影响,但可明显促进细胞矿化。
乳牙;牙髓保存;人乳牙牙髓细胞;直接盖髓材料;三氧化矿物凝聚体;细胞增殖;细胞分化
活髓保存是儿童牙髓治疗的首选方法,理想的活髓保存材料应该能够促进组织愈合,具有良好的生物相容性、封闭性、抗菌性、尺寸稳定性及操作性,能快速固化并不受潮湿环境影响等[1]。三氧化矿物凝聚体(MTA)克服了传统活髓保存材料的封闭性和生物相容性差等缺点[2], 盖髓后牙髓组织炎性反应较轻,可促进恒牙牙髓细胞再生,形成修复性牙本质[1, 3],目前常用于评价其他新型活髓保存材料的参照物[4]。但MTA在使用前需将粉剂和无菌注射用水混合,难以保证材料的均质性;而且其固化时间长,内含的三氧化二铋、铁、镁等成分易导致牙冠变色等[5]。iRoot BP是一种新型生物陶瓷材料,与MTA的基本组成成分类似。2016年10月~2017年1月,我们对iRoot BP与MTA在乳牙活髓保存中的效果进行了对比观察。现报告如下。
1 材料与方法
1.1 乳牙牙髓细胞培养及鉴定 经患儿监护人知情同意,收集临床无明显根吸收的滞留乳牙或因外伤需拔除的乳牙。无菌条件下取出牙髓组织,弃牙髓根尖2 mm部分,将其余组织剪碎,平铺于25 cm2培养瓶内。培养瓶中加入α-MEM培养基(美国Gibco公司),内含15% FBS(美国Gibco公司)、2 mmol/L谷氨酰胺(美国Sigma公司)、100 μmol/L左旋抗坏血酸磷酸盐(美国Sigma公司)、1×105U/L青霉素(华北制药集团有限责任公司)、100 mg/L链霉素(华北制药集团有限责任公司),置于37 ℃、5% CO2、饱和湿度环境中培养。每2~3天换液1次。取传4~6代细胞,免疫组化染色,显微镜下可见乳牙牙髓细胞呈典型的长梭形,具有成纤维细胞样形态;Cytokeratin表达呈弱阳性、Vimentin表达呈强阳性。证实为原代培养的人乳牙牙髓细胞。
1.2 iRoot BP及MTA浸提液制备 将iRoot BP、MTA分别制成高度2 mm、直径8 mm的圆柱体,紫外线灭菌3 h,置于50 mL DMEM培养基(含1 mmol/L L-Glu、10% FBS)中, 37 ℃细胞培养箱中浸提24 h。将iRoot BP、MTA浸提液采用0.22 μm滤器过滤除菌,4 ℃保存备用。
1.3 iRoot BP及MTA对牙髓细胞增殖能力影响的观察 取对数生长期牙髓细胞,接种于96孔板,每孔3×103个,37 ℃、5% CO2、饱和湿度环境中培养24 h。随机将细胞分为iRoot BP组、MTA组和对照组。iRoot BP组和MTA组分别加入适量iRoot BP、MTA浸提液,使其终浓度分别为10%、20%、50%、100%,对照组不予处理。三组分别于培养24、72 h,采用CCK-8法检测450 nm波长处各孔的光密度(OD)值。细胞增殖指数=(OD实验孔-OD空白孔)/(OD对照孔-OD空白孔)×100%。实验重复3次,取平均值。
1.4 iRoot BP及MTA对牙髓细胞碱性磷酸酶(ALP)mRNA表达影响的观察 取对数生长期牙髓细胞按1×104个/cm2接种于培养瓶中,随机分为iRoot BP组、MTA组和对照组。根据1.3的结果,iRoot BP组和MTA组仅加入浓度为10% iRoot BP、MTA的浸提液,对照组不予处理。每48 h换液1次,连续培养96 h。分别收集三组培养48、96 h细胞,加入细胞裂解液,TRIzol法提取细胞总RNA,逆转录合成cDNA。根据GenBank基因库公布的ALP、GAPDH(内参基因)mRNA 序列,使用Primer5.0软件设计引物。引物序列:ALP上游引物:5′-AGCACTCCCACTTCATCTGGAA-3′,下游引物:5′-GAGACCCAATAGGTAGTCCACATTG-3′,引物长度分别为22、25 bp;GAPDH上游引物:5′-CAACGGATTTGGTCGTATTGG-3′,下游引物:5′-GCAACAATATCCACTTTACCAGAGTTAA-3′,引物长度分别为21、28 bp。PCR反应体系共20 μL:Sybr Green Mix 10 μL、cDNA 0.5 μL、 Milli Q水8.5 μL和上下游引物各0.5 μmol/L。反应条件:50 ℃ 2 min,95 ℃ 10 min,95 ℃ 15 s、60 ℃ 1 min重复40个循环。采用2-ΔΔCt法计算各组ALP mRNA相对表达量。实验重复3次,取平均值。
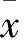
2 结果
2.1 三组细胞增殖指数比较 与对照组同时间点比较,含100%、50%浸提液的iRoot BP组、MTA组细胞增殖指数均降低,以含100%浸提液的iRoot BP组、MTA组细胞增殖指数降低更明显(P均<0.05)。含20%和10%浸提液的iRoot BP组、MTA组作用24、72 h细胞增殖指数与对照组比较差异均无统计学意义(P均>0.05)。含相同浓度浸提液的iRoot BP组、MTA组作用相同时间细胞增殖指数比较差异均无统计学意义(P均>0.05)。见表1。

表1 三组细胞增殖指数±s)
2.2 三组ALP mRNA表达比较 与对照组同时间点比较,iRoot BP组、MTA组ALP mRNA相对表达量均升高(P均<0.05)。iRoot BP组与MTA组作用48、96 h ALP mRNA相对表达量比较差异均无统计学意义(P均>0.05)。见表2。
表2 三组ALP mRNA相对表达量比较
注:与对照组同期比较,*P<0.05。
3 讨论
牙髓组织具有一定的修复能力,当其受到损伤时,原有的健康牙髓组织增殖分化并形成修复性牙本质,这是保存活髓的基础[6]。目前,保存活髓的方法主要为直接盖髓术。直接盖髓术是指在暴露的牙髓创面覆盖能使牙髓组织恢复的制剂,即盖髓剂。临床应用的盖髓剂主要有氢氧化钙和MTA。氢氧化钙作为盖髓剂时操作复杂,疗程较长,治疗成功率较低[7]。MTA中含三氧化二铋,作为阻射剂时,不仅会增加细胞毒性,抑制细胞增殖,还可能导致牙冠变色[8]。iRoot BP是保存活髓的新型材料,该材料以氧化钽、氧化锆代替了MTA中的三氧化二铋,可避免牙冠变色[9]。而且iRoot BP使用前无需调拌,可预先混合成膏状或糊状,吸收组织液或牙本质中的水分即可引发固化反应,临床操作性能优于MTA[10]。目前关于iRoot BP的研究主要集中于封闭性[11]、生物相容性[9]、成骨作用[12]等方面,其作为盖髓剂对牙髓细胞增殖及矿化影响的报道较少。
原代培养的人牙髓细胞、牙周膜细胞和牙龈上皮细胞等常作为口腔材料、药物生物安全性评价的模型[13,14]。本研究选择与盖髓材料直接接触的乳牙牙髓细胞作为研究对象,结果显示,与对照组同时间点比较,含100%、50%浸提液的iRoot BP组、MTA组细胞增殖指数均降低,而含20%、10%浸提液的iRoot BP组、MTA组细胞增殖指数则无明显变化。说明高浓度的iRoot BP、MTA浸提液可抑制人乳牙牙髓细胞增殖,而低浓度的浸提液则无明显增殖抑制作用,与以往研究[11]结果一致。因此,本研究选择10% iRoot BP、MTA浸提液进行后续实验。
ALP是与牙本质基质形成及矿化密切相关的蛋白,其表达水平可间接反映牙髓细胞向成牙本质样细胞分化,以及促进矿化、形成修复性牙本质的能力。研究证实,组织非特异型ALP可参与牙齿和骨等组织的代谢及矿化, ALP是成牙本质样细胞或成骨样细胞分化成熟的标志[14]。ALP是成骨细胞分化的早期表型标志物,其能水解磷酸酯,为羟基磷灰石的沉积提供磷酸[15]。本研究结果显示,同时间点iRoot BP组、MTA组ALP mRNA相对表达量均较对照组升高,但作用48、96 h时两组ALP mRNA相对表达量比较差异均无统计学意义。表明10% iRoot BP、MTA浸提液均能促进人乳牙牙髓细胞的矿化,且二者效果并无明显统计学差异。
综上所述,10% iRoot BP浸提液对人乳牙牙髓细胞增殖无明显影响,但可明显促进细胞矿化,具有良好的生物活性及促成骨作用。此外,iRoot BP的操作性和固化性更好,有望成为儿科临床适宜的直接盖髓材料。
[1] Karabucak B, Li D, Lim J, et al. Vital pulp therapy with mineral trioxide aggregate[J]. Dent Traumatol, 2005,21(4):240-243.
[2] Parirokh M ,Torabinejad M. Mineral trioxide aggregate: a comprehensive literature review--Part Ⅲ: Clinical applications, drawbacks, and mechanism of action [J]. J Endod, 2010,36(3):400-413.
[3] Witherspoon DE, Small JC, Harris GZ. Mineral trioxide aggregate pulpotomies: a case series outcomes assessment[J]. J Am Dent Assoc, 2006,137(5):610-618.
[4] 董艳梅.活髓保存治疗与生物活性盖髓剂的临床现状与研究[J].中华口腔医学杂志,2014,49(5):268-271.
[5] Asgary S, Parirokh M, Eghbal MJ, et al. Chemical differences between white and gray mineral trioxide aggregate[J]. J Endod, 2005,31(2):101-103.
[6] Goldberg M, Smith AJ. Cells and extracellular matrices of dentin and pulp: a biological basis for repair and tissue engineering[J]. Crit Rev Oral Biol Med, 2004,15(1):13-27.
[7] Mohammadi Z, Dummer PM. Properties and applications of calcium hydroxide in endodontics and dental traumatology[J]. Int Endod J, 2011,44(8):697-730.
[8] Camilleri J, Montesin FE, Papaioannou S, et al. Biocompatibility of two commercial forms of mineral trioxide aggregate[J]. Int Endod J, 2004,37(10):699-704.
[9] Zhang S, Yang X, Fan M. BioAggregate and iRoot BP Plus optimize the proliferation and mineralization ability of human dental pulp cells[J]. Int Endod J, 2013,46(10):923-929.
[10] 乔迪,董艳梅,高学军.体外评价新型根尖倒充填材料iRoot的生物学性能[J].北京大学学报(医学版),2016,48(2):324-329.
[11] Ma J, Shen Y, Stojicic S, et al. Biocompatibility of two novel root repair materials[J]. J Endod, 2011,37(6):793-798.
[12] Muincharern W, Louwakul P, Pavasant P, et al. Effect of fluocinolone acetonide on human dental pulp cells: cytotoxicity, proliferation, and extracellular matrix formation[J]. J Endod, 2011,37(2):181-184.
[13] Galler KM, Schweikl H, Hiller KA, et al. TEGDMA reduces mineralization in dental pulp cells[J]. J Dent Res, 2011,90(2):257-262.
[14] Yao KL, Todescan RJ, Sodek J. Temporal changes in matrix protein synthesis and mRNA expression during mineralized tissue formation by adult rat bone marrow cells in culture[J]. J Bone Miner Res, 1994,9(2):231-240.
[15] 王国红,李祺福.Cbfa1/Runx2与成骨细胞分化调控[J].生命科学,2005,17(1):40-44.
刘鹤(E-mail: heliu69@126.com)
10.3969/j.issn.1002- 266X.2017.28.027
R329.2
B
1002- 266X(2017)28- 0085- 03
2017- 02- 09)

