功能性单核苷酸多态性调控结核病易感的分子机制研究
朱秀云 汪文斐 张培泽 张洁云 邱智辉 王召钦 张明霞 邓国防
·论著·
功能性单核苷酸多态性调控结核病易感的分子机制研究
朱秀云 汪文斐 张培泽 张洁云 邱智辉 王召钦 张明霞 邓国防
目的 通过构建花生四烯酸12-脂氧合酶(ALOX-12)基因(ALOX-12基因)启动子区域rs3840880位点不同基因型的双荧光素酶表达质粒,分析此单核苷酸多态性(single nucleotide polymorphisms,SNP)对ALOX-12基因启动子活性的影响及其对基因表达的影响,阐明功能性SNP调控结核病易感的分子机制。方法 从全血样本中提取人全基因组,PCR扩增ALOX-12基因启动子区域包含rs3840880位点在内的约1700 bp的基因片段,构建pGL3-Basic-rs3840880G质粒,对此质粒进行定点突变得到pGL3-Basic-rs3840880 D放散型(DEL)质粒,分别转染人宫颈癌细胞株Hela细胞后使用双荧光报告酶检测系统(dual luciferase assay system)检测相对荧光值。结果 成功构建了ALOX-12基因启动子区rs3840880位点等位基因G的表达质粒pGL3-basic-G,采用定点突变技术成功将pGL3-basic-G质粒改造为pGL3-Basic-DEL质粒,测序验证后,两质粒其他序列完全相同。分别将此两个质粒转染Hela细胞并检测相对荧光比值[荧光值(F)/荧光(R)]后,发现pGL3-Basic质粒F/R=0.129,等位基因G的F/R=0.194,低于等位基因DEL质粒的F/R(0.274),采用单因素方差分析,二者之间的差异有统计学意义(F=25.09,P=0.001)。结论 不同等位基因构建的质粒转染细胞后,荧光报告基因的表达差异具有统计学意义,故ALOX-12基因启动子区域的功能性SNPs确实能够影响启动子的活性,从而调控结核病的易感性。
花生四烯酸盐12-脂氧合酶; 多态性, 单核苷酸; 荧光光度测定法; 结核病; 基因表达调控, 细菌
结核病作为一种慢性炎症反应疾病,是多因素导致的复杂疾病。据世界卫生组织最新的调查报告显示,全球约有1/3的人口感染结核分枝杆菌,而在发生结核分枝杆菌感染的人群中仅有5%~10%发生结核病的事实表明,宿主遗传易感性在结核病的发生中起着关键作用,抗炎药物应答反应具有宿主基因型特异性也是结核病靶向基因和药物治疗的基础。
全国结核病流行病学抽样调查表明,我国结核病发病率下降缓慢,每年因结核病死亡的患者约12万例,相当于其他传染病死亡总和的2倍[1-2]。结核病的发病受多种因素影响,目前具体机制尚不清楚[3]。脂氧合酶(LOX)家族的多个基因亚型表达具有物种和组织特异性[4],12-羟基二十碳四烯酸(12-HETE)是由脂氧合酶-12(LOX-12)催化花生四烯酸(AA)产生,它广泛参与多种炎症疾病的病理生理过程,被认为是体内最重要的内源性脂质促炎介质之一。虽然有关花生四烯酸12-脂氧合酶(ALOX-12)基因(ALOX-12基因)多态性与疾病遗传易感性的有关研究有限,但在这些仅有的少量报道中业已发现ALOX-12基因与多个人类疾病易感性有关,包括炎症反应性疾病、肿瘤和慢性感染性疾病[3]。LOX基因单核苷酸多态性(single nucleotide polymorphisms,SNP)位点rs2115819也被报道与结核病的易感性有关,是LOX基因家族多态性在中国汉族人群,尤其是儿童群体中为数不多的研究之一[5]。Tobin等[6]研究发现,位于白三烯A4水解酶(leukotriene A4 hydrolase, LTA4H)(LTA4H基因)启动子区域的rs17525495位点,在结核性脑膜炎中,TT基因型患者未经地塞米松抗炎治疗,其死亡率高于CC基因型;而经过地塞米松治疗后,TT基因型的患者死亡率反而最低。这些研究进一步提示我们,宿主基因多态性不仅与疾病的易感性相关,而且影响药物的应答反应,进而影响疾病的临床转归。
荧光素酶报告系统是通过双荧光素酶基因表达的转录调控来研究培养细胞的生物学特性。将不同的ALOX-12基因的SNP与启动子分别插入到带有萤火虫荧光素酶基因和海肾荧光素酶基因PGL3-Basic载体中,两种基因分别转染到状态良好的Hela细胞,利用目的基因表达时荧光素酶基因也同时表达的作用,分别利用萤火虫荧光素酶与海肾荧光素酶相应的不同底物反应产生荧光,通过检测荧光强度反应反映出不同SNP对ALOX-12基因启动子活性的影响。本研究所取得的成果将深入地揭示宿主ALOX-12基因遗传易感性在结核病发生发展中的作用,为结核病易感人群的预防干预决策及结核病基因型特异性个体化治疗提供理论依据。
资料和方法
一、材料
实验标本:取人血液样本2 ml提取全基因组DNA,通过紫外分光光度计测定DNA浓度均≥50 ng/μl,NanoDrop DNA测定仪(美国Thermo Fisher公司)测定DNA纯度[吸光度(A)260/280比值(指260 nm和280 nm下吸光度比值)]。
二、试剂
(1)全血DNA抽提试剂盒 QIAamp DNA Blood Mini kit购自Qiagen 公司;(2)双荧光素酶检测试剂盒Dual-Glo®luciferase assay system购自普洛麦格(北京)生物技术有限公司;(3)内切酶、T4连接酶、PCR反应试剂购自Takara公司;(4)细胞转染试剂LipofectamineTM2000购自Invitrogen公司;(5)StarMut多点基因定点突变试剂盒(StarMut Site-directed Mutagenesis Kit)购自安捷伦生物技术有限公司;(6)荧光素酶报告基因载体pGL3-Basic和Hela细胞系由本实验室保存。
三、方法
1.不同SNP位点双荧光素表达质粒的构建:根据ALOX-12基因启动子基因片段设计PCR引物,以前期提取的基因组DNA为模板进行扩增,酶切回收的ALOX-12基因启动子片段与pGL3-Basic质粒进行连接,构建pGL3-Basic-rs3840880G表达质粒,将此表达质粒进行定点突变得到pGL3-Basic-rs3840880DEL表达质粒,并测序验证。
2.将质粒转染到Hela细胞中:提前24 h用无抗生素DMEM培养基(Dulbecco modified Eagle medium)+10%胎牛血清(FBS)铺板六孔板Hela细胞,2 ml/孔。确保细胞密度达到80%~90%融合度;按照每种质粒做2个复孔,2个空白对照要求,每孔(下同)用500 μl 无血清培养基稀释2 μg 表达质粒;500 μl 无血清培养基稀释10 μl 脂质体2000;5 min后,将DNA溶液和脂质体溶液混合,室温静置20 min;从6孔板中吸出1 ml无血清培养基,然后滴加入1 ml质粒和脂质体混合物;6~10 h后,移除含有DNA-脂质体复合物的培养基,代之以正常培养液DMED+10%FBS(从此刻开始算时间),24 h 后进行荧光检测。
3.双荧光素表达系统检测:根据Dual-Glo®luciferase assay system试剂盒要求,将检测试剂配制好,按照如下步骤操作检测荧光;从恒温孵箱中取出培养有Hela细胞的六孔板。为获取最佳结果,在进行第2步前将Dual-Glo®luciferase reagent(荧光素酶试剂)加入板中;将转染后的Hela细胞消化后,用磷酸盐缓冲液(PBS)清洗打匀、混匀。分别取75 μl 加入到已经加入Dual-Glo®luciferase reagent的对应的白板孔中;静置15 min,让细胞充分裂解,然后在荧光发光仪中测量荧光值。
结 果
一、ALOX-12基因启动子片段扩增
根据实验需求,提取人类基因组DNA,使用ALOX-12基因启动子引物对其进行PCR扩增,使用1%(W/V)琼脂糖凝胶进行PCR产物鉴定,与预期结果相符(图1)。
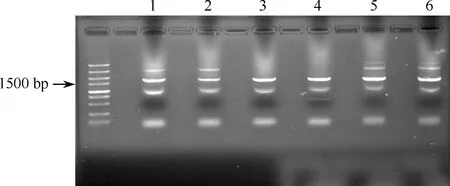
图1 1~6为ALOX-12基因各引物组合的PCR扩增产物;最终选取3、4目的条带约1700 bp进行切胶回收
二、ALOX-12基因启动子片段与pGL3-Basic质粒的连接克隆
用 NcoⅠ和XhoⅠ内切酶对片段和载体进行酶切,酶切产物用1%琼脂糖凝胶电泳。回收1700 bp目的基因片段,并将其与酶切回收后的pGL3-Basic质粒进行连接后得到pGL3-rs3840880G质粒;菌液PCR和测序鉴定见图2,3。
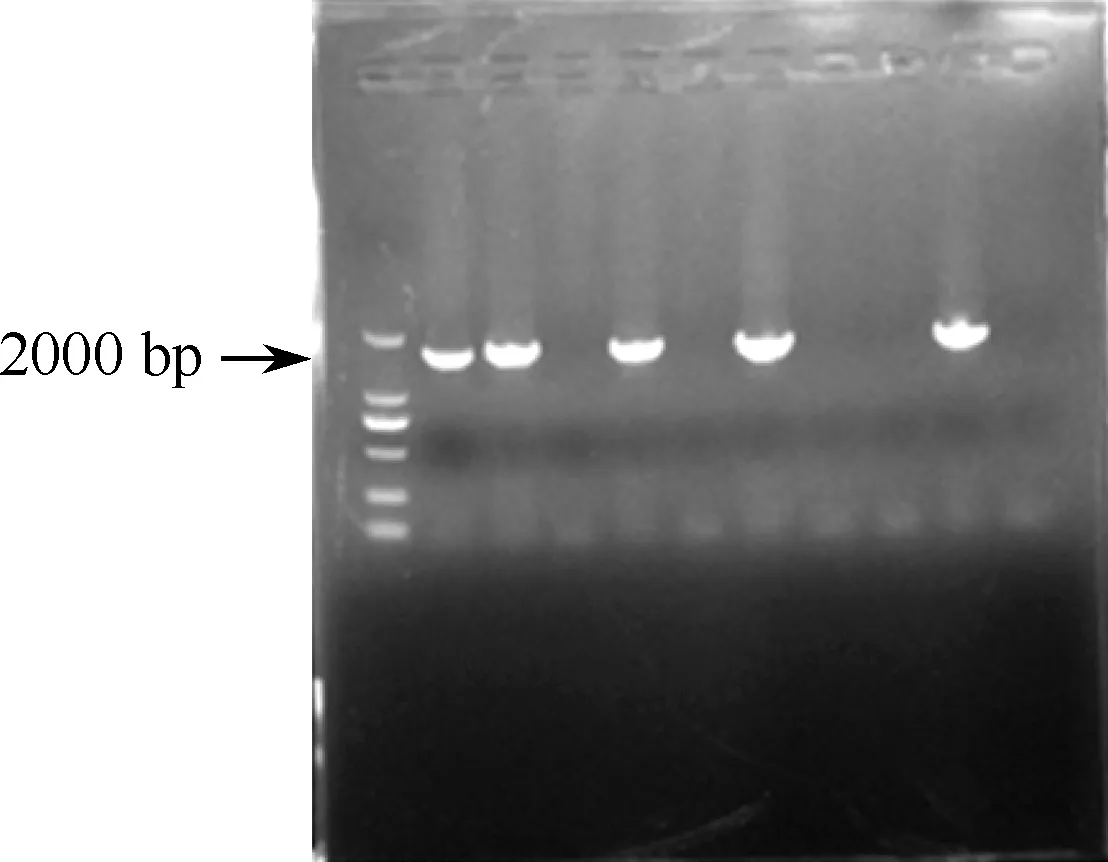
图2 目的片段约1700 bp,菌液PCR鉴定TA克隆结果,将阳性克隆测序
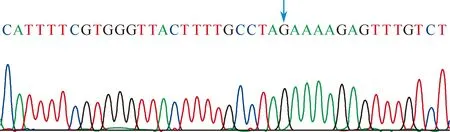
图3 阳性克隆测序图谱,箭头所指为rs3840880位点等位基因G
三、定点突变结果
使用StarMut Site-directed Mutagenesis Kit 基因定点突变试剂盒,将选取标本在rs3840880位点的G定点突变为D放散型(DEL)。采用甲基化的质粒DNA为模板,使用人工合成含有目的突变碱基的引物进行扩增反应,然后用DpnI限制性内切酶消化不含突变的质粒模板,得到pGL3-rs3840880DEL质粒,转化后筛选阳性克隆并测序验证, 与预期结果相符(图4)。
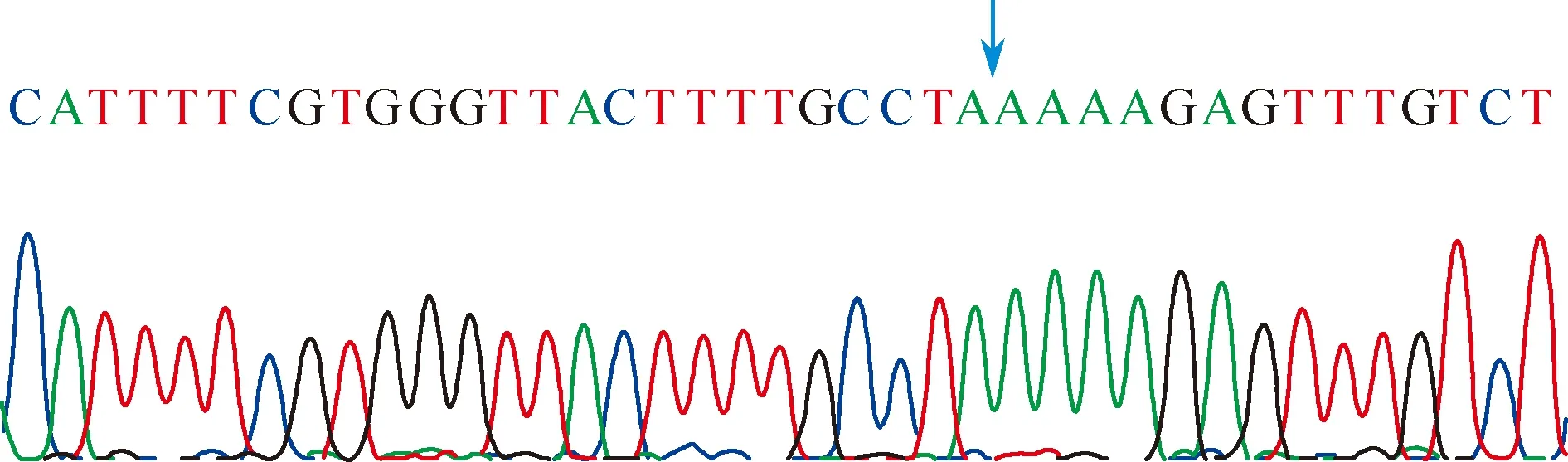
图4 阳性克隆测序图谱,箭头所指为rs3840880位点定点突变结果为等位基因DEL
四、双荧光素表达系统结果
使用Dual-Glo®luciferase assay system试剂盒,根据荧光信号强度检测转染后的Hela细胞中pGL3-Basic质粒表达的情况。将转染有突变后基因的Hela细胞和转染有未突变基因的Hela细胞与空白对照组的Hela细胞消化后,用PBS清洗打匀,分别取75 μl加入到已经加入Dual-Glo®luciferase reagent的对应的白板孔中混匀,15 min后萤火虫荧光素酶催化相应底物产生荧光(R)。随后加入海肾荧光素酶底物,检测荧光值(F),笔者取2次荧光比值(F/R)作为基因表达的参考(图5),以海肾荧光作为内参来校正细胞状态、检测环境等对结果测定的影响。由图5看出,ALOX-12基因不同功能的SNP对启动子活性的影响明显不同,pGL3-Basic质粒F/R=0.129,pGL3-rs3840880DEL质粒F/R=0.194,pGL3-rs3840880DEL质粒F/R=0.274,采用单因素方差分析,F=25.09,P=0.001,差异有统计学意义。
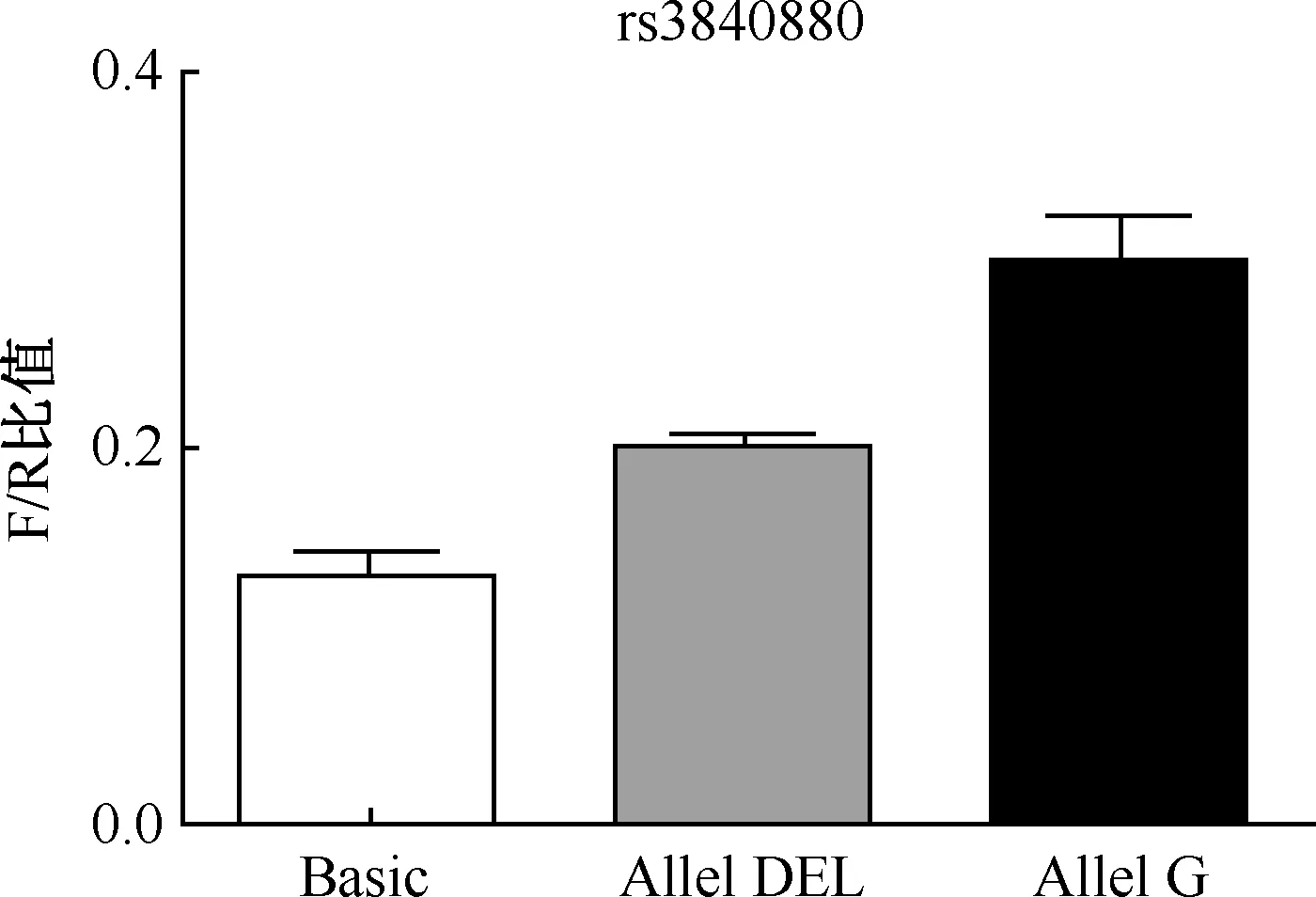
图5 Basic为转染空载体的荧光检测结果;Allel DEL与Allel G分别为转染pGL3-rs3840880DEL和pGL3-rs3840880G质粒的荧光检测结果
讨 论
花生四烯酸是广泛存在细胞膜磷脂双分子层中的不饱和脂肪酸,当细胞受到不同生长因子、细胞因子等生理性或者病理性的刺激后,在磷脂酶A2的作用下花生四烯酸变为游离状态并在环氧合酶(cyclooxygenase,COX)、LOX的催化下生成相应的代谢产物。LOX家族的成员众多并且催化AA为炎症介质白细胞三烯(leukotriene,LTs)和HETE[7]。LOX基因亚型具有物种和组织特异性,除了在血小板内能直接催化AA产生12-HETE以外,ALOX-12还可以催化中性粒细胞代谢产生脂氧素[8]。结核保护性免疫的产生既受宿主因素的调节,反映在不同个体在发生结核分枝杆菌感染后的免疫应答反应明显不同,而在不同人群中对卡介苗的免疫保护效果也明显不同;同样,保护性免疫也受感染的结核分枝杆菌的影响,反映在不同毒力的菌株和用不同的细菌量诱导产生的免疫应答反应不同。目前,与结核病密切相关基因的SNP的研究主要包括:模式识别受体类分子、干扰素家族及其相关基因、促炎细胞因子、抑炎细胞因子、趋化因子家族等五类,其中对于SNP趋化因子家族的研究与本研究有着密切的关系[9]。
本研究所针对的ALOX-12基因功能性SNPs位点rs3840880采用病例-对照策略发现。通过定点突变,笔者获得了带有rs3840880位点不同等位基因的荧光素表达载体,在前期统计学的基础上研究功能性SNPs调控宿主的结核病易感机制。双荧光素表达系统能反映出ALOX-12基因启动子的表达情况,不但用荧光内参减少了细胞、操作环境变化对实验结果的影响,而且使用荧光比值更清晰准确地对比出实验结果的变化。本实验所取得的成果将进一步地揭示结核病发生发展的精确分子和免疫机制,为结核病易感人群的预防干预决策及结核病基因型特异性个体化治疗提供一定理论依据。但是,由于ALOX-12基因的组织特异性,并且结核病是受多种因素影响发病的一种感染性疾病,因此关于结核病更全面的发病研究与临床治疗方案有待进一步探索。
[1] 陈伟,夏愔愔,成诗明. 结核病疫情及对策. 中国防痨杂志,2012,34(9):611-613.
[2] Zumla A, Raviglione M, Hafner R, et al. Tuberculosis. N Engl J Med, 2013, 368(8):745-755.
[3] O’Garra A, Redford PS, McNab FW, et al. The immune response in tuberculosis. Annu Rev Immunol, 2013, 31:475-527.
[4] Yoshimoto T, Takahashi Y. Arachidonate 12-lipoxygenases. Prostaglandins Other Lipid Mediat, 2002, 68/69:245-262.
[5] Shen C, Wu XR, Wang BB, et al. ALOX5 is associated with tuberculosis in a subset of the pediatric population of North China. Genet Test Mol Biomarkers, 2013, 17(4):284-288.
[6] Tobin DM, Roca FJ, Oh SF, et al. Host genotype-specific therapies can optimize the inflammatory response to mycobacterial infections. Cell, 2012, 148(3):434-446.
[7] Xu R, Wang S, Li W, et al. Activation of peroxisome proliferator-activated receptor-γ by a 12/15-lipoxygenase product of arachidonic acid: a possible neuroprotective effect in the brain after experimental intracerebral hemorrhage. J Neurosurg, 2016, 14:1-10. [Epub ahead of print].
[8] Pabst T, Kortz L, Fiedler GM, et al. The plasma lipidome in acute myeloid leukemia at diagnosis in relation to clinical disease features. BBA Clin, 2017, 7:105-114.
[9] Caws M, Thwaites G, Dunstan S, et al. The influence of host and bacterial genotype on the development of disseminated disease withMycobacteriumtuberculosis. PLoS Pathog, 2008, 4(3): e1000034.
(本文编辑:薛爱华)
Molecular mechanism of functional single nucleotide polymorphisms regulated tuberculosis susceptibility
ZHUXiu-yun,WANGWen-fei,ZHANGPei-ze,ZHANGJie-yun,QIUZhi-hui,WANGZhao-qin,ZHANGMing-xia,DENGGuo-fang.
LungDiseaseMedicalCenter,ThirdPeople’sHospitalofShenzhen,GuangdongKeyLaboratoryforEmergingInfectiousDisease,Shenzhen518112,China
DENGGuo-fang,Email:jxxk1035@yeah.net
Objective To construct different genotype dual luciferase expression plasmid expressed the rs3840880 loci of promoter region located in arachidonic acid lipoxidase-12 (ALOX-12) gene, and to analyze the effects of this single nucleotide polymorphisms (SNP) onALOX-12 gene promoter activity and gene expression, in order to elucidate the molecular mechanism of functional SNP regulated tuberculosis susceptibility. Methods The 1700 bp fragments contained rs2840880 loci of promoter region located inALOX-12 gene were amplified with human genome DNA extracted from whole blood samples by PCR. The pGL3-Basic-rs3840880 DEL plasmids was obtained from pGL3-Basic plasmid constructed with the PCR products and the original plasmid by site-directed mutagenesis and transfected into human cervical carcinoma cell line(Hela). The relative fluorescence values were detected by the dual luciferase assay system. Results The pGL3-Basic-DEL plasmid from pGL3-Basic-G plasmid containing the rs3840880 loci of promoter region located in theALOX-12 gene by site-directed mutagenesis was obtained and sequenced successfully. The relative fluorescence ratio (F/R) were detected after two plasmids were transfected into Hela cell line. The fluorescence ratio of allele G (F/R=0.194) was lower than that of allele DEL (F/R=0.274), pGL3-Basic (F/R=0.129) with significant difference statistically (F=25.09,P=0.001). Conclusion The expression differences of fluorescence reporter gene in the plasmids constructed with different alleles and transfected into Hela cell line are significant statistically. It shows that functional SNP of ALOX-12 gene affect really the activity of promoter and regulate tuberculosis susceptibility.
Arachidonate 12-lipoxygenase; Polymorphism, single nucleotide; Fluorophotometry; Tuberculosis; Gene expression regulation, bacterial
10.3969/j.issn.1000-6621.2017.08.004
国家自然科学基金(81500004);广东省自然科学基金(2015A030313692);深圳市科技计划项目(JCYJ20160427152106244, JCYJ20160427153348709, JCYJ20150402111430658);深圳市卫生计生系统科研项目(201501029)
518112 深圳市第三人民医院肺病医学中心 广东省新发传染病诊治重点实验室
邓国防,Email:jxxk1035@yeah.net
2017-06-19)
——一道江苏高考题的奥秘解读和拓展

