采用罗氏培养基进行MTB药物敏感性试验的影响因素分析
姜广路 戴广明 黄海荣
·论著·
采用罗氏培养基进行MTB药物敏感性试验的影响因素分析
姜广路 戴广明 黄海荣
目的 评价基于罗氏培养基绝对浓度法的结核分枝杆菌药物敏感性试验(简称“药敏试验”)检测异烟肼、利福平、乙胺丁醇的药物浓度标准,以及不同接种菌量、接种方式对耐药性检测结果的影响。方法 按照世界卫生组织推荐方法从可能敏感患者和可能耐药患者痰液样本中的分离菌株,分别测定两类菌株对异烟肼、利福平、乙胺丁醇的最低抑菌浓度(MIC)并计算累计百分比,以两类菌株累计百分比差值最大的MIC确定耐药界限;分别将菌量为10-3mg和10-4mg的结核分枝杆菌,接种于比例法耐药界限的3种药物含药培养基,经4周孵育后比较耐药结果;比较接种量均为10-6mg菌量的两种接种方法(接种环和滴管接种)孵育4周后菌落形成单位(CFU)的数量差异。 结果 异烟肼、利福平和乙胺丁醇经绝对浓度法测定的浓度界限分别为0.2 μg/ml、40 μg/ml、2 μg/ml;不同接种量(10-3mg与10-4mg)接种相同含药培养基,其药敏试验结果差异无统计学意义(χ2值分别为0.57、0.00、0.00,P值分别为0.45、1.00、1.00);使用接种环接种菌悬液的菌落形成单位数[(40.60±34.54)个,95%CI=35.08~46.12个]明显多于使用滴管的菌落形成单位数[(11.27±11.11)个,95%CI=9.50~13.05个](t=11.58,P<0.01)。 结论 异烟肼、利福平、乙胺丁醇的耐药界限采用比例法药物浓度界限更适宜;接种菌量10-3mg和10-4mg对药敏试验结果无明显影响;接种环接种效果较滴管接种效果好。
分枝杆菌, 结核; 微生物敏感性试验; 培养基, 无血清; 诊断技术和方法; 结果与过程评价(卫生保健); 因素分析, 统计学
耐药结核病是全球关注的严重公共卫生问题。据世界卫生组织(WHO)2016年结核病疫情报告估算,全球结核病疫情较以往估算更为严重。耐多药结核病(MDR-TB)患者绝对数最多的前3个国家分别是印度、中国、俄罗斯联邦[1-2],耐药结核病仍是结核病控制的重大挑战之一。高质量的结核分枝杆菌药物敏感性试验(简称“药敏试验”),对耐药结核病的控制至关重要。综合考虑成本和可操作性等诸多因素,基于罗氏培养基的传统药敏试验短期内仍不能被完全替代。目前我国的结核病细菌学检测指南、检验规程将绝对浓度法和比例法同时作为标准方法[3-4],但在实际工作中,这两种方法的耐药检测结果有一定差异,曾经有学者对两种方法的接种菌量、细菌菌悬液的制备、出现差异的菌株最低抑菌浓度(MIC)等方面进行了研究[5-9],各个研究的结论不尽相同[10-11];尤其对于两种方法耐药结果不一致时,如何确定结果的问题仍没有明确解决。本研究基于对结核分枝杆菌耐药检测指南发展历程的回顾[12-13],按照世界卫生组织(WHO)[14]及其他文献推荐的方法[15],根据两种方法的不同之处,及患者抗结核药物治疗史选取符合研究目的的结核分枝杆菌菌株,测定异烟肼、利福平、乙胺丁醇的绝对浓度法耐药浓度界限,并对接种量和接种方式(接种环接种和吸管滴加)等因素进行分析, 以期为结束两种方法并行,形成统一的检测方法和标准提供参考。
材料和方法
一、材料
1.菌株:依据研究目的不同,选取不同来源的菌株。所有结核分枝杆菌临床分离株均经过对硝基苯甲酸鉴别培养基(PNB)鉴定为结核分枝杆菌复合群。(1)测定耐药浓度界限的菌株:①可能敏感的结核分枝杆菌菌株(PS)。来自2007年全国结核病耐药基线调查时未进行抗结核药物治疗的新登记肺结核患者的分离菌株,共100株。②可能耐药的结核分枝杆菌菌株(PR)。来自中国全球基金耐药结核病控制项目湖北肺结核治疗失败患者分离株,以及北京胸科医院肺结核患者经异烟肼、利福平、乙胺丁醇治疗不少于6个月的临床分离株,共计对异烟肼、利福平的可能耐药菌株各100株,对乙胺丁醇的可能耐药菌株73株。可能敏感的结核分枝杆菌菌株和可能耐药的结核分枝杆菌菌株用于药敏试验含药培养基浓度标准测定,菌株数量符合WHO规定[14]的可能敏感的菌株不少于100株,可能耐药的菌株不少于50株的规定。(2)用于药敏试验接种菌量的研究菌株:来自2007年全国结核病耐药基线调查菌株515株,用于药敏试验接种菌量的研究菌株。(3)用于药敏试验接种方法研究的菌株:北京胸科医院肺结核患者分离株160株。(4)结核分枝杆菌标准株:H37Rv(ATCC27294),来自国家结核病参比实验室。
2.抗结核药物:药物纯粉来自Sigma公司,异烟肼批号为115K0675,乙胺丁醇批号为28H1266,利福平批号为058K1405。
3.培养基:参照《结核病诊断细菌学检验规程》[16]规定配制空白罗氏培养基和相应浓度含药罗氏培养基。
4. 22SWG标准接种环:一环接种液体体积约10 μl[4],由国家结核病参比实验室提供。
5.耐药性分子检测试剂:结核分枝杆菌rpoB基因和突变检测试剂盒(实时荧光PCR法,Cepheid 公司生产;批次:1000039249)。结核分枝杆菌异烟肼耐药突变检测试剂盒(荧光PCR熔解曲线法,厦门致善生物科技股份有限公司出品;批号:17010301)。
二、研究方法
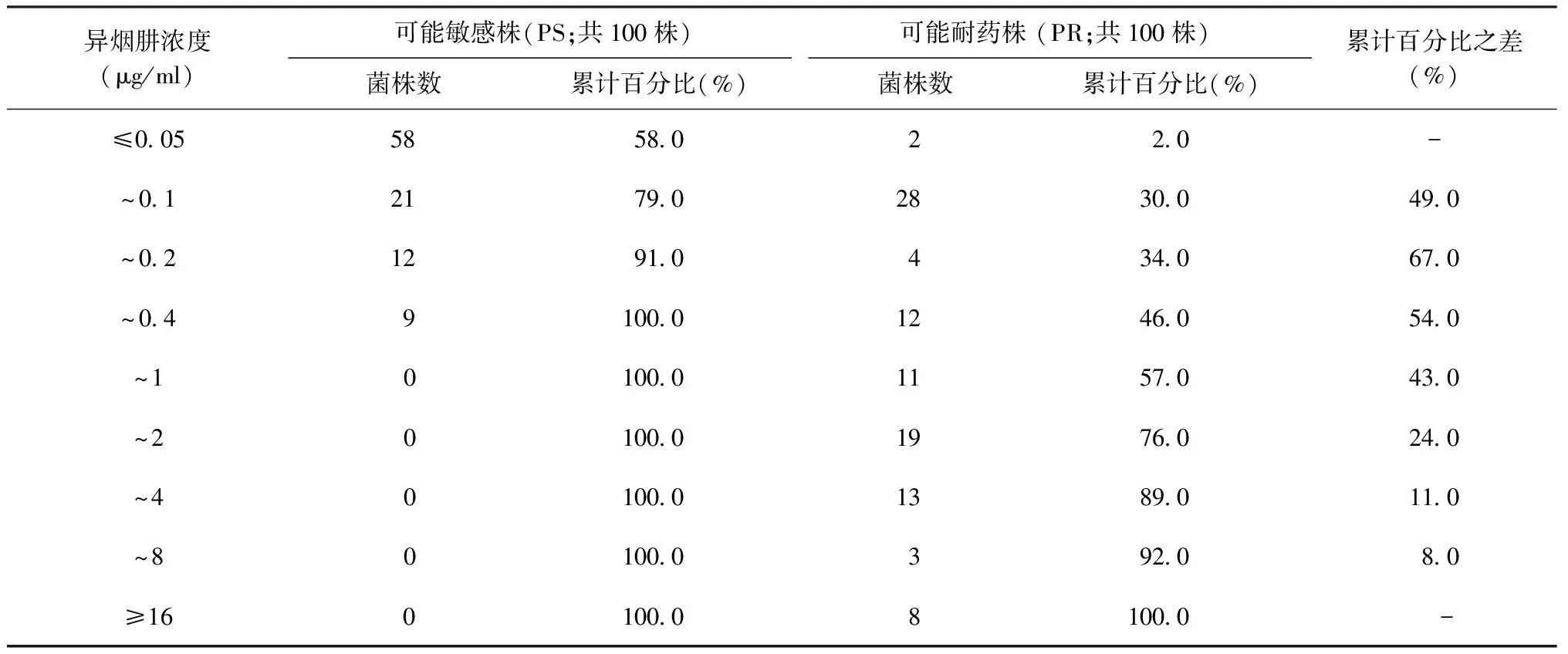
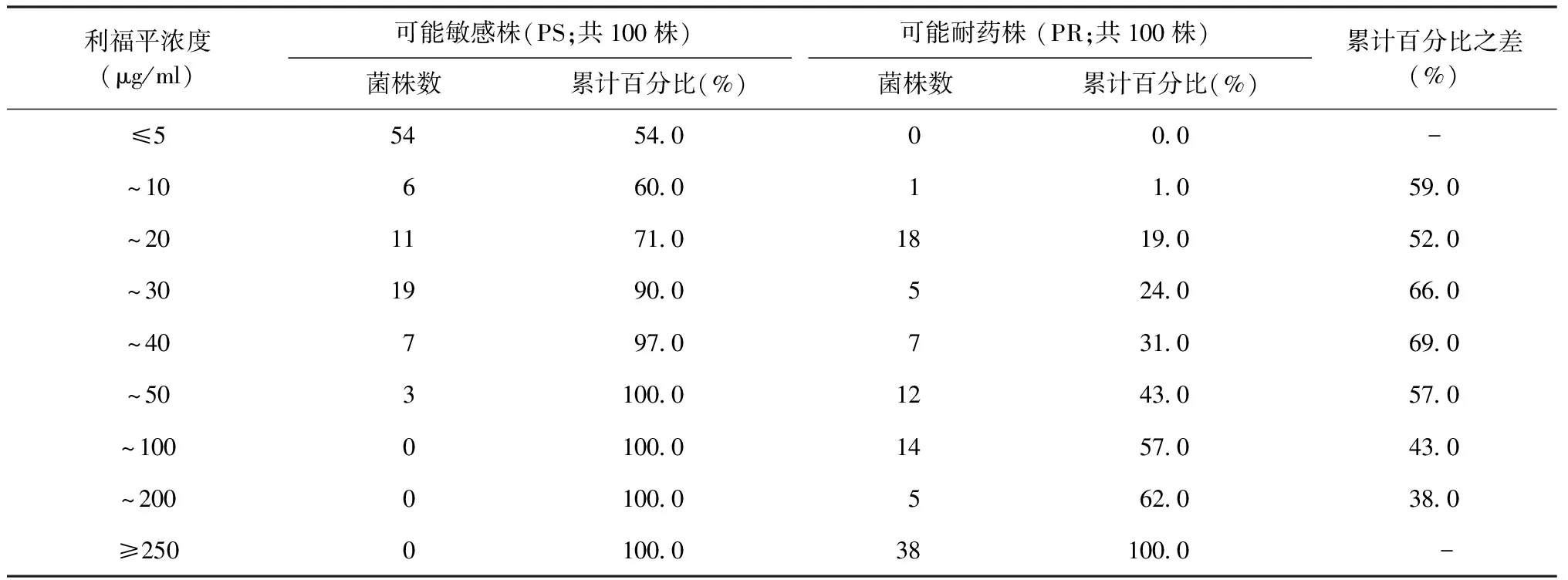
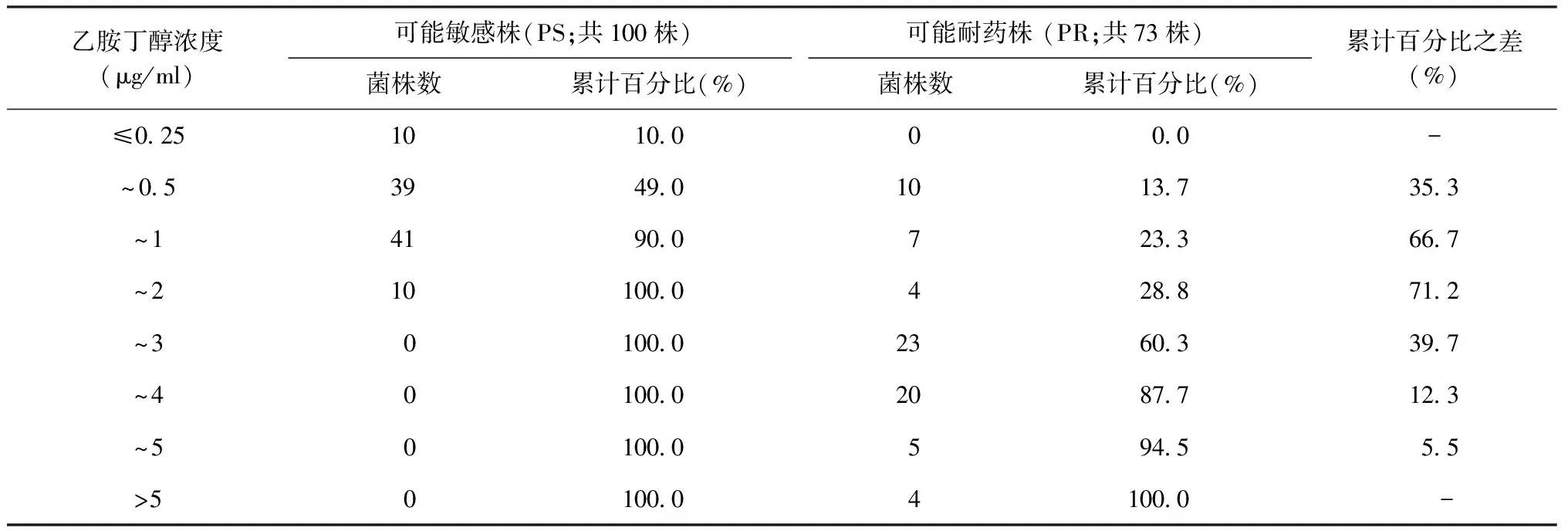
1.绝对浓度法药敏试验耐药界限测定:综合现行的比例法和绝对浓度法药敏试验方法的浓度界限,制备一系列不同浓度的含药培养基,以测定药物的MIC。异烟肼终浓度分别为:0.05、0.1、0.2、0.4、1、2、4、8、16 μg/ml;利福平终浓度分别为5、10、20、40、80、100、200、250 μg/ml;乙胺丁醇终浓度为0.25、0.5、1、2、3、4、5 μg/ml。
2.菌悬液制备及接种:将试验菌株转种至空白罗氏培养基,36~37 ℃培养至约3~4周,制备1麦氏浊度(相当于1 mg/ml菌悬液浊度)的菌悬液,经2次10倍稀释成10-2mg/ml,以滴管取0.1 ml分别滴加至空白培养基和含药培养基,在36~37 ℃下进行孵育,孵育4周后报告结果。在对照培养基上细菌生长旺盛的前提下,以抑制99%结核分枝杆菌生长的最低药物浓度作为该试验的菌株MIC。
3.耐药界限确定:分别统计可能敏感菌和可能耐药菌的MIC累计百分比,将累计百分比之差(可能敏感菌和可能耐药菌累计百分比相减的差值)最大的MIC确定为耐药浓度界限。
4.耐药验证:取利福平40 μg/ml 5.两种检测方法不同接种量标准检测耐药性比较:比较含药培养基药物浓度相同而接种量不同的药敏试验结果。按照比例法标准制备的异烟肼(0.2 μg/ml)、乙胺丁醇(2 μg/ml)、利福平(40 μg/ml)含药培养基。取2007年全国结核病耐药性基线调查的结核分枝杆菌菌株515株,按照目前国内规程绝对浓度法接种量[制备1麦氏浊度(1 mg/ml)的菌悬液,逐步10倍稀释制备成10-2mg/ml],以滴管滴加0.1 ml接种于空白培养基和含药培养基上,经36~37 ℃孵育,4周后报告结果;同时按照比例法药敏试验方法[接种菌量(10-2mg/ml)]操作,以接种环的方式接种0.01 ml测定该细菌的耐药性,将两种方法的结果相比较,结果采用配对资料McNemar 检验。 6.接种方式比较:比较接种量均为10-6mg菌量的两种接种方法菌落生成单位(CFU)的数量差异。临床分离结核分枝杆菌菌株160株,制备1麦氏浊度的菌悬液,逐步10倍稀释为10-4mg/ml和10-5mg/ml浓度的菌悬液,使用微量移液器取10-4mg/ml 菌悬液10 μl,接种至2支罗氏培养基后,再以接种环划线涂匀;另取2支罗氏培养基,使用无菌吸管吸取10-5mg/ml菌悬液滴加0.1 ml至罗氏培养基,置于斜面架上,保持培养基斜面水平;将以上两种接种方式接种的培养基置于同一恒温培养箱孵育。经36~37 ℃孵育4周后观察菌落生成数量的差异。 三、统计学分析 应用SPSS 19.0软件进行统计学数据分析,两种检测方法不同药物浓度在相同培养基上检测的耐药性比较采用配对资料McNemar检验,以P<0.05为差异有统计学意义。 1.药敏试验在相同含药培养基的浓度界限测定:异烟肼、利福平、乙胺丁醇的MIC测定结果分别为:异烟肼0.2 μg/ml、利福平40 μg/ml、乙胺丁醇2 μg/ml。详见表1~3。检测结果与绝对药物法的MIC标准相同。 表1 异烟肼最低抑菌浓度分布 注 MIC累计百分比为(该浓度菌株数+以上所有浓度菌株数)/菌株总数;MIC累计百分比之差为可能敏感菌和可能耐药菌累计百分比相减的差值;“-”表示本研究对低于0.05 μg/ml或高于16 μg/ml的 MIC检测浓度未进行检测,故未计算差值 表2 利福平最低抑菌浓度分布 注 MIC累计百分比为(该浓度菌株数+以上所有浓度菌株数)/菌株总数;MIC累计百分比之差为可能敏感菌和可能耐药菌累计百分比相减的差值;“-”表示本研究对低于5 μg/ml或高于250 μg/ml的MIC检测浓度未进行检测,故未计算差值 表3 乙胺丁醇最低抑菌浓度分布 注 MIC累计百分比为(该浓度菌株数+以上所有浓度菌株数)/菌株总数;MIC累计百分比之差为可能敏感菌和可能耐药菌累计百分比相减的差值;“-”表示本研究对低于0.25 μg/ml或高于5 μg/ml的 MIC检测浓度未进行检测,故未计算差值 2.耐药基因突变验证结果:利福平40 μg/ml 3.不同接种量结果比较:本研究仅对绝对浓度法和比例法的差异是否有统计学意义进行统计学处理,采用配对资料McNemar检验,差异均无统计学意义(P值均>0.05)(表4)。 4. 不同接种方法菌落计数:因菌落融合不能计数等原因,160对已接种细菌的罗氏培养基中,可统计菌落数量的培养基为153对。滴管接种法菌落均数为(11.27±11.11)个 (95%CI:9.50~13.05个),划线接种法菌落均数为(40.60±34.54)个(95%CI:35.08~46.12个),两种接种方法菌落生成单位数量差异有统计学意义(t=11.58,P<0.01)。 一、异烟肼、利福平和乙胺丁醇绝对浓度法药敏试验含药培养基浓度标准界定 (一)国外绝对浓度法和比例法发展概述 1963年WHO公报提出结核分枝杆菌药敏试验方法,包括Gertrud Meissner提出的绝对浓度法和Canetii提出的比例法[17]。绝对浓度法检测的药物包括异烟肼、链霉素、对氨基水杨酸,其中异烟肼浓度为0.2 μg/ml和1 μg/ml,含药罗氏培养基制备时仅凝固1次,制备1麦氏浊度的菌悬液,稀释50倍,以10 μl接种环分别接种于空白培养基和含药培养基各1环,接种菌量为2×10-4mg,约为2000~10 000个细菌。待结果报告时,含药培养基生长菌落超过20个为耐药,判读标准实质是耐药菌数量超过全部菌最低数量的1%即为耐药。Canetti等提出的比例法,检测药物包括异烟肼、链霉素、对氨基水杨酸,其中异烟肼浓度为0.2 μg/ml和1 μg/ml,制备10-3mg/ml和10-5mg/ml菌悬液,分别取0.2 ml接种至空白培养基和含药培养基,至结果报告时,含药培养基菌落数≥1%即为耐药。由此可见,绝对浓度法与比例法创始之初,两种方法理论基础相同,耐药临界浓度和接种量均相同或相近。这些方法实践基础与1963年在东部非洲医院的结核病患者异烟肼治疗与实验室结果比对的研究[17]有密切的关系,其研究发现患者治疗后培养阴转情况与耐受0.2 μg/ml异烟肼的结核分枝杆菌所占的比率相关性最好,而与耐受1 μg/ml、5 μg/ml、50 μg/ml的所占比率相关性很差;特别值得注意的是,文献[17]着重说明,疗效与结核分枝杆菌的MIC无明显的相关性。 至1969年,WHO公报中进一步明确异烟肼浓度为0.2 μg/ml,利福平为40 μg/ml,乙胺丁醇为2 μg/ml[14],并规定了结核分枝杆菌药敏试验耐药浓度界限的方法,其规定为选取可能敏感的菌株不少于100株,可能耐药的菌株不少于50株,对这些菌株进行MIC测定并统计累计百分比,将累计百分比差别最大的最低抑菌浓度作为耐药界限。1997年World Health Organization与International Union Against Tuberculosis and Lung Disease[19]公布的Globalworkinggrouponantituberculosisdrugresistancesurveillance1guidelineforsurveillanceofdrugresistanceintuberculosis中提及的药敏试验方法及其耐药浓度界限仍保持与1963年、1969年WHO公报的耐药界限一致。 (二)国内绝对浓度法发展概述 我国最初的结核病细菌学检验规程规定的药敏试验方法在1963年颁布[20]。其方法规定罗氏培养基制备时需凝固2次,检测药物包括异烟肼、链霉素、对氨基水杨酸,异烟肼浓度分别为0.1、1、10 μg/ml,接种量为0.1 mg,即相当于1麦氏浊度的菌悬液0.1 ml分别接种至空白培养基和含药培养基上;含药培养基菌落少于10个菌落不报告,需重复试验;大于10个则记录该浓度并报告该浓度,该方法重点强调耐药标准待与临床结果比对后再确定;由此可知,国内绝对浓度法创立最初其实质是简化的MIC测定,并没有规定耐药标准。1963—1980年诸多学者对结核分枝杆菌药敏试验进行了研究[21-23],但耐药菌株均分离自临床治疗过的患者,并未严格来自治疗失败或治疗6个月以上的结核病患者;制备罗氏培养基时仍然凝固2次。1980年《抗结核药物耐药性测定暂行规定》颁布[24],含药培养基中浓度分别为异烟肼1 μg/ml和10 μg/ml、乙胺丁醇5 μg/ml和50 μg/ml,以及利福平5、10和250 μg/ml,罗氏培养基制备时需凝固2次。在1996年刊登在《中国防痨杂志》的《结核病诊断细菌学检验规程》[16]中,将罗氏培养基凝固次数由2次改为1次,但药物浓度并未进行相应调整。2006年出版的《结核病诊断实验室检验规程》同时将比例法和绝对浓度法列出[3],绝对浓度法中链霉素不再使用加倍量。基于以上发展历程,国内的绝对浓度法与世界卫生组织公告中报道的绝对浓度法、比例法均不相同,在培养基制备过程、接种步骤、结果判读等方面有很大差异,必然导致检测结果存在差异。 (三)国内学者对两种方法的比较研究 丁北川等[7]按照WHO规定的绝对浓度法进行药敏试验,结果与比例法差异无统计学意义。刘宇红等[10]研究表明,比例法和国内绝对浓度法结果差异有统计学意义的药物是异烟肼、乙胺丁醇,而浓度界限接近的利福平则差异无统计学意义,有差异的菌株MIC均在比例法和绝对浓度法浓度界限之间。也说明了两种药敏方法结果有差异的主要原因是耐药界限。刘宇红等[11]采用2000年全国结核病流行病学抽样调查分离的结核分枝杆菌菌株进行两种方法的检测比较,结果显示异烟肼和利福平差异无统计学意义,乙胺丁醇差异有统计学意义;也提示了诸多学者的研究结果比较不尽相同的原因,即在研究的所有结核分枝杆菌菌株中,两种方法检测的结核分枝杆菌菌株MIC介于比例法和国内绝对浓度法耐药界限之间的构成比率的差异有统计学意义。因此,不严格界定患者的用药史,难以获得稳定的比较结果,也难以确定耐药浓度界限。 (四)本研究测定的耐药界限及讨论 本研究根据WHO规定,严格依据治疗史纳入试验菌株(可能敏感菌株来自未治疗的患者,可能耐药菌株来自治疗失败的患者),且样本量不少于WHO规定标准。结果显示异烟肼、利福平、乙胺丁醇的罗氏培养基耐药界限与比例法耐药界限一致,经检测对利福平和异烟肼耐药基因突变的结核分枝杆菌,其MIC介于比例法和国内绝对浓度法耐药界限之间,多数明确存在与表型耐药相关的耐药基因突变。 虽然近年很多学者对耐药结核病影响因素进行了大量研究,有学者提出传播是结核分枝杆菌耐药的主要原因[25],这种结论是将初治和复治耐药菌株合并分析所得的结果,更倾向于耐药流行的影响因素研究。而本研究根据治疗史将菌株进行分类并测定MIC,是基于结核分枝杆菌耐药的产生原因进行分析。也有学者基于2007年全国结核病耐药基线调查,将初治和复治患者分别分析,认为初治患者接受过小于1个月的治疗,以及复治患者接受多次治疗是耐药的危险因素[26-27],说明结核病经过抗结核药物治疗,尤其是多次治疗是耐药产生的影响因素。 国内沿用绝对浓度法作为诊断和治疗参考由来已久,尤其习惯于绝对浓度法设立高低两个浓度,可以得到低浓度耐药和高浓度耐药结果,甚至在可选药物很少的情况下,低浓度耐药可为继续使用该药物提供某种程度的实验室“参考”依据。但需要注意的是,根据现有的WHO指南,同一种药物,通过调整剂量作为某种程度的“新药”使用的只有异烟肼,而且不是推荐的优先选择。其理论基础是结核分枝杆菌不同的异烟肼基因突变导致异烟肼耐药程度的不同,inhA基因突变可耐受0.2 μg/ml的异烟肼,katG基因突变导致结核分枝杆菌耐受1 μg/ml的异烟肼[28]。而国内的绝对浓度法测定的异烟肼浓度分别为1 μg/ml和10 μg/ml,因此国内的绝对浓度法低浓度耐药难以作为继续使用异烟肼的实验室依据。另外,近年来,高剂量利福平临床实验较多,其目的是在药物不良反应增加不明显的前提下,将利福平用量从10 mg/kg提高至15 mg/kg甚至20 mg/kg,从而提高初治结核病患者的治愈率[29-31]。这种方法是将利福平作为一种药物一种剂量使用,并非依据结核分枝杆菌对利福平不同耐药程度选择不同剂量。本研究虽然设定单一浓度界限,但并不反对从科研角度研究其他浓度界限和不同突变位点的关系[32],但如上文1963年针对结核病患者异烟肼治疗结果的研究报道,耐药程度(实验室具体表现为MIC)与疗效无明显相关性[18]。针对临床治疗而言,确定单一的耐药界限后,进而关注超过这一界限的结核分枝杆菌菌株的比率,可能对治疗有更多参考价值。 耐药菌的定义包含了耐药菌的两个关键属性[16,33],即临床治疗反应性下降和明显不同于接触过药物的野生菌株,其发现过程为在临床治疗中发现疗效下降的菌株,经实验室检测发现与未用过药物菌株的差异,通过实验室检测这种差异从而为临床治疗提供参考。提示耐药菌与敏感菌的临床疗效和实验室检测结果明显不同,有必要定期对治疗失败和未治疗的患者菌株进行实验室检测分析,因为经过长期的治疗,这种源自临床的耐药界限可能存在一定程度的变化;如果结核病控制比较好,未治疗患者的耐药率可能会降低,反之则升高,这两种状况均会影响耐药浓度界限的确定。 此外,虽然本研究的结果表明培养基药物浓度界限与比例法测定相同,但数据表明利福平30 μg/ml和40 μg/ml差别很小。Laszlo等[34]在1997年发表的第1次全球结核病网络实验室结核分枝杆菌药敏试验实验室间的质量评价,曾提出利福平在30 μg/ml和40 μg/ml可能差异无统计学意义。采用德国标准(DIN)方案的测试结果有望证实这一结果,其利福平的临界浓度是32 μg/ml。 有学者对耐药的定义提出了质疑,即质疑传统表型药敏试验结果不能完全与临床治疗结果一致,认为将复杂的临床疗效归因于细菌耐药存在一定局限,忽略了人体药物代谢和免疫作用的因素[33]。同时Gumbo[35]根据药代动力学和药效学提出药敏试验的临界浓度应进一步降低。但就目前研究状况而言,难以将细菌抗药性、药物代谢、人体免疫状况等因素进行整合后再全面评价临床疗效。仅通过细菌学方法进行的耐药性检测也仅仅可以检测细菌的属性,故目前当务之急是规范和标准化药敏试验,以便将来整合其他影响因素来评价疗效。 二、接种量对结果的影响 研究结果显示,药物浓度界限采用比例法但接种量采用绝对浓度法的细菌量(菌液质量浓度10-2mg/ml,接种0.1 ml,接种量为10-3mg),其药敏试验结果与标准比例法的结果(菌液质量浓度10-2mg/ml,接种0.01 ml,接种菌量为10-4mg)差异无统计学意义,与黎友伦等[8]的研究结果相同。其原因可能是无论哪一种接种菌量(1 mg湿菌细菌数量相当于107数量级,10-3mg、10-4mg的细菌数量分别为104、103),均远低于耐药自然突变率(结核分枝杆菌的异烟肼、利福平、乙胺丁醇自然突变率为每106、108、105个细菌检出一个自然耐药突变),提示接种量对两种接种方法药敏试验结果无明显影响。 三、接种方式的差异 本研究结果提示,使用接种环以涂抹方式接种(划线接种法)的菌落数明显多于滴管法,原因可能是使用滴管滴加方式可使一次滴加菌液较多(0.1 ml 或100 μl),尽管保持培养基斜面水平放置,但由于结核分枝杆菌表面脂质较多,疏水性较强,在菌悬液中结核分枝杆菌更易聚集而不易分开,导致生成的菌落数较少;而经接种环取少量菌悬液(10 μl)划线接种,液体成分较少,经接种环划线后,结核分枝杆菌直接与培养基斜面接触,不易再聚集,故菌落较多。 本研究结果显示,虽然滴管接种法菌落均数的标准差[(11.27±11.11)个]较小,但根据95%CI绝大多数滴管法的菌落在9.50~13.05个之间,而绝大多数划线接种法菌落数在35.08~46.12个之间;故可认为在多数情况下,针对同一菌悬液,使用划线接种较滴管法接种效果好。 综上,比例法和绝对浓度法是基于MIC的药敏试验方法,两种方法仅在接种方法和判读方式等方面有所不同,不宜将这两种方法对立看待,绝对浓度法可以看作是在接种量精确定量前提下的比例法。比例法从理论的角度相对严谨,绝对浓度法在操作方面相对简易,只需将目前国内《结核病细菌学检验规程》中绝对浓度法的药物耐药界限调整为与比例法药物浓度界限一致, 则无论采用哪种方法检测耐药性,其结果均具有较高的一致性和可比性,有助于解决某些菌株检测结果不一致的问题。此外,使用接种环以涂抹方式接种菌液,较滴管法能获得相对较多的菌落数,有助于进行菌落计数。已有学者对其他影响因素(如含药培养基中药物含量及保存时间等)进行了研究,总体结论是含药培养基中药物处于持续衰减状态,含药培养基保存不要超过1个月[36-38],其结论与目前国内外的相关指南[3-4]基本一致。关于测定其他抗结核药物的浓度界限及影响因素还有待进一步研究。 志谢 湖北省疾病预防控制中心传染病防治研究所李国明及周丽平两位老师给予了本研究倾力帮助和支持。 [1] World Health Organization. Global tuberculosis report 2016. Geneva: World Health Organization, 2016. [2] World Health Organization. Global tuberculosis report 2015. Geneva: World Health Organization, 2015. [3] 中国防痨协会基础专业委员会. 结核病诊断实验室检验规程. 北京:中国文化教育出版社, 2006. [4] 赵雁林,王黎霞,成诗明,等.结核分枝杆菌药物敏感性试验标准化操作程序及质量保证手册.北京:人民卫生出版社,2013. [5] 陈裕,刘建民,张华伟, 等. 比例法和绝对浓度法对结核分支杆菌药物敏感性测定的对比研究. 河南预防医学杂志, 2001, 12(1):6-8. [6] 杨立涛,张莉,李爱华. 比例法测定结核菌药敏试验中菌液浓度的研究. 疾病监测, 2000, 15(6): 208-210. [7] 丁北川,赵亭,盖亚茹,等. 结核分支杆菌药物敏感性不同检测方法结果的比较. 中华结核和呼吸杂志, 2000, 23(7): 423-425. [8] 黎友伦,陈保文,沈小兵,等. 结核分枝杆菌接种菌量对异烟肼和利福平药敏试验的影响. 中国防痨杂志, 2006, 28(5):288-291. [9] 刘峰,闫晓芳,许文雅. 绝对浓度法与比例法检测结核分枝杆菌药物敏感性的探讨. 国际检验医学杂志, 2012,33(19):2367-2368. [10] 刘宇红,王甦民,那希宽. 比例法测试结核分枝杆菌药物敏感性的探讨. 中华结核和呼吸杂志, 2000, 23(2): 89-92.. [11] 刘宇红,姜广路,赵立平,等. 第四次全国结核病流调分枝杆菌药敏试验的方法学探讨. 中国防痨杂志, 2003,25(1):16-20. [12] 程绍基,刘宇红,潘毓萱. 结核分枝杆菌药物敏感性测定. 中国防痨杂志,1997,19(3):142-144. [13] 姜广路,黄海荣. 中国结核分枝杆菌表型药物敏感性试验方法标准回顾. 中国防痨杂志, 2016,38(9):701-706. [14] Canetti G, Fox W, Khomenko A, et al. Advances in techniques of testing mycobacterial drug sensitivity, and the use of sensitivity tests in tuberculosis control programmes. Bull World Health Organ, 1969, 41(1): 21-43. [15] Heifets LB. Drug susceptibility in the chemotherapy of mycobacterial infections. Boca Raton,Florida,United States:CRC Press Inc,1991. [16] 中国防痨协会. 结核病诊断细菌学检验规程. 中国防痨杂志, 1996, 18(1): 28-31. [17] Canetti G, Froman S, Grosset J, et al. Mycobacteria: laboratory methods for testing drug sensitivity and resistance. Bull World Health Organ, 1963, 29: 565-578. [18] Meyer A. Influence of pretreatment bacterial resistance to isoniazid, thiacetazone or pas on the response to chemotherapy of african patients with pulmonary tuberculosis. Tubercle,1963,44:393-416. [19] World Health Organization.Anti-tuberculosis drug resistance in the world: the WHO/IUATLD Global Project on Anti-Tuberculosis Drug Resistance Surveillance. Geneva: World Health Organization, 1997. [20] 1963年全国结核病学术会议.关于测定结核菌对药物敏感性试验方法的意见. 中国防痨杂志, 1963, 4(3): 155-156. [21] 高东哲, 郑翼宗. 结核菌耐药性测定方法的研究 (一)菌液的制备与其定量. 中国防痨杂志, 1964, 5(4): 550-553. [22] 陈惠兰,王小天. 异菸肼、链霉素、对氨柳酸对结核菌敏感株抑菌浓度的测定及其方法的探讨. 中国防痨杂志, 1965, 6(1):31-34. [23] 吴爱棣. 利福平耐药性测定方法的研究. 中华结核和呼吸系疾病杂志, 1980, 3(2):101-103. [24] 中华医学会结核病学分会. 抗结核药物耐药性测定暂行规定. 中华结核和呼吸系疾病杂志, 1980,3(2):126. [25] Yang C, Luo T, Shen X, et al. Transmission of multidrug-resistantMycobacteriumtuberculosisin Shanghai, China: a retrospective observational study using whole-genome sequencing and epidemiological investigation. Lancet Infect Dis, 2017,17(3):275-284. [26] Zhao Y, Xu S, Wang L, et al. National survey of drug-resistant tuberculosis in China. N Engl J Med, 2012, 366(23):2161-2170. [27] 王胜芬,赵冰,宋媛媛,等. 我国耐药结核病的危险因素—2007年全国结核病耐药基线调查资料分析. 中国防痨杂志, 2013,35(4):221-226 [28] Abe C,Kobayashi I, Mitarai S,et al. Biological and molecular haracteristics ofMycobacteriumtuberculosisclinical isolates with low-level resistance to isoniazid in Japan. J Clin Microbiol,2008, 46(7):2263-2268. [29] Jindani A, Borgulya G, de Patio IW, et al. A randomised Phase Ⅱ trial to evaluate the toxicity of high-dose rifampicin to treat pulmonary tuberculosis. Int J Tuberc Lung Dis, 2016, 20(6):832-838. [30] Zhang Z, Dai F, Luo F,et al. Could high-concentration rifampicin kill rifampicin-resistantM.tuberculosis? Rifampicin MIC test in rifampicin-resistant isolates from patients with osteoarticular tuberculosis. J Orthop Surg Res, 2014, 9:124. [31] Milstein M, Lecca L, Peloquin C, et al. Evaluation of high-dose rifampin in patients with new, smear-positive tuberculosis (HIRIF): study protocol for a randomized controlled trial. BMC Infect Dis, 2016, 16(1):453. [32] 王永忠, 朱珉之, 刘小琴, 等. 结核分枝杆菌耐药基因检测及临床应用. 中华传染病杂志, 2012,30(11):696-699. [33] 潘毓萱. 结核分枝杆菌常规药物敏感性测验和临床化疗疗效相关性的再认识. 中华结核和呼吸杂志, 2006,29(8):514-516. [34] Laszlo A1, Rahman M, Raviglione M, et al. Quality assu-rance programme for drug susceptibility testing ofMycobacteriumtuberculosisin the WHO/IUATLD Supranational Laboratory Network: first round of proficiency testing. Int J Tuberc Lung Dis,1997, 1(3):231-238. [35] Gumbo T. New susceptibility breakpoints for first-line antituberculosis drugs based on antimicrobial pharmacokinetic/pharmacodynamic science and population pharmacokinetic variability. Antimicrob Agents Chemother,2010,54(4):1484-1491. [36] 许敏媛,宛淑肾,高东哲, 等.含抗结核药物的改良罗氏培养基药物效价的观察.中华结核和呼吸系疾病杂志,1984,7(3):155. [37] 马素英, 潘惠可, 常荣焱, 等. 鸡蛋药敏培基中利福平含量探讨. 中国防痨通讯, 1990,12(2):68-69. [38] Yu X, Jiang G, Li H,et al. Rifampin stability in 7H9 broth and Löwenstein-Jensen medium. J Clin Microbiol, 2011, 49(3):784-789. (本文编辑:孟莉 薛爱华) Analysis on influencing factors ofMycobacteriumtuberculosisdrug susceptibility test by using Löwenstein Jensen medium JIANGGuang-lu,DAIGuang-ming,HUANGHai-rong. TuberculosisClinicalLaboratoryofBeijingChestHospital,CapitalMedicalUniversity,Beijing101149,China HUANGHai-rong,Email:huanghairong@tb123.org Objective To evaluate the drug concentration criteria of drug susceptibility test (DST) ofMycobacteriumtuberculosis(MTB) to isoniazid, rifampicin, ethambutol by using absolute concentration method based on Lowenstein-Jensen media, and to evaluate the effects on DST results when different inoculums and inoculation me-thods were adopted. Methods According to the methods recommended by World Health Organization (WHO), the MTB strains were isolated from the sputum specimens collected from the TB patient who were likely drug susceptible cases and likely drug resistant cases respectively, and then the minimal inhabitation concentration (MIC) of isoniazid, rifampicin, ethambutol to the two kinds of MTB strains were tested. The cumulative percentage of the two kinds of MTB strains were calculated and the MIC of which the greatest difference of cumulative percentage between the two kinds of MTB strains was regarded as the cut-off value of drug resistance. 10-3mg and 10-4mg MTB were inoculated on the drug contained media with isoniazid, rifampicin and ethambutol respectively and their drug-resis-tance cut-off values were the criteria of proportion method. The drug resistance results were compared after 4 weeks incubation; MTB suspicion were inoculated on Lowenstein-Jensen with loop or pipette respectively (inoculums were both 10-6mg), colony-forming units (CFU) were compared after four weeks incubation. Results The concentration cut-off values of isonazid, rafampicin and ethambutol tested by absolute concentration method were 0.2 μg/ml, 40 μg/ml and 2 μg/ml respectively. The DST results showed no statistically significant difference between the dif-ferent inoculums (10-3mg vs. 10-4mg)(χ2was 0.57, 0.00, 0.00;Pvalue was 0.45, 1.00, 1.00 respectively). The number of CFU inoculated with loop (40.60±34.54, 95%CI=35.08-46.12) was significantly higher than the number of CFU inoculated with pipette (11.27±11.11, 95%CI=9.50-13.05) (t=11.58,P<0.01). Conclusion The drug resistance cut-off values of isonazid, rifampicin and ethambutol tested by the proportion method are more reasonable. There is no obvious difference between the DST results with the inoculums of 10-3mg and 10-4mg. It is better to inoculate with loop than with pipette. Mycobacteriumtuberculosis; Microbial sensitivity tests; Culture media, serum-free; Diagnostic techniques and methods; Outcome and process assessment (health care); Factor analysis, statistics 10.3969/j.issn.1000-6621.2017.08.007 北京市医院管理局“登峰”计划专项经费资助(DFL20151501) 101149 首都医科大学附属北京胸科医院结核病临床实验室 黄海荣,Email:huanghairong@tbl23.org 2017-05-13)结 果
讨 论

