牛樟芝非核糖体多肽合成酶基因(AcNRPS)的克隆与鉴定
原晓龙, 胡唐阁然, 赵 能, 陈 剑, 陈中华, 王 娟, 杨宇明, 王 毅 *
(1.云南省林业科学院 云南省森林植物培育与开发利用重点实验室 国家林业局云南珍稀濒特森林植物保护和繁育重点实验室,云南昆明 650204;2.中国科学院昆明植物研究所 中国野生生物种质资源库,云南 昆明 650201;3.中国科学院大学,北京 100049)
牛樟芝非核糖体多肽合成酶基因(AcNRPS)的克隆与鉴定
原晓龙1, 胡唐阁然2,3, 赵 能1, 陈 剑1, 陈中华1, 王 娟1, 杨宇明1, 王 毅1*
(1.云南省林业科学院 云南省森林植物培育与开发利用重点实验室 国家林业局云南珍稀濒特森林植物保护和繁育重点实验室,云南昆明 650204;2.中国科学院昆明植物研究所 中国野生生物种质资源库,云南 昆明 650201;3.中国科学院大学,北京 100049)
胶霉毒素属于真菌天然次生代谢产物epipolythiodioxopiperazine (ETP)家族,具有免疫抑制剂、抗真菌等多种生物活性,是由非核糖体多肽合成酶(NRPSs)催化合成。从牛樟芝(Antrodiacamphorata)基因组中挖掘出非核糖体多肽合成酶基因(AcNRPS,NCBI登录号为KX430967),克隆获取其全长cDNA,并对其进行生物信息学分析和表达谱分析。结果显示AcNRPS基因cDNA全长6 687 bp;与其DNA序列比对发现AcNRPS基因含有12 个内含子;其开放阅读框编码2 229 个氨基酸残基,BLAST比对发现其含有2 个A-C-T结构域,底物需2 个氨基酸;系统发育树结果显示AcNRPS与其他合成产物为胶霉毒素的NRPS基因聚为一类,其可合成胶霉毒素类化合物;表达谱分析显示,以葡萄糖和土豆蛋白胨作为碳、氮源的培养基能够有效促进牛樟芝NRPS基因的表达。
牛樟芝; 非核糖体多肽合成酶(NRPSs); 克隆; 表达
微生物通过非核糖体途径合成结构复杂、种类繁多的非核糖体肽(Non-ribosomal peptides, NRPs),其合成由非核糖体多肽合成酶(Non-ribosomal peptides synthetases,NRPSs)催化[1-2]。NRPSs在真菌合成多肽类次生代谢产物过程是一种较关键的酶[2]。目前已知的NRPs在医药方面主要作为抗生素、抗癌药物、抗真菌药及免疫抑制剂等[3];在微生物体内主要作为抗生素、铁载体、毒素及细胞生长调节剂等[4]。NRPSs广泛存在于细菌、真菌、放线菌、藻类等生物体中[2,5-6],是生物合成医药相关多肽类的重要合成酶[7]。目前对NRPSs很多结构域的晶体结构已经解析出来[8],且其合成途径中的多酶系统的功能被证实[9],大多数的研究集中于曲霉属[10]、放线菌[6]及细菌[2]。牛樟芝(Antrodiacamphorata) 属真菌(Fungi)担子菌亚门(Basidomycotina)层菌纲(Hymenomycetes)多孔菌科(Polypolaceae)薄孔菌属(Antrodia),主要分布于中国台湾山区海拔450 ~ 2 000 m的腐朽牛樟树(Cinnamomumkanehirai)的心材内壁中,为台湾地区特产的传统食药两用真菌[11-13]。牛樟芝菌体内含多种生物活性物质,如多糖类、三萜类、麦角甾醇、樟菇酸等[14],具抗肿瘤、抗氧化、免疫调节、抗炎、解毒等功效[15]。牛樟芝在保肝护肝方面的功效显著,对酒精性肝损伤、化学性肝损伤均具有保护作用[16],研究人员已于2014 年完成基因组测序[14]。随着生物信息学和基因测序技术的不断发展,基因组序列不断被报道出来[17]。从基因组数据中挖掘新基因的技术已成为基因研究的重要手段,通过这种方式获得的基因需进行不同方式培养,以验证所挖掘基因表达的条件和方式[18]。目前尚未发现有关牛樟芝中NRPSs的相关报道。本文拟通过对牛樟芝的基因组数据分析,结合生物信息学分析的方法,初步确定牛樟芝中的AcNRPS基因;以牛樟芝的cDNA为模板,克隆出AcNRPS基因全长,并通过半定量PCR检测不同培养基对AcNRPS基因表达的影响,为非核糖体多肽的生物合成提供参考依据。
1 材料与方法
1.1 材料
牛樟芝菌体由昆明市食用菌研究所提供,并在恒温培养箱25 ℃条件MY培养基(麦芽糖10 g/L、酵母提取物5 g/L)中培养。pEASY-T3克隆试剂盒(北京全式金),Trans1-T1 感受态细胞 (北京全式金公司); LATaq酶(TaKaRa),植物 cDNA Synthesis试剂盒(大连宝生物),植物总RNA提取试剂盒 (大连宝生物),TRIzol试剂(上海生工),Tiangen 2×Taq酶 (上海生工),所用的引物由华大基因合成。
1.2 方法
1.2.1 牛樟芝AcNRPS基因全长cDNA的克隆 以来源于Xylonaheveae的NRPS (NCBI登录号:KZF25221)为模板,利用本地BLAST搜索牛樟芝基因组数据,获得牛樟芝NRPS基因DNA序列(AcNRPS)。然后利用全式金公司的无缝连接试剂盒克隆获得AcNRPS全长cDNA。具体方法如下:以DNA序列为基础,设计2对特异引物用于cDNA克隆(表 1),并用植物RNA提取试剂盒提取牛樟芝的总RNA,将其反转录成cDNA。以cDNA为模板和2对特异引物,用高保真DNA聚合酶分别扩增出AcNRPS5′端片段和3′端片段。纯化2个片段后,按照无缝连接试剂盒说明书连接AcNRPS5′端片段,和3′端片段,获得全长cDNA, 并将阳性克隆进行测序验证。
1.2.2AcNRPS基因的生物信息学分析 将AcNRPS基因的cDNA序列和氨基酸残基序列进行理化性质分析,并用NCBI的ORF Finder发现AcNRPS基因的开放阅读框;将测序结果用DNAman去除载体后,通过NCBI对其DNA序列和氨基酸序列进行BLAST比对分析,选择同源性较高的序列并用MEGA 6.0软件进行聚类分析;理化性质的预测借助于ProParam在线工具;信号肽预测利用SignalP 4.1 server;用Target P预测其亚细胞定位,用NCBI中的Conversed Domain Database数据库搜索AcNRPS蛋白的结构功能域。生物信息学所用在线工具及其网址见表2。

表1 克隆反应中所用引物序列

表2 生物信息学在线工具及其网址
1.2.3 牛樟芝NRPS蛋白质的序列分析 将AcNRPS进行BLAST比对,推测其结构域,并从NCBI上下载同其结构域相似的其他17 条NRPS蛋白序列,与牛樟芝NRPS的蛋白质序列进行多序列比对。多序列比对采用MEGA 6.0中的Clustal W程序进行,使用默认参数;构建系统树应用邻位相接法(Neighbor-Joining),自展值设为1 000,其他采用默认参数进行绘制。
1.2.4AcNRPS基因的半定量分析 获取牛樟芝菌丝体,分别接种在1~11号培养基上,各培养基具体配方见表3,再按照8 g/L的量添加琼脂,并将其于15 ℃条件下的人工气候箱培养40 d后,每种培养基中各获取0.5 g牛樟芝真菌提取总RNA。牛樟芝总RNA参照反转录试剂盒(Transgen)说明合成cDNA,-20 ℃冰箱保存备用。以特异引物(表1)检测非核糖体多肽合成酶AcNRPS基因表达的具体情况。参照张文娟等[19]的方法,利用GENE-SNAPS图像分析软件分析不同培养基的条带的积分光密度值,比较各条带的积分光密度值,按照相对定量的方法绘制柱状图[20]。利用PCR技术结合凝胶图像分析软件,分析不同条带的灰度比,对凝胶电泳图像进行相对定量。

表3 不同培养基配方
2 结果与分析
2.1 无缝连接技术克隆牛樟芝AcNRPS基因全长
以牛樟芝cDNA为模板,利用全式金公司提供的无缝连接试剂盒,克隆获得AcNRPS基因全长cDNA,通过测序拼接后显示AcNRPS全长6 687 bp。与DNA序列比对后,发现AcNRPS基因含有12 个内含子(图 1)。从起始密码子开始其内含子依次为850~902、1 432~1 482、1 535~1 583、4 078~4 134、4 242~4 294、4 464~4 515、4 606~
4 655、4 768~4 818、5 007~5 061、5 184~5 277、
6 114~6 173、6 893~6 974,内含子占据AcNRPS基因座位约9.57%。该基因的13 个外显子拼接总长6 687 bp,可编码2 229个氨基酸。

图1 AcNRPS基因的内含子和外显子(实心部分为外显子,空心部位为内含子)Fig.1 The intron and exon of AcNRPS (the solid part is exon, and others is intron)
2.2AcNRPS基因的理化性质分析
用ProtParam在线软件预测牛樟芝NRPS的蛋白序列的理化性质,该蛋白的相对分子质量为244 083.2,酸性氨基酸残基247个,碱性氨基酸残基211个,分子式为C10888H17187O3237N3011S63,理论等电点为6.01,脂肪系数为94.39,在体外培养大肠埃希菌理论半衰期大于10 h;不稳定系数为37.49,为较稳定的蛋白。SignalP 4.1结果显示该蛋白不存在信号肽,为非分泌蛋白;Wolf Psort(亚细胞定位)分析结果显示其位于细胞质中。
2.3 牛樟芝NRPSs蛋白质序列的保守结构域和活性位点分析
将牛樟芝NRPS的蛋白序列在NCBI上进行比对,发现牛樟芝NRPS蛋白序列与干朽皱孔菌(Serpulalacrymansvar.lacrymans)非核糖体多肽合成酶具较高的同源相似性,高达62%。将牛樟芝NRPS蛋白序列与其同源性较高的4 条序列比对,发现牛樟芝NRPS蛋白具有ACTACTHxT 8个基本结构域(图1), 编码2个氨基酸,其最终产物可能是形成2肽。其基本结构域包括A domain(腺苷酰化结构域)、T domain(肽酰载体蛋白结构域)、C domain(缩合结构域)、Hx domain(HxxPF 重复结构域),其中Hx domain在NRPSs中首先发现,最多可重复12次,各个基本结构域的活性保守位点分别为A1(TSGTXXG-PKGV)、T1(KVDR-QI-LGG)、C1(RY-G-VL-GP-NTLP)、A2(TSGSTG-PKXV-L-G)、T2(KVDX-XI-LGX)、C2(DDIVXL-GLFLDR-RX)、Hx(LGXXSL-LXXRL-LA)、T3(L-GXXF-FXL)(X代表任意氨基酸)。

图2 牛樟芝NRPSs蛋白基本结构域的预测Fig.2 The prediction of the basical domains of NRPSs in Antrodia camphorata
2.4 分子系统进化分析
将牛樟芝NRPS蛋白质序列在NCBI上进行BLAST比对,找到与其同源性较高的其余17 条蛋白序列。利用MEGA 6.0软件中的Clustal W程序对牛樟芝NRPS蛋白序列和其他17 条NRPS蛋白序列进行多序列比对,并采用邻位相接法(Neighbor-Joining tree)构建系统进化树。分析结果显示,牛樟芝NRPS蛋白序列与Xylonaheveae(KZF25221.1)、费舍尔曲霉(AspergilusfischeriXP001263173.1)、构巢曲霉(A.fumigatusKEY80879.1)聚为一支,即含有两组A-T-C结构域,根据其聚类情况,推测牛樟芝NRPS可能合成胶霉毒素类,其余两支为合成青霉素母核,及合成微囊藻毒素母核。本研究中牛樟芝NRPSs可将2 个半胱氨酸形成二硫桥键,促进形成环多硫哌嗪二酮类物质。
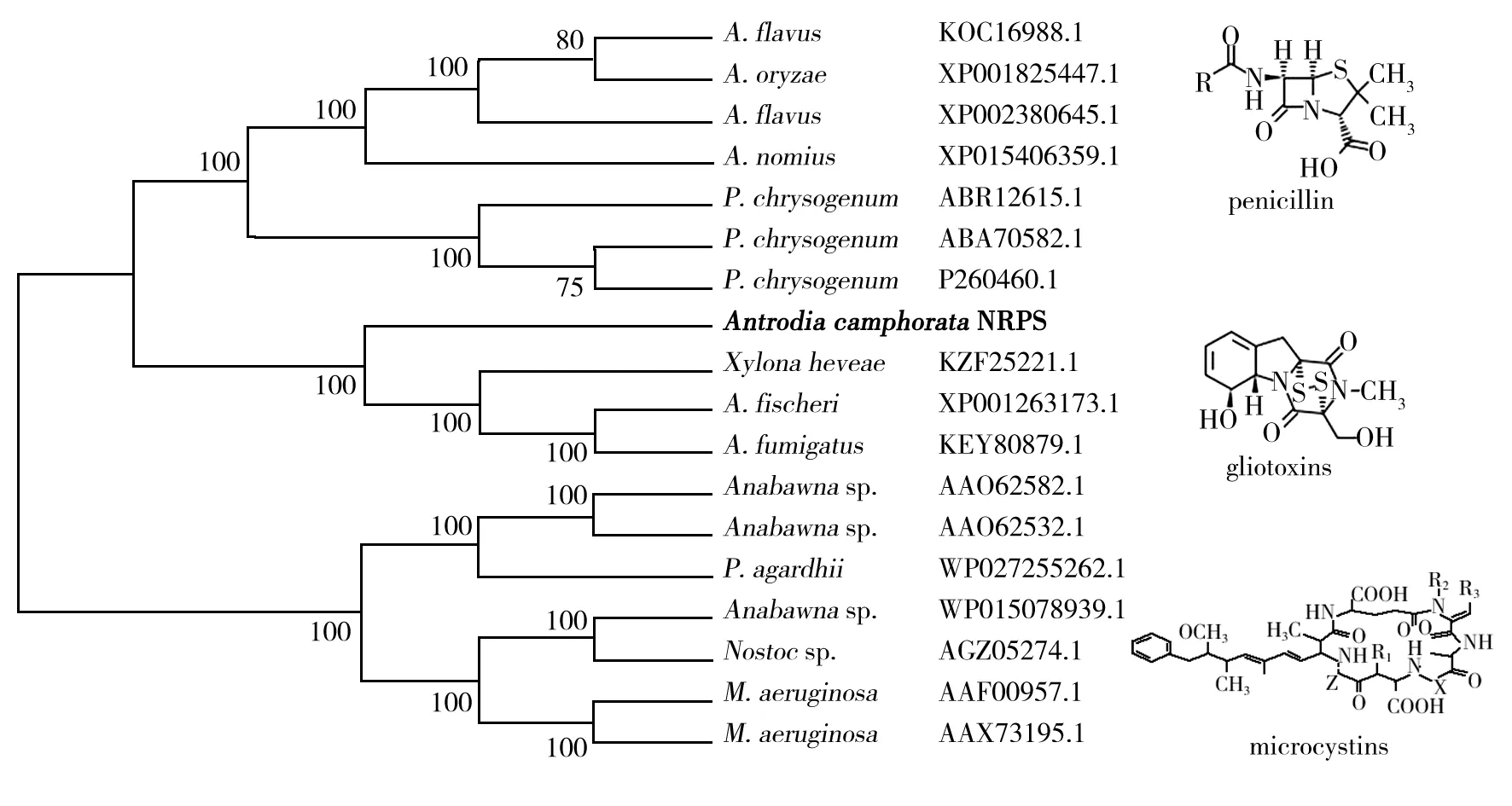
图3 牛樟芝NRPS与其他17条非核糖体多肽合成酶分子系统进化分析Fig.3 The phylogenetic analysis of NRPSs in Antrodia camphorata and another 17 NRPSs
2.5 不同培养基对AcNRPS基因表达的影响
以肌动蛋白(actin)作为参照,TNRPKSF、TNRPKSR为引物检测牛樟芝NRPS基因在不同碳氮源培养基上的诱导表达情况。AcNRPS基因在不同碳源条件下,其诱导表达情况差异显著,葡萄糖诱导AcNRPS基因表达最强,果糖次之,麦芽糖和甘露糖诱导表达情况相仿,乳糖抑制其表达;不同氮源条件下,其诱导表达能力从强到弱的顺序为土豆蛋白胨>牛肉浸粉>胰蛋白胨>酵母提取物>番茄浸粉>酪蛋白胨。
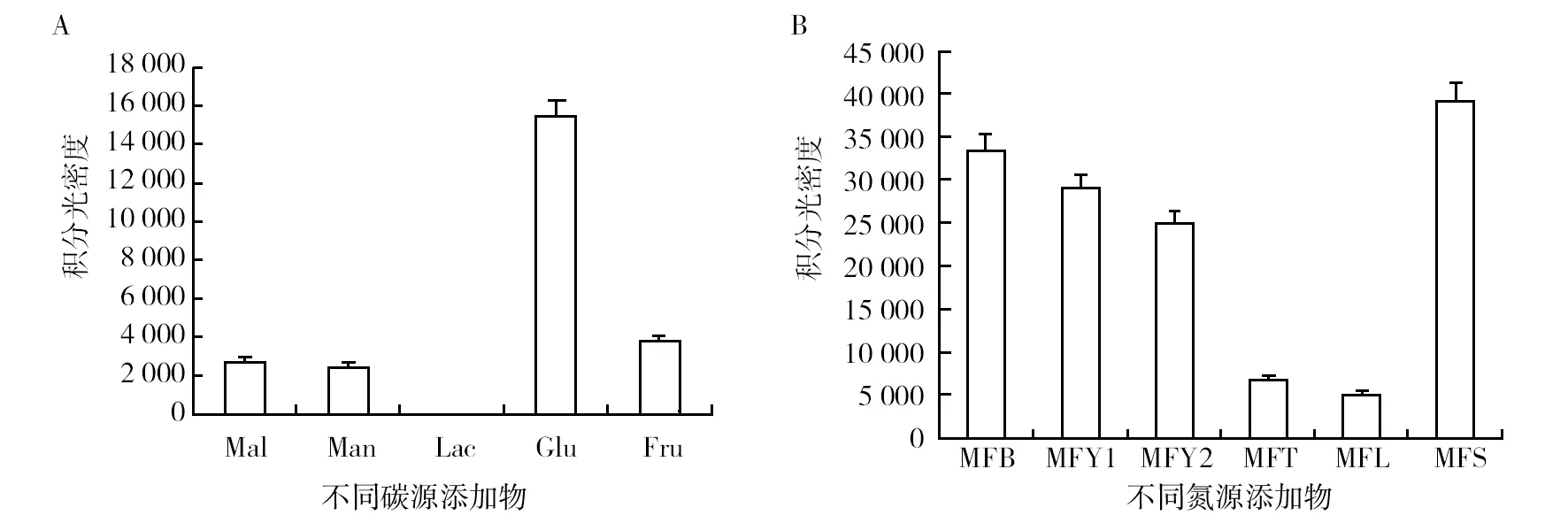
图4 不同培养基条件下牛樟芝NRPS基因的诱导表达情况Fig.4 The inducible expression of Antrodia camphorata′s gene NRPS cultivated in the different mediumA:在麦芽糖6 g/L,酵母提取物3 g/L相同情况下,碳源依次为不添加、甘露糖4 g/L、乳糖4 g/L、葡萄糖4 g/L、果糖4 g/L;B:在麦芽糖1.8 g/L,葡萄糖6 g/L相同情况下,氮源依次为牛肉浸粉4 g/L、胰蛋白胨4 g/L、酵母提取物4 g/L、番茄浸粉4 g/L、酪蛋白胨4 g/L、土豆蛋白胨4 g/LA: Carbon sources are no addition, Mannose 4 g/L, Lactose 4 g/L, Glucose 4 g/L, Frutose 4 g/L successively under the same conditions of maltose 6 g/L and yeast extract 3 g/L;B: Nitrogen sources are Beef extract powder 4 g/L, Tryptone 4 g/L, Yeast extract 4 g/L, Tomato extract 4 g/L, Casein 4 g/L, Potato peptone 4 g/L successively under the same conditions of maltose 1.8 g/L and fructose 6 g/L
3 讨 论
牛樟芝是台湾地区的道地药材,仅生长在腐朽牛樟树的中空心材内部,野生牛樟芝较为珍稀;台湾山地的原住居民用牛樟芝治疗和预防因过度饮酒而引起的身体疾病,发现其可解宿醉,还可以治疗牙痛及一些小病痛[21]。本研究通过挖掘牛樟芝基因组数据,发现了牛樟芝中AcNRPS基因序列,通过系统进化和不同物种基因簇比对,AcNRPS基因最可能的合成产物为胶霉毒素(GliP)。胶霉毒素是真菌代谢产物ETP家族的一员,是一种潜在的免疫抑制剂,具独特的二硫键结构,两个硫原子之间形成共价键,此共价键一般位于多肽链中所含有的两个半胱氨酸侧链的硫原子之间[22-23]。赵文英等[24]研究发现,胶霉毒素在较低浓度(0.15 mg/L)下对小鼠的乳腺癌细胞具很强的细胞毒性。同时胶霉毒素具免疫抑制毒性,可诱导多种细胞凋亡[23]。胶霉毒素在体外条件下,能够抑制胸腺细胞、巨噬细胞的吞噬作用,刺激淋巴细胞的有丝分裂,诱导T细胞产生细胞毒素,还可进行氧化还原循环,产生引起氧化损伤的氧自由基,导致细胞凋亡[22]。
Cramer等[10]利用非核糖体多肽合成酶的A结构域对曲霉属的不同NRPS进行了分类,但是这种方法存在一定程度的误差,因为一个完整的NRPSs具有多个A结构域。本研究利用NCBI确定牛樟芝的NRPSs的保守结构域,明确A结构域的数量,同时选择与其结构域基本相同或相似(满足具有与牛樟芝A结构域相同数量的序列),构建分子系统进化树,其可信度比仅用A结构域要高。本研究对牛樟芝NRPS基因进行了表达谱分析,以葡萄糖作为碳源、以土豆蛋白胨作为氮源对牛樟芝NRPS基因的诱导表达效果最好,为以后牛樟芝生物合成提参考。
[1] Von Dohren H. A survey of nonribosomal peptide synthetase (NRPS) genes inAspergillusnidulans[J]. Fungal genet biol, 2009, 46(S1): 45-52.
[2] Evans, B.S. Nonribosomal Peptide and Polyketide Biosynthesis Methods and Protocols[M]. London, UK, Human press, 2016:14-50.
[3] 郑宗明, 顾晓波, 俞海青, 等. 非核糖体肽合成酶主要结构域的研究进展[J]. 中国抗生素杂志, 2005, 30(2):120-124.
[4] Roongsawang N, Washio K, Morikawa M. Diversity of nonribosomal peptide synthetases involved in the biosynthesis of lipopeptide biosurfactants[J]. Int J Mol Sci, 2010, 12:141-172.
[5] Sims J W, Schmidt E W. Thioesterase-Like Role for Fungal PKS-NRPS Hybrid Reductive Domains[J]. J. Amer. Chem Soc, 2008, 130:11149-11155.
[6] 马艳玲, 邓海, 魏菁菁, 等. 稀有海洋放线菌Salinisporaarenicola非核糖体肽合成酶和卤代酶生物合成基因簇核心区的克隆及序列分析[J]. 生物技术通报, 2011, 32:175-184.
[7] Meyer S, Kehr J C, Mainz A, et al. Biochemical Dissection of the Natural Diversification of Microcystin Provides Lessons for Synthetic Biology of NRPS[J]. Cell Chem Biol, 2016, 23:462-471.
[8] Challis G L, Naismith J H. Structural aspects of non-ribosomal peptide biosynthesis[J]. Curr Opin Struct Biol, 2004, 14:748-756.
[9] Bergendahl V, Linne U, Marahiel M A. Mutational analysis of the C-domain in nonribosomal peptide synthesis[J]. Eur J Biochem, 2002, 269:620-629.
[10] Cramer R A, Jr Stajich J E, Yamanaka Y, et al. Phylogenomic analysis of non-ribosomal peptide synthetases in the genusAspergillus[J]. Gene, 2006, 383: 24-32.
[11] 胡鸥, 张君逸, 卢喜. 樟芝及其研究开发概况[J]. 福建热作科技, 2006, 31(4):40-42.
[12] Ao ZH, Xu ZH, Lu ZM, et al. Niuchangchih (Antrodiacamphorata) and its potential in treating liver diseases[J]. J Ethnopharmacol, 2009, 121:194-212.
[13] 张知晓, 季梅, 泽桑梓. 牛樟芝培养技术的研究进展[J]. 热带农业科学, 2015, 35(3):94-99.
[14] Lu M Y, Fan W L, Wang W F, et al. Genomic and transcriptomic analyses of the medicinal fungusAntrodiacinnamomeafor its metabolite biosynthesis and sexual development[J]. PNAS, 2014, 111:E4743-E4752.
[15] 陈娟, 姜兴华, 范青生, 等. 樟芝的食用安全性研究进展[J]. 中国微生态学杂志, 2010, 22(9):857-859.
[16] Duan D, Yue Y, Engelhardt J F. Expanding AAV packaging capacity with trans-splicing or overlapping vectors: a quantitative comparison[J]. Mol. Ther., 2001, 4: 383-391.
[17] 贾继增, 黎裕. 植物基因组学与种质资源新基因发掘[J]. 中国农业科学, 2004, 37:1585-1592.
[18] Lautru S, Deeth R J, Bailey L M, et al. Discovery of a new peptide natural product byStreptomycescoelicolorgenome mining[J]. Nat. Chem. Biol., 2005, 1:265-269.
[19] 张文娟, 刘薇, 魏锋, 等. 聚合酶链式反应·限制性片段长度多态性法用于检定川贝母掺伪情况的研究[J]. 药物分析杂志, 2014, 34:1830-1835.
[20] 汪薇, 王诗航. 光密度值测定在实验医学研究中的应用及意义[J]. 解剖科学进展, 2006, 12:286.
[21] Lien H M, Tseng C J, Huang C L, et al. Antimicrobial Activity ofAntrodiacamphorataExtracts against Oral Bacteria[J]. PLoS one, 2014, 9:1-7.
[22] Kosalec I, Pepeljnjak S. Mycotoxigenicity of clinical and environmentalAspergillusfumigatusandA.flavusisolates[J]. Acta Pharmaceutica, 2006, 55: 365-375.
[23] Scharf D H, Heinekamp T, Remme N, et al. Biosynthesis and function of gliotoxin inAspergillusfumigatus[J]. Appl Microbiol Biotechnol, 2011, 93: 467-472.
[24] 赵文英, 顾谦群, 朱伟明. 海洋来源真菌烟曲霉中胶霉毒素类成分研究[J]. 化学研究, 2007, 18(3):10-13.
Isolation and Identification of Nonribosomal Peptides Synthetase (AcNRPS) fromAntrodiacamphorata
YUAN Xiao-long1, HU Tanggeran2,3, ZHAO Neng1, CHEN Jian1, CHEN Zhong-hua1,WANG Juan1, YANG Yu-ming1, WANG Yi1
(1.KeyLab.forConserv’nofRare,Endan. &EndemicForestPlants,StateForest.Administ.,YunnanProv.KeyLab.ofCultiv’n&Exploit’nofForestPlants,YunnanAcad.ofForest.,Kunming650204; 2.KunmingInstituteofBotany,ChineseWildGermplasmResourceBank,Kunming650201; 3.UniversityofChineseAcademyofSciences,Beijing100049)
Gliotoxin is a kind of fungal natural secondary metabolites, which belongs to the family of epipolythiodioxopiperazine (ETP), it has much bioactivity such as immunosuppressant, antifungal etc. The synthesis of gliotoxin could be catalyzed by NRPSs (nonribosomal peptides synthetase). In this paper the NRPS gene (AcNRPS, NCBI ID: KX430967) of the NRPSs was tapped from the genome ofAntrodiacamphorata, acquired the full length ofAcNRPS, and analyzedAcNRPSgene with bioinformatic methods and expression spectrum analysis. The results showed that the full length ofAcNRPScDNA has 6 687 bp including 12 introns by alignment the cDNA and genomic DNA ofAntrodiacamphorata, the opening frame reader ofAcNRPSgene could encode 2 229 amino acids. NRPSs have two repeats of A-C-T domains by BLAST, and need 2 amino acids as substrates to synthetase the gliotoxin precursor. Phylogenetic analysis clarified that theAcNRPSand the other NRPS gene that they produced the gliotoxin was clustered in a branch. The expression results revealed that the medium, having the glucose and potato peptone as carbon and nitrogen source, respectively, could exalt the production of NRPS gene, effectively.
Antrodiacamphorata; non-ribosomal peptide synthetase (NRPSs); cloning; expression
云南省对外科技合作计划项目(2015IA004); 国家自然科学青年科学基金项目(31400488); 云南省应用基础研究计划面上项目(2016FB055)
原晓龙 男,研究实习员,硕士。从事林木分子生物学研究。E-mail:xiaolony@126.com
* 通讯作者。男,博士,助理研究员。主要从事植物学和分子生物学研究。E-mail:22825818@qq.com
2016-05-20;
2016-06-29
Q936;Q78
A
1005-7021(2017)01-0014-06
10.3969/j.issn.1005-7021.2017.01.003

