PMA结合ddPCR检测食品中金黄色葡萄球菌的研究
赵丽青, 王 静, 秦 燕 , 贾俊涛, 姜英辉, 唐 静, 张 健
(1.山东出入境检验检疫局,山东 青岛 266002;2.威海出入境检验检疫局,山东 威海 264200)
PMA结合ddPCR检测食品中金黄色葡萄球菌的研究
赵丽青1, 王 静2*, 秦 燕2, 贾俊涛1, 姜英辉1, 唐 静1, 张 健1
(1.山东出入境检验检疫局,山东 青岛 266002;2.威海出入境检验检疫局,山东 威海 264200)
研究了将叠氮溴化丙锭(PMA)与微滴式数字PCR(ddPCR)技术相结合,用于金黄色葡萄球菌活菌的检测。结果表明,强烈光照15 min,可以使PMA与死菌DNA共价交联,同时钝化游离的PMA;可以有效抑制金黄色葡萄球菌死菌DNA PCR扩增的PMA终浓度为2.0 μg/mL;不抑制活菌DNA扩增的PMA最高浓度是5.0 μg/mL。在不同死、活菌比例下,PMA-ddPCR可以定量检测活菌,避免了死菌DNA的干扰,本方法的检出限为10 copy/20 μL。利用PMA-ddPCR检测人工污染鸡肉样品,最低可检出102cfu/mL的金黄色葡萄球菌。表明PMA-ddPCR方法的灵敏度高。
叠氮溴化丙锭;微滴式数字PCR;金黄色葡萄球菌
金黄色葡萄球菌(Staphylococcusaureus,SA)广泛分布于自然界,是一种重要的人畜共患病病原菌。传播途径较多,对人类的安全构成威胁。食品中的SA在一定条件下可以产生肠毒素,从而导致食物中毒。至今,已有多起牛奶及奶制品污染SA的事件报道[1]。因此,对SA进行检测十分重要,而检测的关键是食品中活菌是否存在和如何准确定量的问题。为检测食品中的SA,国内外常见的微生物定量方法有平板计数法、磷酸酶活性定量法、MPN-PCR法等,这些方法耗时、费力,不能满足快速检测的需要。因此,开发定量检测活菌的方法非常必要。本研究将基于核酸共价交联技术从分子水平寻找细菌活的状态的标志物,建立活菌的检测方法。叠氮溴化丙锭(propidium monoazide, PMA)是对DNA 具有高度亲和力的光敏染料,能够选择性地穿透死菌细胞的细胞膜,进入细胞内部,并且插入细胞内DNA双螺旋上[2-5]。随后在强光作用下,已经插入到细胞内DNA 双螺旋上的PMA可与DNA双螺旋发生交叉偶合作用,阻止了以此DNA为模版的PCR 反应的进行。因此PMA和PCR技术相结合在定量检测活菌方面有巨大的发展潜力[6]。微滴数字PCR方法(Droplet digital PCR,ddPCR)是近年来发展起来的快速、准确、可实现DNA绝对定量的PCR方法。其原理是通过把稀释到一定浓度的DNA分子分布在一定数目的微滴中,使大部分微滴中的DNA分子数目为1或0,然后通过PCR扩增和荧光信号的累计读取阳性微滴数目,再根据泊松分布计算出样本中的DNA分子数。本方法无需依赖外部核算标准,可实现核酸绝对定量分析。ddPCR与qPCR方法相比,本方法无需核酸标准品,又兼具qPCR方法的优点[7],用于病原体基因检测具有更广阔的应用前景。因此,研究和建立金黄色葡萄球菌的PMA-ddPCR方法,对金黄色葡萄球菌的快速、准确的定性和定量检测具有重大意义。
1 材料与方法
1.1 材料
1.1.1 菌种 金黄色葡萄球菌staphylococcusaureusATCC29213。
1.1.2 试剂与仪器 PMA(1 mg,美国 Biotium公司):溶解于1.0 mL 质量分数20%的DMSO溶液,得到1 mg/mL储备液,于-20 ℃避光保存;细菌基因组DNA提取试剂盒(北京Tiangen公司);引物、探针由生工生物工程(上海)股份有限公司合成;荧光定量PCR反应体系有关试剂购自罗氏公司;微滴式数字PCR反应体系有关试剂购自美国伯乐公司。QX200微滴式数字PCR系统(美国伯乐公司);7900HT Fast 实时荧光定量PCR系统(美国应用生物系统公司);CF16RXII高速冷冻离心机(日本日立公司);卤钨灯(500 W)(飞利浦灯具(上海)有限公司)。
1.2 方法
1.2.1 引物的设计探针 根据金黄色葡萄球菌特异的nuc基因片段为靶基因,设计引物和探针序列见表1,采用设计好的引物和探针建立实时荧光PCR方法。

表1 金黄色葡萄球菌特异性PCR扩增和探针序列
1.2.2 细菌培养及不同胁迫条件下受损细菌的制备 用接种环沾取甘油管保存的菌液,在营养琼脂平板上划线,37 ℃培养24 h。挑取单菌落接种于营养肉汤液体培养基,37 ℃培养至对数生长期。受损细菌的制备:吸取3份处于对数期的细菌培养液于离心管中,分别沸水浴5 min,70%异丙醇处理30 min,30 W紫外灯照射30 min,吸取1 mL涂布于平板计数培养基,37 ℃下培养24 h观察是否有菌落长出。
1.2.3 最佳PMA浓度的选取 取500 μL受损细菌于1.5 mL离心管中,分别加入PMA使其终浓度为0、2.0、5.0、10.0、20.0、40.0、50.0 μg/mL,充分混匀后暗处孵育15 min,每隔5 min颠倒混匀,使PMA最大限度进入受损细胞内。将离心管置于500 W卤钨灯下20 cm处曝光15 min(管口朝上,置于冰上),期间每隔5 min混匀,以使样品溶液曝光均匀。随后用试剂盒法提取基因组DNA,进行荧光定量PCR检测。取500 μL金黄色葡萄球菌液作为对照组,处理同实验组。设置3个重复。
1.2.4 最佳曝光时间的选取 取500 μL受损细菌于1.5 mL离心管中,加入终浓度40.0 μg/mL PMA后暗处孵育15 min,置于卤钨灯下方20 cm处,分别曝光0、2.0、5.0、10.0、 15.0、20.0 min,随后用试剂盒提取基因组DNA,进行荧光定量PCR检测。
1.2.5 PMA-qPCR及PMA-ddPCR检测 分别利用7900HT Fast 实时荧光定量PCR系统和QX200微滴式数字PCR系统进行检测。PMA-qPCR反应体系(25.0 μL):12.5 μL LightCycler®480 Probes Master;10 μmol/L上、下游引物各1.0 μL;10 μmol/L探针0.5 μL;模板DNA 2.0 μL;最后用水补充至25.0 μL。qPCR扩增条件:95 ℃ 1 min;95 ℃ 10 s,60 ℃ 30 s,40个循环,同时收集FAM荧光。PMA-ddPCR反应体系(20.0 μL):10.0 μL ddPCRTMSupermix for Probes (No dUTP);10 μmol/L上、下游引物各1 μL;10 μmol/L探针0.5 μL;模板DNA 6 μL;用ddH2O补至20 μL。ddPCR反应条件:95 ℃ 5 min;95 ℃ 15 s,60 ℃ 35 s,40个循环;98 ℃ 10 min。
1.2.6 qPCR、PMA-qPCR、PMA-ddPCR检测不同比例活菌的比较 配制活菌比例(质量分数)为100%、50%、25%、12.5%、0%的金黄色葡萄球菌菌悬液,分别取500 μL于1.5 mL离心管中,qPCR组不加入PMA,PMA-qPCR、PMA-ddPCR组用PMA处理(PMA终浓度为40.0 μg/mL,曝光15 min),按照试剂盒提取基因组DNA,进行qPCR、PMA-qPCR、PMA-ddPCR检测。
1.2.7 PMA-qPCR、PMA-ddPCR检测金黄色葡萄球菌的灵敏度 将107cfu/mL的金黄色葡萄球菌菌液依次稀释10倍制得浓度为107、106、105、104、103、102、10 cfu/mL的菌液,分别标记为J7~J1。在优化条件下,进行PMA-qPCR、 PMA-ddPCR检测。
1.2.8 PMA-qPCR、PMA-ddPCR检测人工污染鸡肉样品中金黄色葡萄球菌 取25.0 g新鲜鸡肉样品,用均质器制成鸡肉匀浆,加入105cfu/mL死菌,然后加入人工污染10~106cfu/mL的金黄色葡萄球菌菌液,浓度2.0 μg/mL PMA暗处孵育15 min,置于卤钨灯下方20 cm处理15 min,在优化条件下进行PMA-qPCR、PMA-ddPCR检测。
2 结果与分析
2.1 金黄色葡萄球菌在不同受损条件下PMA的处理效果
金黄色葡萄球菌在不同受损条件下PMA的处理效果见图1。未加PMA处理的对照组中,热、异丙醇、紫外灯照射处理得到的金黄色葡萄球菌死细胞DNA的PCR扩增没有明显差异。加PMA处理的实验组中,紫外灯照射对金黄色葡萄球菌细胞DNA的PCR扩增几乎没有影响,原因是紫外照射只破坏了细胞中的核酸结构,没有破坏细菌的细胞膜;与对照组相比,热处理组和异丙醇处理组CT(C代表Cycle,T代表threshold,CT值指每个反应管内的荧光信号到达设定的域值时所经历的循环数)值均明显升高,说明PMA抑制了其DNA扩增。本研究采用了30 W紫外灯照射进行处理。

图1 不同致死方式对叠氮溴化丙锭进入细胞膜的影响Fig.1 Effects of different lethal modes on PMA into the cell membrane
2.2 最佳PMA浓度的优化
不同浓度PMA对金黄色葡萄球菌的影响见图2。随着PMA浓度的增大,死菌DNA qPCR扩增的CT值明显升高,当PMA浓度超过2.0 μg/mL时, CT值几乎不再发生变化。当PMA浓度超过5.0 μg/mL时,活菌DNA qPCR扩增的CT值略高于不加PMA的对照组,高浓度PMA影响了活菌DNA的qPCR扩增。本研究选用2.0 μg/mL PMA为最佳浓度。

图2 不同浓度叠氮溴化丙锭对活菌和热灭活菌的影响Fig.2 Effect of PMA concentration on live and dead Staphylococcus aureus
2.3 最佳曝光时间的优化
曝光时间对PMA处理受损金黄色葡萄球菌的影响见图3。随着光照时间的增加,体系的CT值迅速升高,光照时间超过15.0 min后,体系的CT值不发生明显变化,说明PMA和DNA发生了共价交联反应,多余的PMA与水溶液反应生成没有活性的羟胺。本研究选取15.0 min作为最佳光照时间。
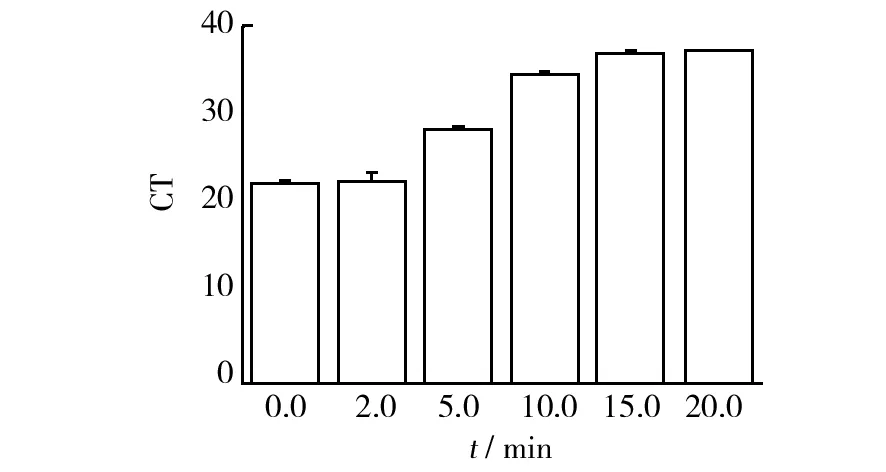
图3 曝光时间对叠氮溴化丙锭处理死细胞的影响Fig.3 Optimization of different light exposure
2.4 qPCR检测金黄色葡萄球菌的线性曲线
qPCR检测金黄色葡萄球菌的线性曲线如图4所示。CT值与金黄色葡萄球菌的浓度在102~108cfu/mL范围内呈现良好的线性关系(R=0.999 4),其线性回归方程:y=49.641-3.636 5x,方程中y代表DNA qPCR扩增的CT值,x代表金黄色葡萄球菌的浓度对数值。PMA-qPCR的检测限是103cfu/mL。
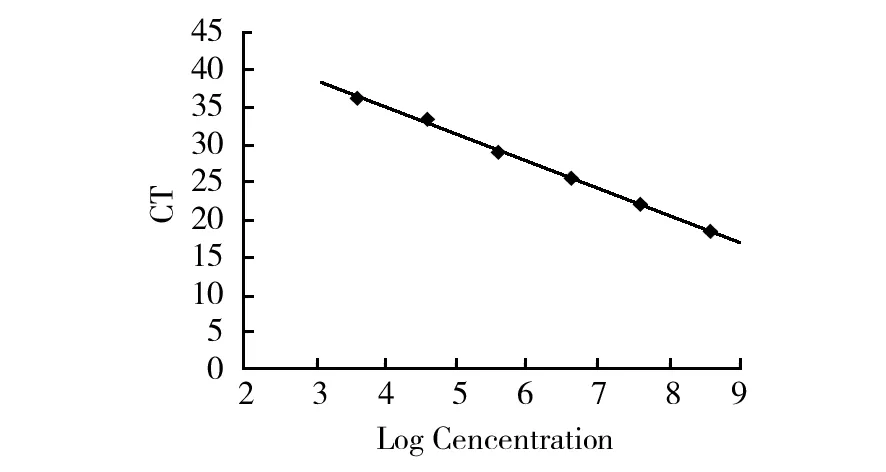
图4 金黄色葡萄球菌实时荧光定量PCR标准曲线Fig.4 Standard curve of Staphylococcus aureus qPCR
2.5 PMA-ddPCR、PMA-qPCR检测金黄色葡萄球菌的灵敏度
将原菌液浓度为6.3×105cfu/mL的金黄色葡萄球菌10倍梯度稀释,分别标记为J5~J1进行PMA-ddPCR、PMA-qPCR检测。结果见图5、6、7。从图6金黄色葡萄球菌扩增散点图可知,经过优化的PCR体系对金黄色葡萄球菌基因组DNA扩增结果良好,其中阳性微滴和阴性微滴明显分成两簇,而且中间弥散的微滴数目很少,表明经过优化确定的ddPCR探针浓度和扩增体系适合金黄色葡萄球菌进行定量分析。从图5可计算出PMA-ddPCR检出限为10 copy/20 μL ,图7中,PMA-qPCR最少可检出103cfu/mL的金黄色葡萄球菌。可见,ddPCR方法检测金黄色葡萄球菌的灵敏度非常高。

图5 叠氮溴化丙锭-数字PCR检测金黄色葡萄球菌灵敏度Fig.5 Sensitivity of Staphylococcus aureus by PMA-ddPCR detection

图6 叠氮溴化丙锭-数字PCR扩增金黄色葡萄球菌的一唯散点图Fig.6 One-dimensional scatter plos of selected wells/samples for Staphylococcus aureus by PMA-ddPCR detection
2.6 肉类样品检测
对不同菌量人工污染的鸡肉样品在优化条件下进行PMA-qPCR、PMA-ddPCR检测,如表1所示,PMA-ddPCR检测人工染菌鸡肉样品,最低可检出102cfu/mL的金黄色葡萄球菌,而PMA-qPCR测得值与理论添加值偏差较大。PMA-ddPCR对样品检测的RSD均小于5.0%。
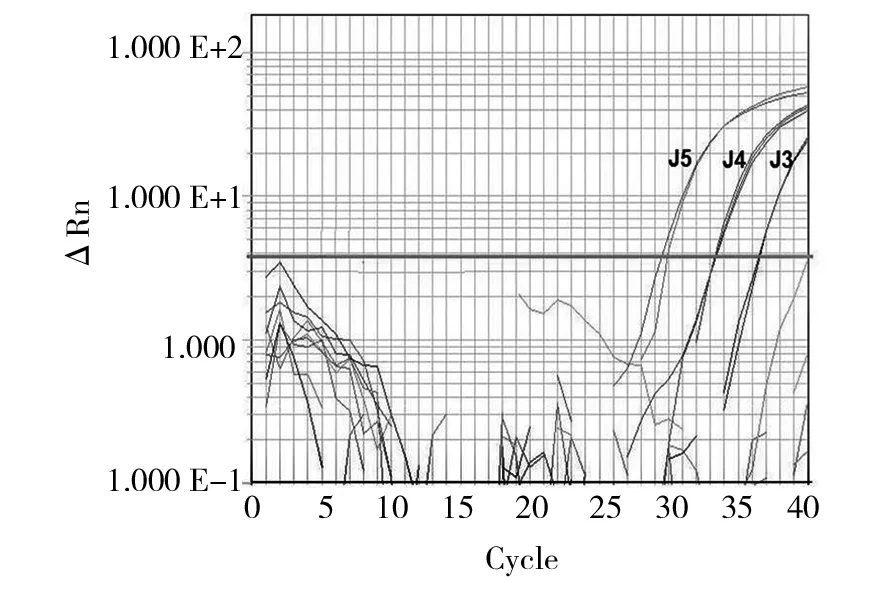
图7 叠氮溴化丙锭-实时荧光定量PCR检测金黄色葡萄球菌灵敏度Fig.7 Sensitivity of Staphylococcus aureus by PMA-qPCR detection

理论添加/(cfu·mL-1)PMA-qPCR结果/(cfu·mL-1)PMA-ddPCR结果/(cfu·mL-1)J12.1×10NDNDJ22.1×102ND2.60×102J32.1×1039.67×1021.60×103J42.1×1041.34×1031.80×104J52.1×1051.64×1042.06×105J62.1×1061.9×1052.09×106
3 讨 论
SA的检测方法主要有分离培养法、琼脂扩散法、免疫学检测法、血清学及核酸探针检测法,这些方法即费时费力,又易出现假阳性和假阴性,很难满足快速检测需要[8]。另外,应用TaqMan实时荧光PCR技术检测金黄色葡萄球菌的研究,在国内有很多相关的报道[9]。但微滴数字PCR检测方法在金黄色葡萄球菌检测方面尚不多见。在检测中传统的PCR技术无法区分死菌与活菌,死菌DNA在PCR检测中也能扩增出目的基因,从而使检测结果出现大量假阳性。本研究选取SAnuc基因为靶基因设计引物和探针,将PMA与微滴式数字PCR(ddPCR)技术相结合,用于金黄色葡萄球菌活菌的检测,避免了死菌DNA的PCR干扰。
本研究将原菌液浓度为6.3×105cfu/mL的金黄色葡萄球菌10倍梯度稀释,分别进行PMA-ddPCR、PMA-qPCR检测,实验结果显示,PMA-ddPCR检出限为10 copy/20 μL,而PMA-qPCR最少可检出103cfu/mL的金黄色葡萄球菌。ddPCR方法检测金黄色葡萄球菌的灵敏度非常高。为了评估PMA-ddPCR对污染食品样本的定量检测性能,本研究选用人工污染的鸡肉样品进行PMA-ddPCR和PMA-qPCR检测。最终,PMA-ddPCR对样品检测的RSD均小于5.0%,而PMA-qPCR测得值与理论添加值偏差较大。因此,本研究建立的方法较PMA-qPCR有明显的优势。
微生物在食品生产、储存、运输和销售的整个过程中处于动态变化中。如何实时监测微生物数量成为微生物控制的关键。本研究建立了一种灵敏度高、检测限低、精密度好的检测金黄色葡萄球菌活菌的方法,将为食品、水源环境中金黄色葡萄球菌进行大规模、高通量、多元化、快速检测提供了可能。
[1] 蒋原. 食源性病原微生物检测指南[M]. 北京:中国标准出版社, 2010:98-109.
[2] Fereidoun-Forghani, Taimour-Langaee, Mohammad-Eskandari, et al. Rapid detection of viableBacilluscereusemetic and enterotoxic strains in food by coupling propidium monoazide and multiplex PCR (PMA-mPCR)[J]. Food Control,2015,55:151-157.
[3] Inagaki T.H.F. Molecular quantification of environmental DNA using microfluidics and digital PCR[J].Systematic and Applied Microbiology,2012,35:390-395.
[4] Nocker A, Cheung C Y, Camper A K. Comparison of propidium monoazide with ethidium monoazide for differentiation of live vs. dead bacteria by selective removal of DNA from dead cells[J].J Microbiol Methods,2006,67:310-320.
[5] Nocker A, Sossa-Fernandez, Camper A.K, et al. Use of propidium monoazide for live/dead distinction in microbial ecology[J].Appl Environ Microbiol, 2007,73: 5111-5117.
[6] Cawthorn D M, Witthuhn R C. Selective PCR detection of viable Enterobacter sakazakii cells utilizingpropidium monoazide or ethidium bromide monoazide[J]. Appl Microbiol,2008,105:1178-1185.
[7] Alison S. Devonshire, Rebecca Sanders, Timothy M.Wilks,et al.Application of next generation qPCR and sequencing platforms to mRNA biomarker analysis[J]. Methods, 2013,(59):89-100.
[8] 赵素君,李江凌,谢晶,等. EMA-PCR检测金黄色葡萄球菌活菌的方法[J]. 中国兽医杂志,2013,9(43):25.
[9] 苏裕心,高珊,康琳,等. 荧光定量PCR快速检测金黄色葡萄球菌方法的建立[J]. 军事研究科学院院刊,2010,34(3):25-29.
Detection ofStaphylococcusaureusin Foods by PMA Combined with ddPCR
ZHAO Li-qing1, WANG Jing2, QIN Yan2, JIA Jun-tao1,JIANG Ying-hui1, TANG Jing1, ZHANG Jian1
(1.Technol.Ctr.,ShandongEntry-ExitInspect. &Quarant.Bur.,Qingdao266002;2.Technol.Ctr.,WeihaiEntry-ExitInspect. &Quarant.Bur.,Weihai264200)
Propidium monoazide (PMA) combined with droplet digital PCR (ddPCR) was used for testing liveStaphylococcusaureusin this study. The results showed that under strong light radiation for 15 min. made the covalent cross linkage between PMA and dead bacteria DNA to happen and free PMA to be deactivated simultaneously; The final PMA concentration of 2.0 μg/mL can effectively inhibit DNA PCR amplification of deadS.aureus; The highest PMA concentration that cannot inhibit DNA PCR amplification of liveS.aureuswas 5.0 μg/mL. Mixture of dead and liveS.aureusin different proportion, PMA-ddPCR can quantitatively detect live bacteria and avoid the interference of dead bacteria DNA. The detection limits of the method was 10 copy/20 μL. Using PMA-ddPCR to detect samples of artificial infected chicken, the minimum ofS.aureuscan be detected was 102cfu/mL. Suggested that PMA-ddPCR method had high sensitivity.
propidium monoazide (PMA); droplet digital PCR (ddPCR);Staphylococcusaureus
国家质检总局科研项目(2014IK114,2016IK198)
赵丽青 女,高级兽医师,硕士。主要研究方向为食品微生物研究。Tel:0532-80885629,E-mail:zlq3022@163.com
* 通讯作者。女,高级工程师,硕士。主要研究方向为食品微生物研究。 Tel:0631-3807388,E-mail:1094325001@qq.com
2016-03-11;
2016-05-05
Q93;TS207
B
1005-7021(2017)01-0105-05
10.3969/j.issn.1005-7021.2017.01.017

