酶法合成功能性低聚糖
李炳学, 牛 菲, 张 宁
(1.沈阳农业大学 土地与环境学院 土肥资源高效利用国家工程实验室,辽宁 沈阳 110866;2.沈阳农业大学 生物科学技术学院,辽宁 沈阳 110866)
·大家专版·
酶法合成功能性低聚糖
李炳学1, 牛 菲1, 张 宁2
(1.沈阳农业大学 土地与环境学院 土肥资源高效利用国家工程实验室,辽宁 沈阳 110866;2.沈阳农业大学 生物科学技术学院,辽宁 沈阳 110866)
功能性低聚糖具有无毒、无残留、稳定性强等特点,作为新型绿色添加剂被广泛应用在食品、饲料、医药行业。国际市场上10余种低聚糖产品中除大豆低聚糖、棉籽糖外,主要采用酶法制备。用于合成功能性低聚糖的酶包括糖苷酶、糖基转移酶和磷酸化酶。本文综述了功能性低聚糖种类、性质和制备方法,分析了酶法合成低聚糖的优缺点,阐述了磷酸化酶种类、催化特性和低聚糖产物。多酶法合成策略和目标酶的分子改造将是酶法合成功能性低聚糖的发展方向。
功能性低聚糖;酶法;磷酸化酶;合成
1 功能性低聚糖概述
国家轻工业局颁布的QB/T 2492-2000《功能性低聚糖通用技术规则》定义了功能性低聚糖的主要特征:由2~10 个相同或不同的单糖聚合而成;其具有糖类某些共同特性,可直接代替蔗糖,作为甜食配料,但不被人体胃酸、胃酶降解,不在小肠吸收,可到达大肠;具有促进人体双歧杆菌增殖等生理特性[1]。由于功能性低聚糖不被口腔、胃和小肠细菌降解和吸收,因而具有防治龋齿的作用,以及作为水溶性膳食纤维防止便秘的功能[2-3]。功能性低聚糖还具有降低血清胆固醇、增强机体免疫能力、抗肿瘤等功能[4]。功能性低聚糖具有无毒、无残留、稳定性强等特点,作为新型绿色添加剂被广泛应用于食品、饲料、医药行业[3-4]。
常见的功能性低聚糖有18种,其成分、自然界分布、制备方法和特性见表1。从成分上看,主要是2~6个单糖聚合而成。在自然界中功能性低聚糖主要分布在植物体内(蔬菜和农作物),动物源(甲壳类)和微生物源(海藻和真菌)比较少。天然提取适用于从甜菜甜蜜中提取棉籽糖、从大豆乳清中提取大豆低聚糖、从菌体中抽提黑曲霉低聚糖(例如黑曲霉二糖)等天然原料中含量多的低聚糖。然而,对于在天然原料中含量较低,且不带电荷、无色的低聚糖的提取却十分困难。因此,国际市场上10余种低聚糖产品中除大豆低聚糖、棉籽糖外,主要采用酶法制备。

表1 功能性低聚糖种类及性质

续表1
2 酶法制备功能性低聚糖
参与生成低聚糖的酶类主要有糖苷酶、糖基转移酶以及糖苷磷酸化酶。糖苷酶又称为糖基水解酶,以水解活性为主。水解糖苷键时不需要任何辅酶或辅因子[22]。表1中,纤维二糖、黑曲霉二糖、低聚异麦芽糖、龙胆低聚糖、菊粉低聚糖、低聚氨基葡萄糖、低聚半乳糖都是利用糖苷酶水解活性分解适宜的多糖底物产生低聚糖的。产物往往都是混合物,后续分离纯化比较困难,影响后续深入应用。
糖基转移酶能特异性地催化糖基从活性中间体(如UDP衍生物)转移到目标产物分子上[23-24],具有高度的选择性和催化效率,并且不会引起底物或产物的水解。在低聚糖合成中,糖基转移酶催化转移的糖分子与受体底物之间形成糖苷键,转移的糖分子中尤以单糖分子最为典型[25];核苷糖、糖分子均可作为糖基供体;作为受体的一般为糖分子,可以是单糖、二糖或三糖等。因转移的糖分子数量和受体的结构组成不同,致使形成的低聚糖为多种不同的低聚糖混合物[26]。果糖基转移酶、葡萄糖基转移酶、岩藻糖基转移酶均是利用转糖苷来合成低聚糖的。例如表1中的低聚果糖、异麦芽酮糖等。糖基转移酶多为膜结合蛋白,稳定性差,而且糖基供体(如UDPG)价格昂贵,这些特征也限制了糖基转移酶大规模合成低聚糖。
相比于糖苷酶和糖基转移酶,磷酸化酶可催化糖苷-1-磷酸和相应受体合成目的低聚糖。磷酸化酶的糖基供体(如Glc-1-P)比糖基转移酶的糖基供体(如UDPG)价格低,而且糖苷磷酸化酶不是膜结合蛋白,稳定性好。因此,糖苷磷酸化酶更适于规模化合成功能性低聚糖[27]。
磷酸化酶催化反应是双向可逆的,即可在非还原末端磷酸解低聚糖形成糖苷-1-磷酸和单糖[28],也能以糖苷-1-磷酸为供体,以糖为受体合成低聚糖[29]。基于氨基酸序列的相似性,磷酸化酶被归类于糖苷水解酶家族中的GH13、GH65、GH94、GH112和GH130家族,以及糖基转移酶中的GT4、GT35家族[30]。
多数磷酸化酶反应可逆、底物专一性强、产物单一[30]。基于可逆性这个特点,可用蔗糖磷酸化酶来磷酸解蔗糖产生葡萄糖-1-磷酸,后者作为供体经另一种磷酸化酶催化大量合成目标低聚糖,即双酶法催化普通低聚糖得到另一种低聚糖[31-36]。随着人们对细菌基因组研究的不断深入,越来越多的磷酸化酶序列被发现。在CAZy数据库中,目前已发现37种磷酸化酶。其中细菌25种(如nigerose phosphorylase、maltose phosphorylase等),真菌1种(trehalose phosphorylase),植物7种(如西葫芦中的α-1,4-glucan phosphorylase H等),动物4种(glycogen phosphorylase、liver glycogen phosphorylase、muscle glycogen phosphorylase和brain glycogen phosphorylase)(www.cazy.com)。
利用磷酸化酶合成低聚糖已经成为研究热点,目前已有13种低聚糖通过磷酸化酶大量合成(表2)。来自于GH13、GH65、GH94、GH112、GH130以及GT4家族的磷酸化酶,以β-D-Glc-1P、α-D-Man-1P、α-D-Glc-1P以及α-D-Gal-1P为糖基供体。另外,还有一些酶类已被证明是磷酸化酶,如GT35家族的Glycogen phosphorylase[46]、GH65家族的Trehalose-6-phosphate phosphorylase[47]、GH94家族的N,N′-Diacetylchitobiose phosphorylase[48]、GH130家族的β-1,4-Mannooligosaccharide phosphorylase[49]、GH94家族的Chitobiose phosphorylase[50-51]以及未知家族的β-1,3-Glucan phosphorylase[52]等。表2中,蔗糖[53]、麦芽糖、纤维糊精属于普通性低聚糖,海藻糖、纤维二糖、GNB/LNB、黑曲霉二糖属于功能性低聚糖,昆布二糖、D-Galactosyl-β-1,4-L-rhamnose、D-Mannosyl-β-1,4-D-glucosehe 3-O-α-D-Glucosyl-L-rhamnose的功能有待验证。
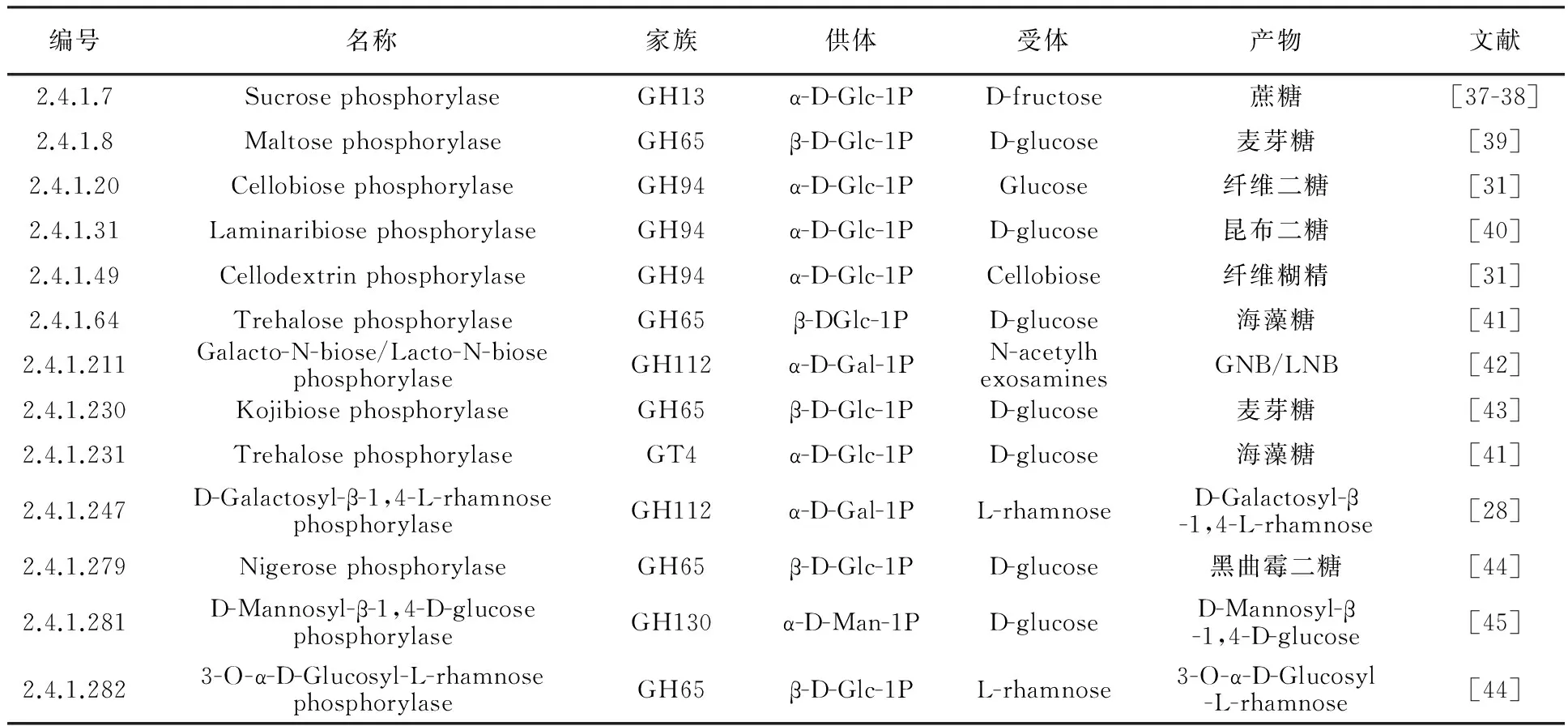
表2 磷酸化酶合成低聚糖
3 多酶法合成功能性低聚糖
GNB(Galacto-N-biose I)也称T-抗原二糖,是肠道细胞黏液糖蛋白糖链上的一个重要结构。LNB(Lacto-N-biose I)是I型核心糖链,也是人体肠道细胞糖链的组成部分。GNB 和LNB 被认为是双歧杆菌天然的营养来源。外源添加GNB 和LNB可以促进双歧杆菌增殖,调节肠道微生态[54]。因此,广阔的市场需要大规模合成GNB 和LNB。GNB一直以来是利用β-半乳糖苷酶和β-(1→3)-半乳糖苷转移酶进行合成的,然而这些合成方法却不能大规模生产GNB[45]。Mamoru Nishimoto等利用多酶法实现了GNB/LNB大尺度合成,底物是廉价的蔗糖和无机磷酸,5种酶通过大肠埃希菌异源表达获得[19]。合成步骤如下:蔗糖与无机磷酸在蔗糖磷酸化酶(Sp)的作用下[54],生成α-D-Glc-1P和D-fructose,接着α-D-Glc-1P和UDP-Gal在半乳糖苷转移酶的作用下生成Gal-1P和UDP-Glc[55],UDP-Glc在UDP葡糖己糖-1-磷酸尿苷酰基转移酶催化下完成了UDP-Gal再生[56],最后Gal-1P和GalNAc/GlcNAc在GLNBP(Galacto-N-biose/lacto-N-biose I 磷酸化酶)的作用下,生成GNB/LNB和Pi[19](图1)。由LNB合成范例可知,利用多酶体系和不同的磷酸化酶来催化廉价的底物从而大量合成目标低聚糖是可行的。多酶体系为酶法体外合成目标寡糖提供了思路,将体系中的GLNBP置换成其他的以Gal-1P为供体的磷酸化酶,配以相应的受体就能够合成目标寡糖。

图1 多酶法合成LNB和GNBFig.1 Multi-enzymatic synthesis of LNB and GNB
4 展 望
现有磷酸化酶催化反应类型少、催化效率低是限制其发展的瓶颈。利用易错PCR等分子进化技术改造酶分子结构,改变底物亲和力和催化效率,将是发展磷酸化酶法合成功能性低聚糖的有效途径[57-58]。利用糖基转移酶催化合成具有重要生理功能的糖蛋白和糖脂药物,将是糖工程领域发展的重要方向和新热点。组合利用磷酸化酶和糖基转移酶的多酶合成体系是提供糖基供体的有效途径。另外,从基因组和蛋白质组数据库中发掘新型糖基转移酶和磷酸化酶资源,也将为合成功能性低聚糖等糖工程产品奠定基础,支撑功能性低聚糖相关食品、医药产业发展。
[1] 谢海华,丁盛金,戴军,等.QB/T 2492-2000,中华人民共和国轻工行业标准功能性低聚糖通用技术规则, 2000.
[2] 张晓萍, 段钢. 功能性低聚糖酶法制备研究进展[J]. 食品与发酵工业,2011,37(4):159-165.
[3] Vera C, Cordova A,Aburto C,et al.Synthesis and purification of galacto-oligosaccharides:state of the art[J].World Journal of Microbiology & Biotechnology,2016,32(12):197.
[4] Krasnova L, Wong CH.Exploring human glycosylation for better therapies[J].Molecular Aspects of Medicine, 2016, 51(SI): 125-143.
[5] 毕金峰,刘长江. 低聚异麦芽糖的特性及其应用[J]. 粮油食品科技,2002,10(5):42-44.
[6] 张雪云. 功能性低聚糖的研究开发[J]. 饮料工业,2013,16(1):5-8,12.
[7] 周日尤,向春燕.低聚果糖的功能、应用、生产及发展前景[C].第十一届中国国际食品添加剂和配料展览会学术论文集,2007.
[8] 杨继远.大豆低聚糖保健功能及其在食品工业中的应用[J]. 食品工业科技,2008,(10):291-294.
[9] 唐淑芬,李伟,胡冰.乳酮糖研究进展[J].现代农业科学,2009,3(16): 49-50,65.
[10]李道义,江正强,韦赟,等. 低聚甘露糖的酶法制备、分离与结晶[J]. 食品科学,2005,26(S1):58-60.
[11]邵健,杨宇民. 低聚氨基葡萄糖的研制[J]. 中国医药工业杂志,1999,(11):481-483.
[12]侯东军,曾凡坤. 菊粉低聚糖生产的研究进展[J]. 中国食品添加剂,2003,(5):88-90.
[13]陈昱,王丽娜,昌盛,等. 菊粉低聚糖的工艺优化研究[J]. 食品科技,2012,(4):238-240.
[14]王媛媛,郭文斌,王淑芳,等. 褐藻寡糖的生物活性与应用研究进展[J]. 食品与发酵工业,2010,(10):122-126.
[15]朱婧,覃拥灵,陈桂光.β-葡萄糖苷酶高产菌株的选育及酶法转化葡萄糖生产龙胆低聚糖[J].食品与发酵工业,2010,36(4):21-24,27.
[16]梁丽心.功能性低聚糖——水苏糖[J].中国食品添加剂,2004,(4):51-54.
[17]周冬丽,宋伟光,郭文峰,等. 棉籽低聚糖——棉籽糖研究概况[J]. 粮食与油脂,2010,(12):39-41.
[18]苏雪梅.帕拉金糖的生产工艺及市场分析[J]. 轻工科技,2012,(4):1-2.
[19]Mamoru Nishimoto, Motomitsu Kitaoka.One-pot enzymatic production of β-D-galactopyranosyl-(1→3)-2-acetamido -2-deoxy-D-galactose (galacto-N-biose) from sucrose and 2-acetamido-2-deoxy-Dgalactose (N-acetylgalactosamine)[J].Carbohydrate Research,2009,(344):2573-2576.
[20]彭亚锋,周耀斌,李勤,等. 海藻糖的特性及其应用[J]. 中国食品添加剂,2009,(1):65-69.
[21]Kyung-MoSong,Jae-Hoon Shim,Jong-Tae Park.Transglycosylation properties of maltodextrin glucosidase (MalZ) fromEscherichiacoliand its application for synthesis of a nigerose-containing Oligosaccharide[J]. Biochemical and Biophysical Research Communications,2010,(397):87-92.
[22]Danby PM, Withers SG. Advances in Enzymatic Glycoside Synthesis[J].Acs Chemical Biology, 2016, 11(7): 1784-1794.
[23]Petschacher B, Nidetzky B.Biotechnological production of fucosylated human milk oligosaccharides: Prokaryotic fucosyltransferases and their use in biocatalytic cascades or whole cell conversion systems[J].Journal of Biotechnology, 2016, 235 (SI): 61-83.
[24]Monica M Palcic.Glycosyltransferases as biocatalysts[J].Current Opinion in Chemical Biology, 2011, 15:226-233.
[25] Lairson L L,Henrissat B,Davies G J,et al.Glycosyltransferases: structures, functions and mechanisms[J]. Annu Rev Biochem, 2008, 77: 521-555.
[26]Hill A,Tian F,Karboune S.Synthesis of Levan and Fructooligosaccharides by Levansucrase: Catalytic, Structural and Substrate-Specificity Properties[J].Current Organic Chemistry,2017,21(2): 149-161.
[27] Luley-Goedl C,Nidetzky B.Carbohydrate synthesis by disaccharide phosphorylases: reactions, catalytic mechanisms and application in the glycosciences[J]. Biotechnol.J, 2010,5:1324-1338.
[28]Masahiro Nakajima, Mamoru Nishimoto, Motomitsu Kitaoka. Characterization of D-galactosyl-β1→4-L-rhamnose phosphorylase fromOpitutusterrae[J]. Enzyme and Microbial Technology, 2010,(46):315-319.
[29]Hiroyuki Nakai, Motomitsu Kitaoka, Birte Svensson, et al.Recent development of phosphorylases possessing large potential for oligosaccharide synthesis[J].Current Opinion in Chemical Biology, 2013,(17):301-309.
[30]Cantarel BL, Coutinho PM, Rancurel C,et al. The Carbohydrate-Active EnZymes database (CAZy): an expert resource for glycogenomics[J]. Nucleic Acids Res, 2009,(37):D233-D238.
[31]Nakai H, Hachem M A,Petersen B O, et al. Efficient chemoenzymatic oligosaccharide synthesis by reverse phosphorolysis using cellobiose phosphorylase and cellodextrin phosphorylase fromClostridiumthermocellum[J].Biochimie,2010,(92):1818-1826.
[32]Sawangwan T, Goedl C, Nidetzky B. Single-step enzymatic synthesis of (R)-2-O-α-D-glucopyranosyl glycerate,a compatible solute from micro-organisms that functions as a protein stabiliser[J]. Org Biomol Chem,2009,7:4267-4270.
[33]Nakai H, Dilokpimol A, Abou Hachem M, et al.Efficient one-pot enzymatic synthesis of a-(1→4)-glucosidic disaccharides through a coupled reaction catalysed byLactobacillusacidophilusNCFM maltose phosphorylase[J]. Carbohydr Res, 2010,345:1061-1064.
[34]Hidaka M, Nishimoto M, Kitaoka M,et al. The crystal structure of galacto-N-biose/lacto-N-biose I phosphorylase: a large deformation of a TIM barrel scaffold[J]. J Biol Chem, 2009, 284:7273-7283.
[35]Ohdan K, Fujii K, Yanase M, et al. Enzymatic synthesis of amylose[J].Biocatal Biotransform, 2006, 24:77-81.
[36]Suzuki M, Kaneda K, Nakai Y,et al. Synthesis of cellobiose from starch by the successive actions of two phosphorylases[J]. New Biotechnol, 2009, 26:137-142.
[37]Min Hye Shin a, Min Woo Jung a, Jong-Hoon Lee, et al. Strategies for producing recombinant sucrose phosphorylase originating from Bifidobacterium longum inEscherichiacoliJM109[J]. Process Biochemistry, 2008,(43): 822-828.
[38]秦文信,宾力. 蔗糖的功能与人体健康[J]. 中国食物与营养,2005,(12):48-50.
[39]Kazuo Aisaka,Tomomi Masuda,Tadashi Chikamune. Properties of Maltose Phosphorylase fromPropionibacteriumfreudenreichii[J].Journl of Fermentation and Bioengineering,1996,82(2):121-173.
[40]Takanori Nihira, Yuka Saito, Motomitsu Kitaoka, et al.Characterization of a laminaribiose phosphorylase fromAcholeplasmalaidlawiiPG-8A and production of 1,3-β-D-glucosyl disaccharides[J].Carbohydrate Research, 2012,361:49-54.
[41]Kazuhiko Maruta, Hikaru Watanabe, Tomoyuki Nishimoto. Acceptor Specificity of Trehalose Phosphorylase fromThermoanaerobacterbrockii: Production of Novel Nonreducing Trisaccharide,6-O-α-D-Galactopyranosyl Trehalose[J]. Journal of bioscience and bioebgineering,2006,101(5):385-390.
[42]Takumi Satoh, Toshitaka Odamaki, Mariko Namura,et al. In vitro comparative evaluation of the impact of lacto-N-biose I,a major building block of human milk oligosaccharides, on the fecal microbiota of infants[J]. Anaerobe,2013,19:50-57.
[43]Hiroto Chaen,Tomoyuki Nishimoto,Tetsuya Nakada.Enzymatic Synthesis of Kojioligosaccharides Using Kojibiose Phosphorylase[J].Journal of bioscience and bioengineering,2001,92(2):177-182.
[44]Takanori Nihira, Hiroyuki Nakai, Motomitsu Kitaoka.3-O-a-D-Glucopyranosyl-L-rhamnose phosphorylase fromClostridiumphytofermentans[J].Carbohydrate Research, 2012,350:94-97.
[45]Senoura T, Ito S, Taguchi H,et al. New microbial mannan catabolic pathway that involves a novel mannosylglucose phosphorylase[J]. Biochem Biophys Res Commun, 2011, 408:701-706.
[46]Watson KA, McCleverty C, Geremia S, et al. Phosphorylase recognition and phosphorolysis of its oligosaccharide substrate: answers to a long outstanding question[J]. EMBO J, 1999, 18:4619-4632.
[47]Andersson U, Levander F, Radstrom P. Trehalose-6-phosphate phosphorylase is part of a novel metabolic pathway for trehalose utilization inLactococcuslactis[J]. JBiol Chem, 2001,276:42707-42713.
[48]Park JK, Keyhani NO, Roseman S. Chitin catabolism in the marine bacterium Vibrio furnissii. Identification, molecular cloning, and characterization of an N,N-diacetylchitobiose phosphorylase[J]. J Biol Chem, 2000, 275:33077-33083
[49]Kawahara R, Saburi W, Odaka R, et al. Metabolic mechanism of mannan in a ruminal bacterium,Ruminococcusalbus, involving two mannoside phosphorylases and Cellobiose 2-epimerase: discovery of a new carbohydrate phosphorylase, β-1,4-mannooligosaccharide phosphorylase[J]. J Biol Chem, 2012, 287:42389-42399.
[50]Hidaka M, Honda Y, Kitaoka M,et al. Chitobiose phosphorylase from Vibrio proteolyticus, a member of glycosyl transferase family 36, has a clan GH-L-like (a/a)6 barrel fold[J]. Structure,2004, 12:937-947.
[51]Syson K, Stevenson CE, Rejzek M, et al. Structure of Streptomyces maltosyltransferase GlgE, a homologue of a genetically validated anti-tuberculosis target[J]. J Biol Chem, 2011, 286:38298-38310.
[52]Hiroyuki Nakai, Motomitsu Kitaoka, Birte Svensson.Recent development of phosphorylases possessing large potential for oligosaccharide synthesis[J].Current Opinion in Chemical Biology, 2013, 17:301-309.
[53]邹丽娟. 功能性寡糖在畜牧兽医上的应用[J]. 肉类研究,2009,(2):48-52.
[54]Jin-Ha Lee,Seung-Heon Yoon, Seung-Hee Nam. Molecular cloning of a gene encoding the sucrose phosphorylase fromLeuconostocmesenteroidesB-1149 and the expression inEscherichiacoli[J].Enzyme and Microbial Technology, 2006,39(4): 612-620.
[55]Ramandeep Singh, Babu R. Thapa, Gurjit Kaur. Biochemical and molecular characterization of GALT gene from Indian galactosemia patients: Identification of 10 novel mutations and their structural and functional implications[J]. Clinica Chimica Acta, 2012,(414):191-196.
[56]Marc R. Lake, Cynthia L. Williamson, Robert D. Slocum.Molecular cloning and characterization of a UDP-glucose-4-epimerase gene (galE) and its expression in pea tissues[J]. Plant Physiology and Biochemistry, 1998,36(8):555-562.
[57]Muller M,Nidetzky B.The role of Asp-295 in the catalytic mechanism ofLeuconostocmesenteroidessucrose phosphorylase probedwith site-directed mutagenesis[J]. Febs Letters, 2007, 581(7): 1403-1408.
[58]Schwarz A,Nidetzky B. Asp-196→Ala mutant of Leuconostoc mesenteroides sucrose phosphorylase exhibits altered stereochemical course and kinetic mechanism of glucosyl transfer to and from phosphate[J]. Febs Letters, 2006, 580(16): 3905-3910.
Enzymatic Synthesis of Functional Oligosaccharides
LI Bing-Xue1, NIU Fei1, ZHANG Ning2
(1.CollegeofLandandEnvironment,ShenyangAgriculturalUniversity,Liaoning,Shenyang, 110866;2.CollegeofBiologicalScienceandTechnology,ShenyangAgriculturalUniversity,Liaoning,Shenyang, 110866)
Functional oligosaccharide is endowed with the features of non-toxic, no residue and strong stability, as a new pollution-free additive widely used in food, feed, pesticide and fertilizer industries. More than ten kinds of oligosaccharide produced by enzymatic preparing methods in the international market with exception for soy oligosaccharides, cottonseed sugar. Glycosidase, glycosyltransferase and phosphorylase are usually used for the preparation of functional oligosaccharides. Here, we review the types of functional oligosaccharides, properties and preparation methods, and analyze the advantages and disadvantages of enzymatic synthesis of oligosaccharides, elaborated the phosphorylase categories, catalytic properties and oligosaccharides product systematically. Enzymatic synthesis strategy and target enzyme molecule modification will be the development direction of enzymatic synthesis of functional oligosaccharides in the future.
Functional oligosaccharides; Enzymatic; Phosphorylase; Synthesis
国家自然科学基金项目(31271818);中国博士后科学基金项目(2012M510836,2013T60299)
李炳学 男,博士,教授,硕士生导师。主要从事微生物生理与分子遗传方面研究。
Tel:024-88487155,E-mail: libingxue1027@163.com
2017-02-01
李炳学,男,博士,教授,硕士生导师,沈阳农业大学土地与环境学院微生物学科负责人、副院长,辽宁省法库县科技顾问。1995年毕业于辽宁师范大学生物技术专业,2009年获得中国农业大学微生物学博士学位。2006年晋升为副教授,2015年晋升为教授。联合国大学—麒麟学者(UNU-KIRIN Fellow,2010.3~2011.3),在日本国立食品综合研究所酶学实验室合作研究。现任辽宁省微生物学会常务理事、辽宁省土壤学会理事、国际人和动物真菌学会(ISHAM)黑酵母工作组会员、《微生物学杂志》编委。为辽宁省科技特派员,2012年起学校派驻法库县科技顾问,筹建院士工作站和新农村发展研究院法库综合服务站,实现校地深入合作共赢。荣获校新农村发展研究院2012年先进个人。主持获得沈阳农业大学教学成果一等奖1项;辽宁省教学成果三等奖1项;主持辽宁省教育厅教学改革课题2项;副主编教材2部,参编教材3部。获得硕士研究生校级优秀毕业论文指导教师3次。沈阳农业大学十佳青年教职工,沈阳农业大学三育人标兵。主持科研课题12项:国家自然科学基金面上项目1项,中国博士后科学基金特别资助1项,中国博士后科学基金面上项目1项,联合国大学访问学者基金1项,沈阳市科技创新专项资金1项,糖化学与生物技术教育部重点实验室开放课题1项,沈阳市农业科技共建项目1项,沈阳市农业综合开发项目3项,辽宁省转基因专项子课题1项,沈阳农业大学博士后科学基金1项。在Gene、Applied Microbiology and Biotechnology、Journal of Pure and Applied Microbiology、Journal of Applied Glycoscience、Microbial Cell Factories、Journal of microbiology and biotechnology、环境科学、食品科学、微生物学报、微生物学通报和微生物学杂志等中英文期刊发表研究论文20余篇。
Q936
A
1005-7021(2017)01-0001-06
10.3969/j.issn.1005-7021.2017.01.001

