1株产纤维素酶细菌的筛选、鉴定及生长特性
何 楠, 令利军, 冯 蕾, 苏 敏, 姚彦敏, 宋雪梅
(西北师范大学 生命科学学院,甘肃 兰州 730070)
1株产纤维素酶细菌的筛选、鉴定及生长特性
何 楠, 令利军*, 冯 蕾, 苏 敏, 姚彦敏, 宋雪梅
(西北师范大学 生命科学学院,甘肃 兰州 730070)
分离筛选高效降解纤维素的菌株,并研究其生物学特性。利用刚果红染色法从腐烂的玉米秸秆中分离纤维素降解菌,再通过测定滤纸的降解率及多种酶活复筛。综合考虑水解圈和菌落直径(HC值),滤纸的降解率和酶活,对所筛选的菌株进行纤维素降解能力综合评价,最终获得1株具有纤维素降解能力的菌株DX4,其滤纸酶活(FPA酶活)、内切葡聚糖酶活力(CMC酶活)和外切葡聚糖酶活力(Cex酶活)分别为256.051、358.276和5.536 U/mL。结合形态学、生理生化特性和分子生物学鉴定,将该菌株鉴定为枯草芽胞杆菌(Bacillussubtilis),命名为BacillussubtilisDX4,简称BS-DX4。研究表明,BS-DX4的最适生长温度为40 ℃,最适生长pH为7.0,低盐浓度下生长旺盛,是具有开发潜力的纤维素酶高产菌株。
纤维素降解菌;鉴定;纤维素酶活;枯草芽胞杆菌;生长特性
由于地球化石燃料资源的大量减少,众多研究者将眼光投向了通过光合作用大量产生的自然资源——纤维素[1]。纤维素是地球上最大的可再生资源,是自然界中分布最广、含量最多的一种复杂的多糖,由8 000~10 000个葡萄糖残基通过β-1,4糖苷键相连而成,但是目前只开发了1%~2%[2-6]。纤维素酶可用于降解天然纤维素材料,从而产生纤维乙醇等物质[7],纤维素酶是一组可协同降解纤维素的多酶体系,由内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶三种组分组成[8]。不同菌种分泌的纤维素酶的三种组分比例不同,故其发挥作用的活性也有很大区别。纤维素酶的来源广泛,在真菌、放线菌、细菌中均有发现[9-11],放线菌纤维素酶产量低,研究较少;相对于真菌,细菌生长迅速,分泌酶种类丰富,更利于酶协同降解纤维素[12],同时细菌更易适应环境,所分泌的酶也更加稳定[13]。酶法降解纤维素具有高效性和环境友好性,本研究从自然发酵的玉米秸秆中筛选产纤维素酶菌株,转化得到的小分子多糖可以进一步发酵成乙醇,这也为生产可持续能源指明了方向[14]。纤维素酶已经逐渐应用于日用化工、食品发酵、工业洗涤及医药等行业中[15-18]。纤维素酶产生菌是生产纤维素酶产品的最有效的方式之一。工业应用纤维素酶由于成本过高,酶活性不稳定等缺点,应用受到一定的限制。寻找高效产酶特性的菌株,分离出高效酶活性的纤维素酶一直是人们的研究重点。
1 材料与方法
1.1 材料
1.1.1 样品来源 采自自然发酵中的玉米秸秆,于4 ℃冰箱中保存待用。
1.1.2 培养基(g/L) 富集培养基[19]:KH2PO42,(NH4)2SO41.4,MgSO4·7H2O 0.3,CaCl20.3,FeSO4·7H2O 0.005,CMC-Na 5,葡萄糖 2.5,蛋白胨1,蒸馏水1 L;筛选培养基[20]:CMC-Na 5,KCl 0.5,FeSO4·7H2O 5,KH2PO40.5,MgSO4·7H2O 0.3,NaNO33,琼脂14,蛋白胨 1,蒸馏水1 L;液体产酶发酵培养基[20](略有改动):蛋白胨3,酵母膏0.5,(NH4)2SO42, KH2PO44,CaCl2·2H2O 0.3, MgSO4·7H2O 0.3, CMC-Na 10,蒸馏水1 L;赫奇逊氏无机盐培养基:KH2PO41.0,NaCl 0.1,MgSO4·7H2O 0.3,NaNO32.5,FeCl30.001,CaCl20.1,蒸馏水 1 L;保藏培养基:牛肉膏蛋白胨培养基[21]。
1.1.3 药品及仪器 化学药品均为分析纯;分子生物学试剂购于Takara;超净工作台(苏净安泰),电热鼓风干燥箱(上海博讯,GZX-9030MBE),紫外分光光度计(上海昂拉,EU-2600),高压灭菌锅(北京中西,YXQ-SG46-280S),水浴锅(科伟,HH-2型),恒温摇床(上海天呈,TS-100C),PCR仪(杭州郎基,L96+/Y)。
1.1.4 试剂 1 mg/mL的葡萄糖标准液;DNS试剂;磷酸氢二钠-柠檬酸缓冲液(pH 4.8);1% CMC-Na溶液;1 mg/mL刚果红溶液;脱淀粉滤纸条。
1.2 方法
1.2.1 菌种的分离与纯化 取样品1 g于含有50 mL富集培养基的250 mL三角瓶中, 28 ℃、200 r/min震荡培养48 h。将富集后的培养液按10-1、10-2、10-3、10-4、10-5做梯度稀释,取浓度较小的3个稀释菌液涂布平板,待菌落长出后,用 1 mg/mL的刚果红染液染色15 min,再用1 mol/L的NaCl脱色25 min。测量水解圈大小和菌落直径,计算水解能力,最后根据透明圈的大小选取高产酶菌株。挑取所选菌落划线,28 ℃倒置培养,直到获得单菌落为止。
1.2.2 滤纸的降解 参照许玉林等[22]的方法,略有改动。按照3%的接种量,将培养12 h后种子液接入赫奇逊氏无机盐培养基,做后续研究。
1.2.3 粗酶液的制备 挑取经划线培养的单菌落于50 mL液体产酶发酵培养基,30 ℃、200 r/min震荡培养3 d,获得的发酵液在4 ℃、8 000 r/min离心10 min,上清液即为粗酶液,用于酶活力的测定。
1.2.4 酶活力测定 ①葡萄糖标准曲线的制作:用已配制好的1 mg/mL的葡萄糖溶液作母液,参照表1绘制葡萄糖标准曲线。②CMC、Cex、FPA酶活力测定:参照冯健玲等[23]的做法,略作改动。a.内切葡聚糖酶(CMC)活力的测定:在20 mL的试管中(1支对照管,3支实验管)加入0.5mL稀释好的粗酶液,将空白管置于沸水浴中10 min灭活,取出后与样品管均加入1.5 mL CMC-Na 柠檬酸缓冲液,45 ℃保温30 min后沸水浴10 min灭活,加入3 mL DNS试剂沸水浴7 min后取出,迅速冷却至室温,定容至10 mL,于540 nm处测定其吸光值。b.外切葡聚糖酶(Cex)活力的测定:在20 mL的试管中(1支对照管,3支实验管)加入0.5 mL稀释好的粗酶液,将空白管置于沸水浴中10 min灭活,取出后与样品管均加入1.5 mL 0.05 mol/L 柠檬酸缓冲液,并加入0.1 g脱脂棉,45 ℃保温24 h,显色过程及测定与CMC酶活测定方法一致。于540 nm处测定其吸光值。c.滤纸酶(FPA)活力的测定:在20 mL的试管中(1支对照管,3支实验管)加入0.5 mL稀释好的粗酶液,将空白管置于沸水浴中10 min灭活; 以上4支管中分别加入1.5 mL 0.05 mol/L的柠檬酸缓冲液和0.05 g无淀粉滤纸条,45 ℃保温1 h,显色过程及测定与CMC酶活测定方法一致。于540 nm处测定其吸光值。
酶活力的定义:在 45 ℃条件下,1 mL酶液每分钟水解底物生成1 μg葡萄糖的酶量,称为一个酶活单位,以U/mL表示。
酶活力E=1 000×S×N/(T×V)
其中,E:样品的酶活力(U/mL);S:由样品的平均吸光值在标准曲线上相对应的葡萄糖含量(mg);N:粗酶液的稀释倍数;1 000:mg与μg之间的换算倍数;T:反应时间(min);V:参与反应的粗酶液体积(mL)。

表1 葡萄糖标准曲线
1.2.5 菌株的鉴定 ①形态观察及生理生化特性:参照《伯杰氏菌手册》[24]、《常见细菌系统鉴定手册》[25]观察菌株的培养形态、革兰染色并测定其生理生化特征。②分子生物学鉴定:采用菌落PCR方法,冷热交替获取分离菌株的DNA,以此为模板,用27F(5′-AGAGTTTGATCCTGGCTCAG-3′),1492R(5′-GGTTACCTTGTTACGACTT-3′)为引物,进行16S rDNA的PCR扩增。扩增体系为50 μL(PremixTaq25 μL,模板DNA 5 μL,27F 1 μL,1492R 1 μL,ddH2O 18 μL)。扩增条件为95 ℃ 5 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,循环30次;72 ℃ 10 min。PCR产物送华大基因公司测序。测序结果在NCBI上通过BLAST程序与已知16S rDNA序列进性同源性比较及分析,用MEGA 6.0软件中的邻接法(Neighbor-Joining)聚类分析,并构建系统发育树[26]。
1.2.6 DX-4菌株的生长特性分析 参照令利军等[27]、陈美标等[28]的方法,略作改动。①生长曲线的制作:以体积分数为0.8%的接种量将培养过夜的DX4种子液接入液体NA培养基,32 ℃、160 r/min振荡培养,每隔2 h取样,在600 nm处测吸光值,以未接种的NA培养基作为对照。②最适生长温度的测定:将培养过夜的DX4菌株种子液以体积分数为0.8%的接种量接入液体NA培养基中,分别置于15、20、24、28、32、36、40、44、50、55、60 ℃下160 r/min振荡培养,12 h后取样,在600 nm处测其吸光值,以未接种的液体NA培养基作为对照。③最适生长pH测定:将培养过夜的DX4菌株种子液以体积分数为0.8%的接种量接入pH值分别为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0的液体NA培养基中,32 ℃、160 r/min振荡培养,12 h后取样,在600 nm处测其吸光值,以未接种的液体NA培养基为对照。④耐盐性测定:将培养过夜的DX4菌株种子液以体积分数为0.8%的接种量接入NaCl质量分数分别为1%、2%、3%、4%、5%、5.5%、6%、6.5%、7%、7.5%、8%、9%、10%的液体NA培养基中,32 ℃、160 r/min振荡培养,12 h后取样,在600 nm处测其吸光值,以未接种的液体NA培养基为对照。
2 结果与分析
2.1 菌株的初筛
从秸秆中初步筛选得到具有纤维素降解能力的细菌9株,纯化降解能力强的菌株。测定透明圈直径(H)和菌落直径(C),根据透明圈直径与菌落直径比值的大小,最终筛选出4株产酶量相对较高的菌株,编号为DX1~DX4,结果见表2、图1。其中DX4对滤纸降解能力最强。
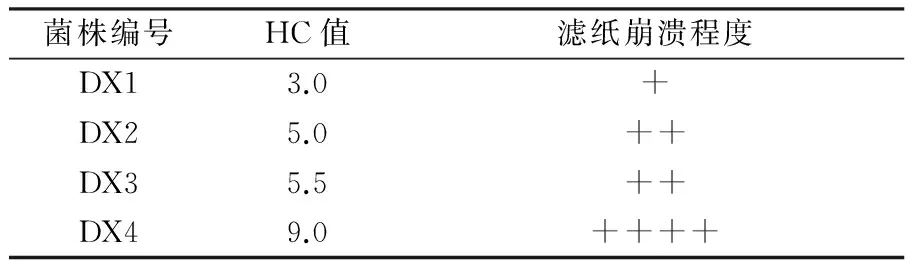
表2 各菌株的HC值及滤纸降解情况
注:“+”表示滤纸崩溃程度,“+” 越多滤纸降解程度越高

图1 刚果红染色后呈现的酶水解纤维素透明圈Fig.1 Transparent hydrolysis circle by Congo red staining
2.2 酶活力测定
2.2.1 葡萄糖标准曲线 由图2可见,标准曲线y=0.7515x-0.1384,线性相关系数R2为0.999 25,线性良好,可以用于纤维素酶活测定。
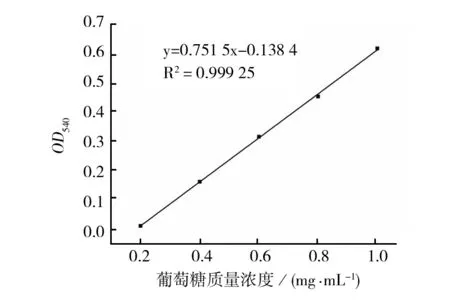
图2 葡萄糖标准曲线Fig.2 Standard curve of glucose
2.2.2 各菌株的酶活 按1.2.4中②方法测定4种菌株的CMC、FPA、Cex酶活性,结果见表3。由表3可知,各菌株都具有一定的产纤维素酶能力,菌株DX4虽对天然滤纸的降解能力不是最强,但综合分析,其产酶能力较强,酶活均相对高于其他菌株,是一株优势菌株,所以选其作为目的菌株,并进行下一步的研究。
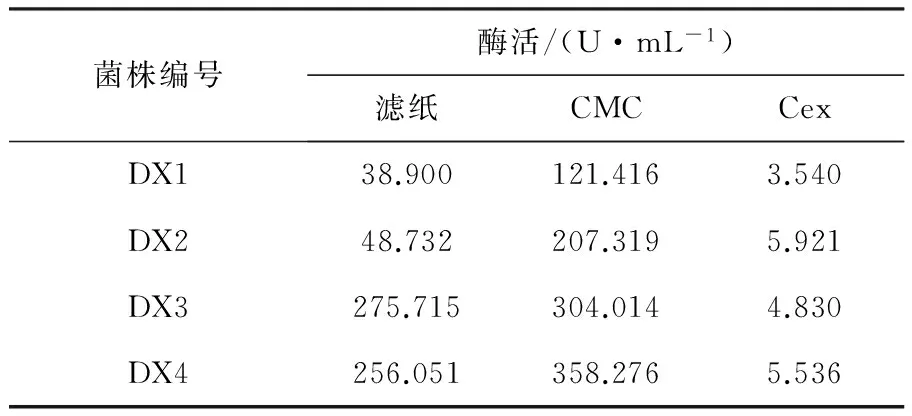
表3 纤维素酶活力
2.3 菌株的鉴定
2.3.1 菌株的形态及生理生化鉴定 菌株DX4在LB固体培养基上培养12 h后,形成1.5 mm左右的菌落,菌落呈圆形,表面光滑,边缘不整齐,乳黄色,不透明;扫描电镜观察为棍棒状,大小为(0.40~0.48) μm×(2.00~2.20) μm(图3)。菌株DX4生理生化鉴定表明,该菌为革兰阳性菌,吲哚实验显阴性,明胶水解和V-P反应显阳性,具体特征见表4。

图3 菌株DX4扫描电镜图Fig.3 The SEM picture of strain DX4

测定指标结果测定指标结果接触酶+淀粉水解+明胶液化+马尿酸钠-甲基红-V-P测定+棉子糖+山梨醇+
2.3.2 分子生物学鉴定 以菌株DX4 DNA为模板,进行16S rRNA PCR扩增,获得1个约1.5 kb的PCR产物;将PCR产物经试剂盒纯化后送华大基因公司测序,所得序列长度为1 398 bp,并提交至NCBI (Access Number: KU200944) 。将测序结果在NCBI进行BLAST同源性比对,选取同源性较高的结果采用MEGA6.0构建系统发育树,如图4所示。测序结果比对显示,菌株DX4与芽胞杆菌属16S rRNA相似度高。
结合形态学、生理生化指标和16S rRNA序列综合分析,将菌株DX4初步定为枯草芽胞杆菌(Bacillussubtilis),命名为BacillussubtilisDX4,简称BS-DX4。

图4 DX4菌株的系统进化树Fig.4 Phylogenetic tree of strain DX4
2.4 菌株BS-DX4的生长特性
2.4.1 生长曲线 由图5可知,0~10 h内细菌数目稳定,繁殖较少,处于调整期,为细菌的分裂增殖储备充足的物质和能量;8~20 h内细菌数目呈几何级数快速增长,处于对数期;20~40 h内细菌数目较为平坦,处于稳定期,但细菌群体活力变化较大,产生相应的代谢产物,如纤维素酶;40 h后逐渐进入衰亡期。菌株处于稳定期时间较长,表明其生长较为旺盛。
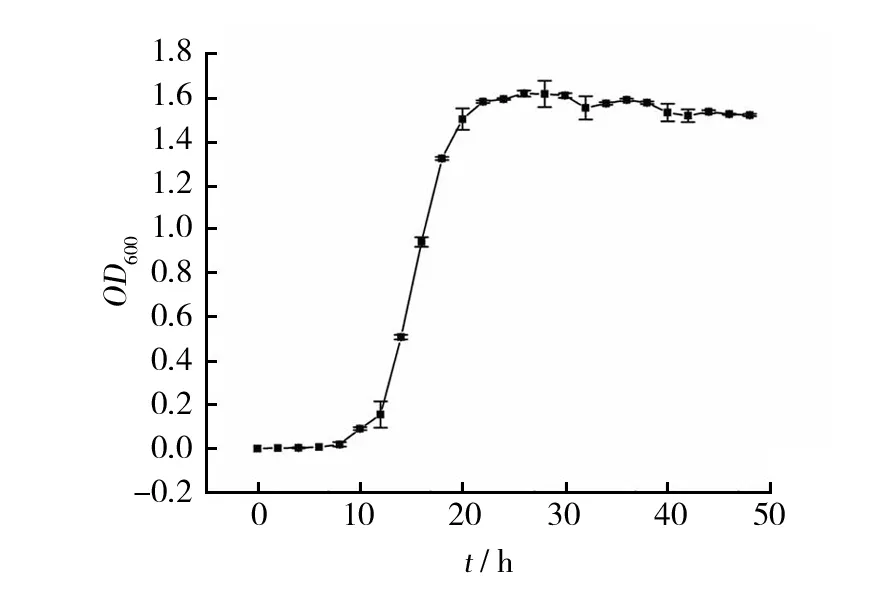
图5 BS-DX4菌株的生长曲线Fig.5 The growth curve of strain BS-DX4
2.4.2 最适生长温度 环境温度的高低会影响细菌的生化反应速率,从而影响其生长速率。在不同温度下,BS-DX4菌株生长不同, 15~60 ℃内均可生长(图6),最适生长温度为40 ℃。
2.4.3 最适生长pH pH会影响微生物对环境中营养物质的吸收,由图7可知,培养基的pH对菌株BS-DX4的生长有明显影响,在pH 4.0~8.5间均可生长。pH 5.5~8.0范围内,菌株生长良好,最适生长pH为7.0。
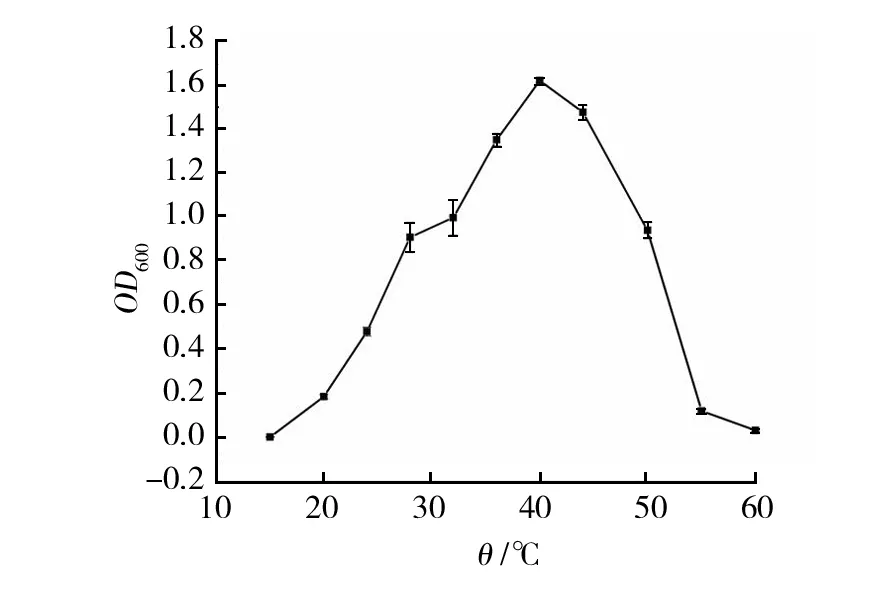
图6 温度对菌株BS-DX4生长的影响Fig.6 The effects of temperature on the growth of strain BS-DX4
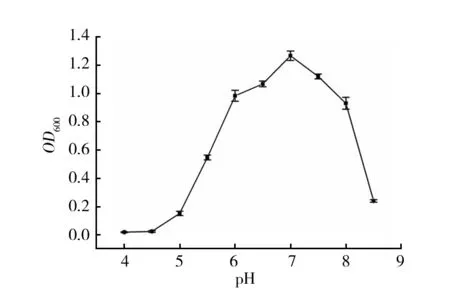
图7 pH对菌株BS-DX4生长的影响
2.4.4 耐盐性能 盐浓度对于维持菌体渗透压较为重要,环境中存在适度的盐有利于微生物生长,但盐浓度过高会产生不利影响。图8中,与不添加NaCl相比,在NA培养基中加入不同质量分数的NaCl对菌株的生长均有一定的影响,在培养基中加入质量分数较低的NaCl,菌株BS-DX4可正常生长;高质量分数的NaCl抑制菌株BS-DX4的生长。

图8 不同质量分数的NaCl对菌株BS-DX4生长的影响Fig.8 The effects of different mass fraction of NaCl on the growth of strain BS-DX4
3 讨 论
纤维素降解菌广泛存在于自然界中,可分泌纤维素酶的细菌较少,而细菌分泌的酶又以内切葡聚糖酶产量最高,且酶的最适pH一般为中性至偏碱性。近年来,随着中性纤维素酶和碱性纤维素酶在棉织品水洗整理及洗涤剂工业中的成功应用,细菌纤维素酶制剂已经显示出良好的应用前景。
乐文民等[29]在优化了一株产中性纤维素酶的芽胞杆菌属细菌,发现其CMC酶活最大可达到194.23 U/mL;黄河等[30]分离得到一株耐酒精纤维素酶产生菌,其最大CMC酶活为158.54 U/mL;吴翔等[31]纤维素降解菌DBJ的CMC最大酶活为57.85 U/mL。本实验所筛选的菌株BS-DX4属于芽胞杆菌属,与枯草芽胞杆菌(Bacillussubtilis)生理生化特征相似,其CMC酶活可达358.276 U/mL。进一步测定其生长特性,发现菌株BS-DX4的最适生长温度为40 ℃,最适生长pH为7.0,可生长温度与pH范围较广。芽胞杆菌具有耐碱、耐酸、耐高温等方面的明显优势,便于实际操作和工业生产[9]。我们研究从腐烂的玉米秸秆中分离得到的菌株的生理特性,有利于后续研究其最佳发酵条件,进而确定菌株BS-DX4分解秸秆的能力。若能将该菌株应用于发酵天然纤维素,如农作物秸秆或其他木材中的纤维素,转化为燃料等可利用资源,对实现经济的可持续发展、减轻化石燃料对环境的负面影响以及维持生态平衡有着重要的意义[32]。
[1] 周晓静. 碱性纤维素酶产生菌的筛选、酶基因克隆及在大肠杆菌中的表达研究[D]. 济南: 山东大学, 2010.
[2] 何京. 人类社会的新能源—生物质能[J]. 广西节能, 2005,(1):35-36.
[3] Hasunuma T, Okazaki F, Okai N. A review of enzymes and microbes for lignocellosic biorefinery and the possibility of their application to consolidated bioprocessing technology[J]. Bioresource Technology, 2013, 135(39):513-522.
[4] Linkins A E, Sinsabaugh R L, Mcclaugherty C A, et al. Cellulase activity on decomposing leaf litter in microcosms[J]. Plant and Soil, 1990, 123(1):17-25.
[5] Zhang Y H. Reviewing the carbohydrate economy via multi-product lignocellulose biorefineries[J]. Journal of industrial microbiology & biotechnology, 2008, 35(5):367-375.
[6] Emsley A M. Cellulosic ethanol reignites the fire of cellulose degradation cellulose[J]. Cellulose, 2008, 15(2): 187-192.
[7] Arnold L D, Michael Newcomb, J.H.David Wu. Cellulase, clostridia, and ethanol [J].Microbiology and molecular Biology Reviews,2005,69(1):124-154.
[8] 颜淑芳. 纤维素酶产生菌的选育鉴定及产酶性能研究[D]. 南昌: 南昌大学,2010.
[9] 陈丽燕, 张光祥, 黄春萍, 等. 两株高产纤维素酶细菌的筛选、鉴定及酶学特性[J]. 微生物学通报, 2011, 38(4):531-538.
[10]魏亚琴,李永泉,李红玉. 纤维素分解菌—青霉和放线菌的分离选育研究[J]. 兰州大学学报(自然科学版), 2008,44(S1):87-91.
[11]林元山. 康氏木霉AS3.2774纤维素酶系的诱导、阻遏、纯化及鉴定方法研究[D]. 南宁: 广西大学, 2010.
[12]李争明, 张娟, 邓中洋,等. 纤维素酶产生菌的筛选、鉴定及发酵产酶条件优化[J]. 生物技术通报, 2015, 31(5):146-152.
[13]Maki M, Leung K T, Qin W S. The prospects of cellulase-producing bacteria for the bioconversion of lignocelleulosic biomass[J]. International journal of biological Sciences, 2009, 5(5):500-516.
[14]李洋. 纤维素酶产生菌的筛选和产酶条件优化[D]. 大连: 大连理工大学, 2015.
[15]Tengerdy R P, Weinberg Z G, Szakacs G, et al.Ensilage alfalfa with additives of lactic acid bacteria and enzymes[J]. Journal of the Science of Food and Agriculture, 1991, 55: 215-228.
[16]宋朝霞. 微波、纤维素酶预处理对大豆低聚糖提取的影响[J]. 现代食品科技, 2007, 23(1): 33-35.
[17]路代国,周荣荣,周志朋,等.酸性纤维素酶抛光效果的影响因素[J].印染,2003, (13):20-23.
[18]Long C, Ou Y, Guo P, et al. Cellulase production by solid state fermentation using bagasse withPencilliumdecumbensL-06[J]. Annals of Microbiology, 2009, 59(3):517-523.
[19]陆晨. 高产纤维素酶菌株的筛选及其产酶条件优化[D]. 长沙: 中南林业科技大学, 2012.
[20]陆晨, 陈介南, 王义强, 等. 一株纤维素酶真菌的筛选及产酶条件优化[J]. 中南林业科技大学学报, 2012, 32(6):118-122.
[21]沈萍, 范秀荣. 微生物学实验(第3版)[M].北京: 高等教育出版社, 1999:50-51.
[22]许玉林, 郑月霞, 叶冰莹, 等. 一株纤维素降解真菌的筛选及鉴定[J]. 微生物学通报, 2013, 40(2): 220-227.
[23]冯健玲, 姚晓华, 韦秉兴, 等. 稻草秸秆纤维素降解菌的分离筛选[J].基因组学与应用生物学, 2009, 28(3):477-480.
[24]R.E.布坎南,N.E.吉本斯,等.伯杰细菌鉴定手册(第8版)[M].北京:科学出版社,1984:729-758.
[25]东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001:349-398.
[26]Tamura K, Stecher G, Peterson D, et al. MEGA 6:Molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution, 2013, 30(12):2725-2729.
[27]令利军, 雷蕾, 冯蕾, 等. 独角莲内生细菌TG116的分离鉴定及抑菌特性研究[J]. 西北师范大学学报, 2014, 50(5):91-97.
[28]陈美标, 郭建华, 姚青, 等. 大宝山矿区耐Cd2+细菌的分离鉴定及其生物学特性[J]. 微生物学通报, 2012, 39(12):1720-1733.
[29]乐文民, 李江华, 刘龙, 等. 产中性纤维素酶细菌的筛选及培养基优化[J]. 食品与生物技术学报, 2015, 34(2):183-188.
[30]黄河, 林元山, 周熠, 等. 一株耐酒精纤维素酶产生菌的筛选、鉴定及其特性研究[J]. 中国酿造, 2015, 34(3):62-65.
[31]吴翔, 甘炳成, 黄忠乾, 等. 纤维素降解细菌DBJ的筛选鉴定及其特性研究[J]. 西南农业学报, 2016, 29(1):81-84.
Isolation, Identification and Growth Characteristics of a Cellulase-Producing Bacterium
HE Nan, LING Li-Jun, FENG Lei, SU Min, YAO Yan-min, SONG Xue-mei
(Coll.ofLifeSci.,NWNormalUni.,Lanzhou730070)
The aim of this study was to screen efficient cellulose degradable strains and study their biological characteristics. The bacteria were isolated and screened from rotten maize straw by using the Congo red staining test, followed by measuring the degradation rate of filter paper and the enzyme activity for further-rescreening. The hydrolysis circle, clearing zone ratios (clearing zone diameter/colony diameter), the degradation rate of filter paper and cellulase activity were taken as comprehensive evaluating selection criteria, and obtained a cellulose-producing strain-DX4. The results showed that the filter paper (FPA), endoglucanase activity (CMCase activity), exoglucanase activity (Cex activity) of DX4 were 256.051 U/mL, 358.276 U/mL, 5.536 U/mL, respectively. Identified by morphological, physiology and biochemistry, molecular technology, DX4, with better cellulose degradable ability, it was characterized asBacillussubtilis, and named as BS-DX4. The study indicated that the strain grew vigorously at 40 ℃ on medium with light salt concentration. It is a high cellulase-producing strain with broad development potential.
cellulose degradable bacteria;identification;cellulase activity;Bacillussubtilis;growth characteristics
甘肃省科技支撑计划项目(1304NKCA143);甘肃省高校科研项目(2013A-011);西北师范大学青年教师提升计划资助
何楠 女,硕士研究生。主要研究方向为植物与微生物互作。E-mail:xiatianali@163.com
* 通讯作者。男,博士,副教授,硕士生导师。主要研究方向为植物与微生物互作。E-mail: linglijun@nwnu.edu.cn
2016-07-12;
2016-08-25
Q93-331
A
1005-7021(2017)01-0043-07
10.3969/j.issn.1005-7021.2017.01.007
项目(NWNU-LKQN-10-18)

