EB病毒变异型EBER2对鼻咽癌细胞增殖和凋亡的影响
李斐斐, 王其春, 刘芡芡,, 邓洪岩, 王 云*
(1.青岛大学医学院 微生物教研室,山东 青岛 266021;2.山东省莱钢医院 检验科,山东 莱芜 271126)
EB病毒变异型EBER2对鼻咽癌细胞增殖和凋亡的影响
李斐斐1, 王其春2, 刘芡芡1,2, 邓洪岩1, 王 云1*
(1.青岛大学医学院 微生物教研室,山东 青岛 266021;2.山东省莱钢医院 检验科,山东 莱芜 271126)
EB病毒(EBV)编码小RNA(EBERs,包括EBER1和EBER2)的致癌作用已在多种细胞系中得到证实,我们前期研究发现在EBER2基因发生6处突变的EB-8m变异型可能与鼻咽癌(NPC)的发生相关。本研究探讨变异型EBER2对NPC细胞增殖和凋亡的影响,以进一步明确EBER2基因变异在NPC发生中的作用。分别以B95-8原型和EB-8m变异型EBER2稳定转染EBV阴性NPC细胞系,MTT法和平板克隆检测细胞增殖,流式细胞仪检测细胞凋亡。与转染原型EBER2细胞及转染载体的对照细胞比较,转染变异型EBER2细胞的MTT吸光度值和平板克隆形成率增高,细胞凋亡率降低(P均小于0.05),原型和对照之间细胞增殖无差异,但原型的细胞凋亡率亦低于对照(P<0.05)。上述结果表明,EB-8m变异型EBER2可通过提高NPC细胞增殖及抗凋亡能力而增强其致癌作用。
EB病毒;EBER2;鼻咽癌;基因变异
EB病毒(Epstein-Barr Virus,EBV)是重要的肿瘤相关病毒,与鼻咽癌(nasopharyngeal carcinoma,NPC)的发生密切相关。EBV致癌机制尚不明确,肿瘤组织中EBV主要以潜伏感染的形式存在,EBV潜伏感染和细胞转化能力是其致癌基础。EBV编码小RNA(EBV-encoded small RNAs,EBERs)是所有EBV潜伏感染类型中表达最丰富的mRNA,每个细胞中高达106~107拷贝,是EBV潜伏感染的标志物[1]。EBERs的致癌作用已在淋巴瘤、NPC和胃癌等多种细胞系中得到证实,EBERs基因过表达,可增强这些肿瘤细胞的增殖、抗凋亡及异种动物致瘤能力,因此EBERs在NPC及其他EBV相关肿瘤发生中的作用日益受到关注[2-3]。EBERs为非编码RNA,包括167 bp的EBER1和172 bp的EBER2,中间间隔161 bp的非转录区。我们前期对山东地区和广东地区NPC及健康人群标本中EBERs基因多态性的检测表明,与原型毒株B95-8比较,EBER1基因高度保守,但几乎所有标本在EBER2编码区以及非转录区出现突变,在EBER2转录区出现6处共有突变的EB-8m变异型在山东地区和广东地区NPC中的检出率均高于同一地区健康人群,差异有显著性(P<0.05),而且在广东地区NPC中的检出率高达82%,提示EB-8m变异型与NPC的发生相关[4-5]。本研究检测比较原型和EB-8m变异型EBER2基因过表达对NPC细胞增殖和凋亡的影响,进一步明确EBER2基因变异在NPC发生中的作用。
1 材料与方法
1.1 材料
1.1.1 细胞与病毒 EBV阴性NPC细胞系HONE1和CNE1由广东医学院病理科朱伟教授馈赠。EBER2慢病毒表达载体由上海吉玛生物制药有限公司构建。
1.1.2 主要试剂 引物由南京金思瑞生物工程技术服务有限公司合成;DMEM培养基、胎牛血清、RNA提取试剂TRIzol和噻唑蓝(MTT)购自美国Gibco公司;Real-time PCR试剂盒购于Roche公司;细胞转染试剂polybrene和结晶紫染色液购自美国Sigma公司;嘌呤霉素购自美国Invitrogen公司;Active人类干扰素-α(Interferon α,IFN-α)全长蛋白质购自英国Abcam公司;细胞凋亡检测试剂Annexin V-APC和7-AAD(7-amino-actinomycin D)分别购自美国eBioscience公司和美国BD公司;二甲基亚砜(DMSO)为安徽天地高纯溶剂有限公司产品。
1.1.3 主要仪器 Real-time PCR扩增仪(Roche Light Cycler 96型);流式细胞仪(美国BD 公司Accuri C6型);酶标仪(美国Bio Tek公司ELx 808型)。
1.2 方法
1.2.1 慢病毒载体构建 前期已构建了含EBERs原型(EB-B95-8)和EB-8m基因的T-A克隆,并经过测序证实序列正确。将EB-8m变异型和EB-B95-8原型的T-A克隆作为摸板,送上海吉玛生物制药有限公司进行EBER2基因的慢病毒载体构建、包装、病毒滴定。两种病毒分别命名为EBER2-B95-8和EBER2-8m,不含外源基因的对照病毒命名为Control。
1.2.2 慢病毒转染目的细胞及稳定转染细胞筛选 以最佳MOI值50转染CNE1和HONE1细胞(按慢病毒包装与使用工具手册操作),转染成功后,以1 μg/mL嘌呤霉素筛选稳定转染细胞。获得稳定转染细胞后,收集细胞,提取转染细胞RNA,采用Real-time PCR检测EBER2基因mRNA,RNA提取步骤及 PCR具体步骤按照试剂盒说明进行。Rea-ltime PCR检测EBER2及内参基因GAPDH表达所用引物序列如表1所示。用ΔΔCt法分析基因表达的相对定量,ΔCt= Ct目的基因-Ct内参基因,ΔΔCt=ΔCt转染基因组-Ct转染对照病毒组,2-ΔΔCt表示转染基因组与对照组比较的相对表达量。
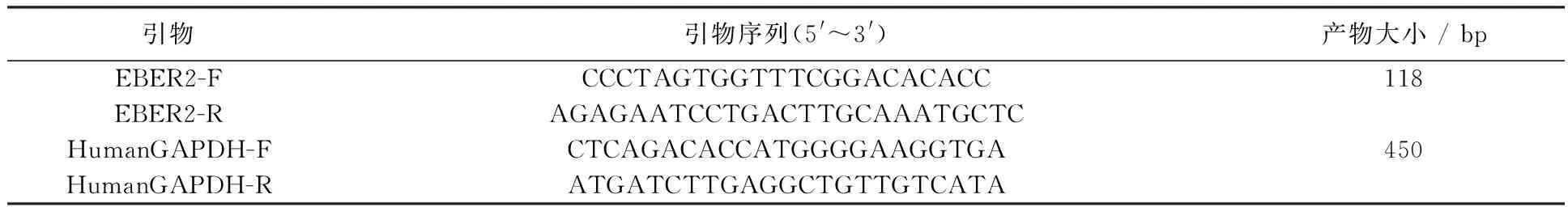
表1 Real-time PCR检测EBER2基因表达所用引物
1.2.3 细胞增殖实验 采用MTT法检测细胞增殖,收集对数期细胞,调整细胞悬液浓度至5×104个/mL,每孔加入100 μL,铺96孔板,5% CO2培养箱37 ℃培养1~8 d。每24 h加入20 μL MTT溶液(5 mg/mL),每次加入MTT后继续培养4 h,小心吸去孔内培养液,每孔加入150 μL二甲基亚砜,置摇床上低速振荡10 min,在酶联免疫检测仪OD490处测量各孔的吸光值,连续观察9 d。设置不加细胞的空白调零孔,每种细胞设置6个复孔,取3次试验均值。同时进行平板克隆实验,收集对数期细胞,0.25%胰蛋白酶消化成单细胞。向6孔板中加入3 mL培养液,每孔加入100个细胞,并轻轻转动,使细胞分散均匀,5% CO2,37 ℃培养2周。当培养皿中的克隆肉眼可见时,终止培养。PBS洗2遍,70%乙醇固定30 min,去固定液,加1 mL 0.1%结晶紫染色30 min,然后清洗细胞,晾干。拍照并计算克隆形成率:克隆形成率(%)=(克隆数/接种细胞数)×100%。
1.2.4 细胞凋亡诱导实验 收集对数生长期的细胞,调整细胞悬液浓度为6×104个/mL,铺6孔板,5% CO2,37 ℃培养过夜,加入浓度10 000 IU/mL的 IFN-α,于加药后72 h,采用Annexin V-APC和7-AAD(7-amino-actinomycin D)双染,流式细胞仪检测细胞凋亡情况,具体步骤按照试剂盒说明书进行。
1.2.5 统计学分析 3次以上重复实验结果用平均数±标准差表示,采用完全随机资料方差分析比较不同实验组与对照组之间的差异。采用SPSS 18.0统计软件进行统计学分析,P<0.05时为差异具有统计学意义。
2 结果与分析
2.1 稳定转染细胞的筛选及鉴定
慢病毒转染细胞经嘌呤霉素抗性筛选后,荧光显微镜下观察,几乎所有细胞均表达绿色荧光蛋白。采用Real-time PCR扩增检测EBER2转染细胞中EBER2基因表达,与转染对照病毒组细胞(Control组)比较,转染EB-B95-8型和EB-8m变异型 EBER2基因的CNE1细胞以及HONE1中EBER2基因过表达显著,CNE1细胞中表达量分别增加了(2 385.37±276.65)和(2 336.28±189.23)倍;HONE1细胞中表达量分别增加了(4 451.27±200.56)和(4 870.99±303.20)倍(图1A)。以3%的琼脂糖凝胶电泳检测Real-time PCR扩增结果见图1B。

图1 EBER2基因转染细胞中EBER2基因表达Fig.1 The expression of EBER2 in EBER2-transfected cellsA:EBER2转染细胞中EBER2的表达水平;B:Real-time PCR电泳结果A: The expression levels of EBER2 mRNA in EBER2-transfected cells versus control; B: The results of Real-time PCR showed by agarose gel electrophoresis
2.2 EBER2原型和变异型基因对NPC细胞增殖的影响
MTT实验中从第0~8 天,两细胞系中各组细胞的吸光度均逐渐增加。在CNE1细胞中,0~4 d 三组细胞间吸光度值无明显差异(P>0.05),但5~8 d,EBER2-B95-8组及Control组细胞增殖减慢,EBER2-8m组吸光度值高于EBER2-B95-8组及Control组,差异有显著性(P<0.05),EBER2-B95-8组与Control组之间无显著性差异(P>0.05)(图2A);在HONE1细胞中,0~5 d三组细胞间吸光度值无明显差异(P>0.05),但6~8 d,EBER2-8m组吸光度值高于EBER2-B95-8组及Control组,差异有显著性(P<0.05),EBER2-B95-8组与Control组之间无显著性差异(P>0.05)(图2D)。平板克隆实验表明无论CNE1还是HONE1细胞系,EBER2-8m组细胞克隆形成率均高于EBER2-B95-8及Control组,差异有显著性(P<0.05),EBER2-B95-8与Control组相比无显著性差异(P>0.05)(CNE1:图2B和C;HONE1:图2E和F)。
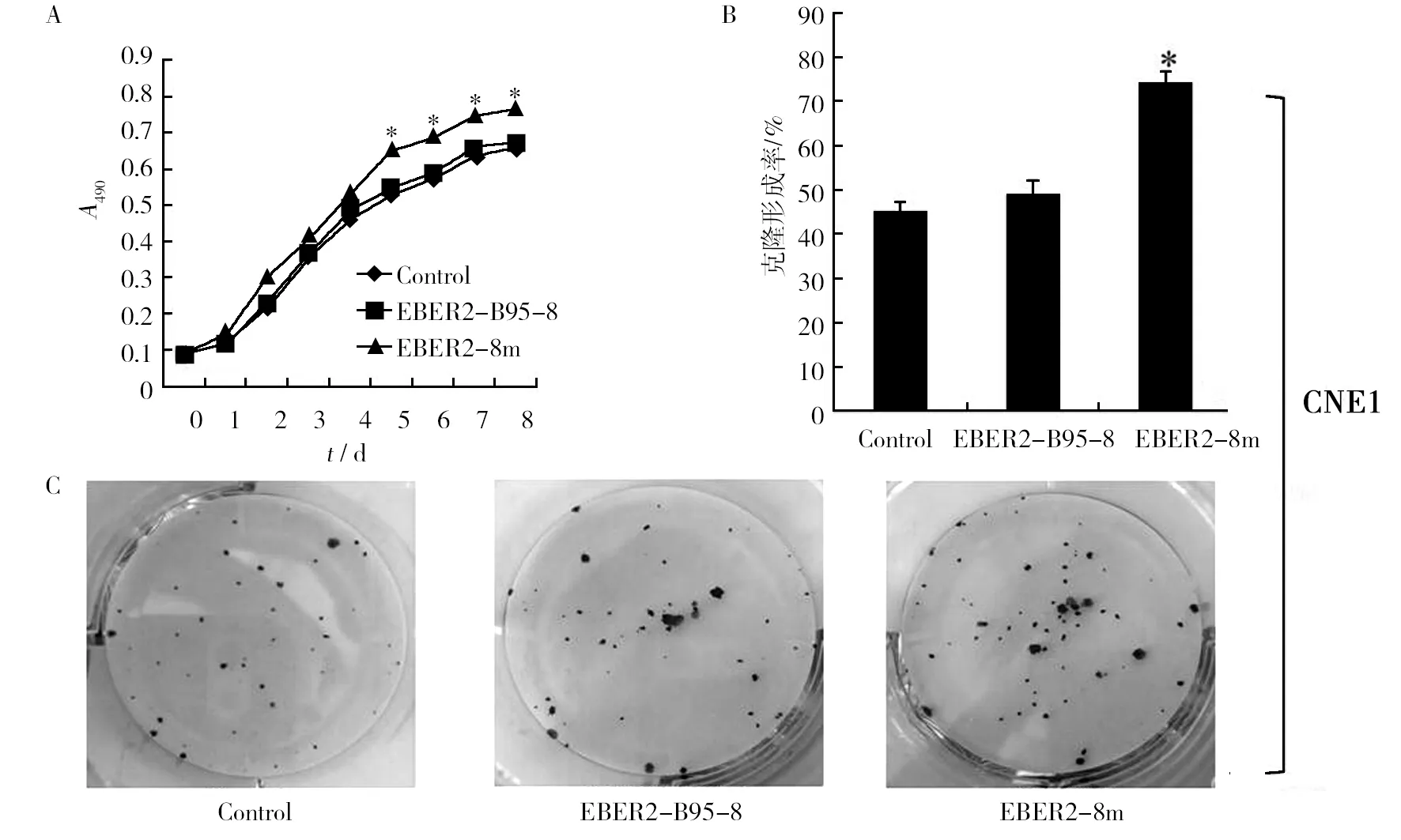
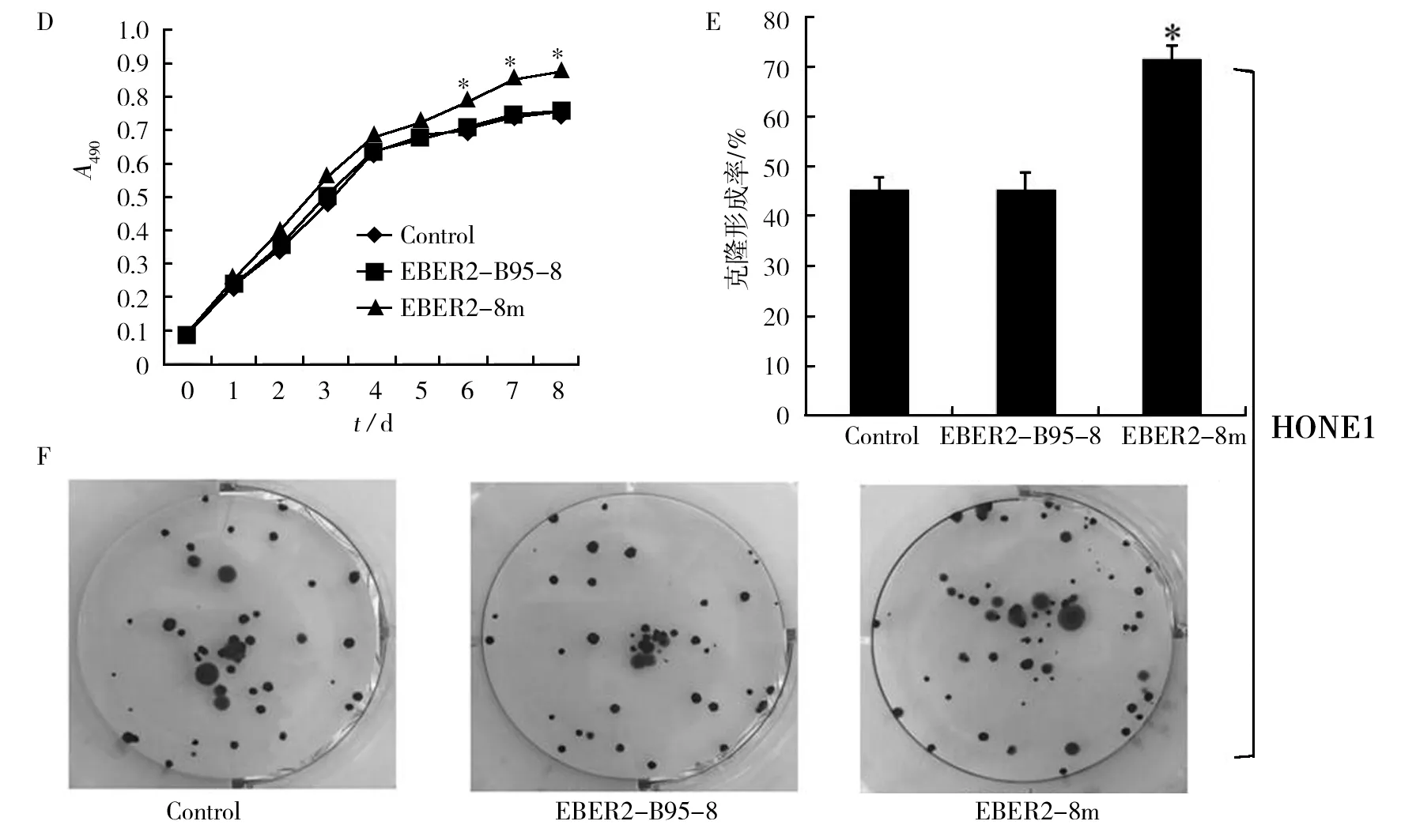
图2 MTT和平板克隆检测EBER2转染CNE1及HONE1细胞增殖Fig.2 Effects of EBER2 expression on CNE1 and HONE1 cell proliferation by MTT assay and colony forming assayA:CNE1细胞MTT实验结果;B:CNE1细胞平板克隆实验结果统计分析;C:CNE1细胞平板克隆实验照片图;D:HONE1细胞MTT实验结果;E:HONE1细胞平板克隆实验结果统计分析;F:HONE1细胞平板克隆实验照片图;*:与Control组及EBER2-B95-8比较,P<0.05A: The results of MTT assay for CNE1 cell lines; B: Analysis of the results of colony forming assay for CNE1 cell lines; C: The representative photos of forming colony for CNE1 cell lines; D: The results of MTT assay for HONE1 cell lines; E: Analysis of the results of colony forming assay for HONE1 cell lines; F: The representative photos of forming colony for HONE1 cell lines; *Compared with Control group or EBER2-B95-8 group, P<0.05
2.3 EBER2原型和变异型基因对NPC细胞凋亡的影响
采用Annexin V-APC和7-AAD双染检测IFN-α诱导细胞凋亡,结果显示两个细胞系EBER2-B95-8组和EBER2-8m组凋亡细胞百分数(3次实验均值)均低于Control组,差异均有显著性(P<0.05),且EBER2-8m组凋亡细胞百分数(3次实验均值)低于EBER2-B95-8组,差异有显著性(P<0.05),CNE1细胞的结果见图3A和B,HONE1细胞的结果见图3C和D。

图3 流式细胞术检测IFN-α诱导细胞凋亡结果Fig.3 Determination of IFN-α induced apoptosis by flow cytometryA:CNE1细胞流式细胞术检测细胞凋亡率的统计结果;B:CNE1细胞流式细胞仪检测结果;C:HONE1细胞流式细胞术检测细胞凋亡率的统计结果;D:HONE1细胞流式细胞仪检测结果;*:与Control组及EBER2-B95-8比较,P<0.05;**:与Control组比较,P<0.05A: Analysis of the results of flow cytometry for CNE1 cell lines; B: Representative images of flow cytometry for CNE1 cell lines; C: Analysis of the results of flow cytometry for HONE1 cell lines; D: Representative images of flow cytometry for HONE1 cell lines; * Compared with Control group or EBER2-B95-8 group, P<0.05; **Compared with Control group, P<0.05
3 讨 论
本研究将携带原型和EB-8m变异型EBER2基因的慢病毒成功转染EBV阴性NPC细胞系CNE1和HONE1,并获得稳定转染细胞,Real-time PCR结果显示2种基因在CNE1和HONE1细胞中均能有效表达。检测了EBER2过表达对细胞增殖及IFN-α诱导细胞凋亡的影响,结果显示原型和变异型EBER2均可增强细胞的抗凋亡能力,且变异型EBER2还可促进细胞增殖,提示EBER2基因尤其是变异型EBER2基因可以增强NPC细胞的肿瘤原性。
通过体外过表达EBERs进行EBERs功能研究的实验中,多数研究过表达的基因包含EBER1、EBER2及上游调控区在内的基因,研究表明EBERs基因具有促癌作用。将EBERs转染EBV阴性BL细胞系Akata和B淋巴瘤细胞系BJAB,可使细胞回复恶性表型,如抗凋能力增强、软琼脂培养克隆形成和联合免疫缺陷鼠皮下成瘤等[6-9];转染EBERs的永生化鼻咽上皮细胞NP-69抗凋亡能力和细胞增殖能力增强[10];转染EBERs的BL细胞系MUTU和Daudi抗凋亡能力增强[9]。Laing 等[11]将EBER1在NIH 3T3细胞中过表达,可提高细胞软琼脂克隆生成率。另外有研究采用基因敲除技术敲除EBV基因组中EBERs基因,证实EBERs在EBV转化B细胞中发挥重要作用[12-13];Wu等[13]分别敲除EBER1和EBER2基因,表明EBER2是引起B细胞转化的关键基因。Gregorovic等[14]采用表达谱芯片检测EBV对B细胞基因表达的影响,发现EBER2基因缺失EBV比EBER1基因缺失 EBV使B细胞基因表达发生更大差异。本研究结果表明EBER2基因尤其是EB-8m变异型EBER2基因也具有致癌作用,进一步提示了EBER2功能的重要性。
本研究结果还表明与原型EBER2比较,EB-8m变异型提高了NPC细胞系增殖和抗凋亡的能力,提示EBER2基因变异提高了EBERs或EBER2基因的致癌潜能。EB-8m变异型首次在山东地区样本中检出并命名,其在NPC中的检出率(33.7%,33/95)高于EBV相关胃癌(2.0%,1/50)和健康人群(1.1%,1/92),差异有显著性(P<0.05)[4-5],我们后续对NPC高发区广州地区样本的检测表明EB-8m在NPC中的检出率高达82%(41/50),高于健康人群(32.4%,24/74),差异有显著性(P<0.05),提示EB-8m变异型与NPC尤其是高发区NPC的发生相关[5]。除EB-8m变异型外,在山东和广东地区样本中还检测到B95-8原型和另外两种变异型,即EB-6m和EB-10m,其中EB-10m和B95-8原型仅见于少数样本,山东地区NPC、EBV相关胃癌和健康人群及广东地区健康人群均以EB-6m为主要亚型。EB-6m发生6处突变,5处位于非转录区,1处位于EBER2基因。来自德国、南非、美国和意大利的EBV相关恶性和良性疾病的小样本检测中,只检出2种基因型即B95-8和EB-6m,其中大多数样本为EB-6m[15-18]。我们对已完整测序的19株EBV毒株的EBERs序列进行分析,发现来源于广东和香港NPC的13株毒株中,12株(GD2、M81、C666-1、HKNPC1-HLNPC9)为EB-8m,1株(GD1)为EB-6m;来源于美国传染性单核细胞增多症的B95-8和非洲BL的MUTU为B95-8型;来自非洲BL的AG876、日本BL的Akata和美国健康人的K4413Mi和K4123Mi为EB-6m[5]。尽管目前对EBERs多态性的研究相对较少,但从上述来自不同地域的数据可以推测,EB-8m变异型只在广东地区NPC组织中具有较高的检出率,是与NPC相关的亚型。本研究中功能学的研究结果进一步支持EB-8m变异型与NPC的发生相关。
[1] Niedobitek G, Herbst H. In situ detection of Epstein-Barr virus and phenotype determination of EBV-infected cells[J]. Methods Mol Biol, 2006, 326: 115-137.
[2] Iwakiri D. Multifunctional non-coding Epstein-Barr virus encoded RNAs (EBERs) contribute to viral pathogenesis[J]. Virus Res, 2016, 212: 30-38.
[3] Takada K. Role of EBER and BARF1 in nasopharyngeal carcinoma (NPC) tumorigenesis[J]. Semin Cancer Biol, 2012, 22(2): 162-165.
[4] Wang Y, Zhang X, Chao Y, et al. New variations of Epstein-Barr virus-encoded small RNA genes in nasopharyngeal carcinomas, gastric carcinomas, and healthy donors in northern China[J]. J Med Virol, 2010, 82(5): 829-836.
[5] Shen ZC, Luo B, Chen JN, et al. High prevalence of the EBER variant EB-8m in endemic nasopharyngeal carcinomas[J]. PLoS One, 2015, 10(3): e0121420.
[6] Komano J, Maruo S, Kurozumi K, et al. Oncogenic role of Epstein-Barr virus-encoded RNAs in Burkitt's lymphoma cell line Akata[J]. J Virol, 1999, 73(12): 9827-9831.
[7] Yamamoto N, Takizawa T, Iwanaga Y, et al. Malignant transformation of B lymphoma cell line BJAB by Epstein-Barr virus-encoded small RNAs[J]. FEBS Lett, 2000, 484(2): 153-158.
[8] Ruf IK, Rhyne PW, Yang C, et al. Epstein-Barr virus small RNAs potentiate tumorigenicity of Burkitt lymphoma cells independently of an effect on apoptosis[J]. J Virol, 2000, 74(21): 10223-10228.
[9] Nanbo A, Inoue K, Adachi-Takasawa K, et al. Epstein-Barr virus RNA confers resistance to interferon-alpha-induced apoptosis in Burkitt’s lymphoma[J]. EMBO J, 2002, 21(5): 954-965.
[10]Wong HL, Wang X, Chang RC, et al. Stable expression of EBERs in immortalized nasopharyngeal epithelial cells confers resistance to apoptotic stress[J]. Mol Carcinog, 2005, 44(2): 92-101.
[11]Laing KG, Elia A, Jeffrey I, et al. In vivo effects of the Epstein-Barr virus small RNA EBER-1 on protein synthesis and cell growth regulation[J]. Virology, 2002, 297(2): 253-269.
[12]Yajima M, Kanda T, Takada K. Critical role of Epstein-Barr Virus (EBV)-encoded RNA in efficient EBV-induced B-lymphocyte growth transformation[J]. J Virol, 2005, 79(7): 4298-4307.
[13]Wu Y, Maruo S, Yajima M, et al. Epstein-Barr virus (EBV)-encoded RNA 2 (EBER2) but not EBER1 plays a critical role in EBV-induced B-cell growth transformation[J]. J Virol, 2007, 81(20): 11236-11245.
[14]Gregorovic G, Bosshard R, Karstegl CE, et al. Cell gene expression correlating with EBER expression in Epstein-Barr virus infected lymphoblastoid cell lines[J]. J Virol, 2011, 85(7): 3535-3545.
[15]Schuster V, Ott G, Seidenspinner S, et al. Common Epstein-Barr virus (EBV) type-1 variant strains in both malignant and benign EBV-associated disorders[J]. Blood, 1996, 87(4): 1579-1585.
[16]Janse van Rensburg E, van Heerden WF, Robson BA, et al. Epstein-Barr virus strain characterization in South African patients with nasopharyngeal carcinomas[J]. Anticancer Res, 2000, 20(3B): 1953-1957.
[17]Frank D, Cesarman E, Liu YF, et al. Posttransplantation lymphoproliferative disorders frequently contain type A and not type B Epstein-Barr virus[J]. Blood, 1995, 85(5): 1396-1403.
[18]Menin C, Ometto L, Veronesi A, et al. Analysis of Epstein-Barr virus (EBV) type and variant in spontaneous lymphoblastoid cells and Hu-SCID mouse tumours[J]. Mol Cell Probes, 1996, 10(6): 453-461.
Effects of the Variant of Epstein-Barr Virus-Encoded RNA2 (EBER2) to Cell Proliferation and Apoptosis of Nasopharyngeal Carcinoma
LI Fei-fei1, WANG Qi-chun2, LIU Qian-qian1, 2, DENG Hong-yan1, WANG Yun1
(1.Teach&Res.DivofMed.Microbiol.,Med.Coll.,QingdaoUni.,Qingdao266021;2.Div.ofClin.Lab.,LaigangHosp.ofShandongProv.,Laiwu271126)
It has been confirmed that EBV-encoded RNAs (EBERs, including EBER1 and EBER2) contribute to carcinogenesis in multiple cell lines. The previous researches demonstrated that EB-8m variant with 6 common mutants in the EBER2 gene area may be associated with nasopharyngeal carcinoma (NPC). This study aims to investigate the effects of EBER2 with EB-8m variant to the cell proliferation and apoptosis of EBV-negative NPC cell lines, and so as to further make certain the role of variant EBER2 in the biogenesis of NPC. In EBV-negative NPC cell lines (CNE1 and HONE1) with stable expression of EBER2 prototype (B95-8) or EB-8m variant gene and control cells with vector transfection, the cell proliferation was assessed by MTT test and plate clone forming assay, and the cell apoptosis was evaluated by flow cytometry. Comparison of infection prototype EBER2 cells with control cells of transfection vector, MTT absorbance value and plate clone formation rate increased, and cell apoptosis dampened (Pall <0.05), the proliferation between prototype and control cell had no difference, however, the apoptosis rate of prototype also lower than control (P<0.05). The above mentioned results showed that EB-8m variant EBER2 could strengthen its carcinogenic effects through the increment of NPC cell proliferation and anti-apoptosis ability.
Epstein-Barr virus; EBER2; nasopharyngeal carcinoma; gene variation
国家自然科学基金项目(81171571);青岛市科技计划项目(13-1-3-50-nsh)
李斐斐 女,硕士研究生。主要研究方向为肿瘤病毒学。E-mial:lifeifei0930@163.com
2016-10-09;
2016-10-21
Q939.93;R373
A
1005-7021(2017)01-0057-07
10.3969/j.issn.1005-7021.2017.01.009
* 通讯作者。女,博士,教授,硕士生导师。主要研究方向为肿瘤病毒学。Tel:0532-82991083,E-mial:qdwangyun@aliyun.com

