硫化氢供体桥二硫哌嗪二酮类小分子的合成
陈 钏, 张春燕, 赵玉玺
(1. 川北医学院 a. 药学院, b. 药物研究所,四川 南充 637000)
·快递论文·
硫化氢供体桥二硫哌嗪二酮类小分子的合成
陈 钏1a,1b*, 张春燕1a,1b, 赵玉玺1a,1b
(1. 川北医学院 a. 药学院, b. 药物研究所,四川 南充 637000)
利用改良的Trown合成法,以甘氨酸酐为原料,经氮烷基化、溴化、取代、脱乙酰基及氧化反应合成了4个桥二硫哌嗪二酮环类小分子化合物,其结构经1H NMR和MS(EI)确证。
甘氨酸酐; 气体信号分子; 硫化氢供体; Trown合成; 桥二硫哌嗪二酮; 合成
硫化氢(H2S)是继气体信号分子一氧化氮(NO)和一氧化碳(CO)后发现的第三种新型气体信号分子[1]。其生物合成依赖于三种酶[2-3],胱硫醚-β-合成酶(CBS),胱硫醚-γ-裂解酶(CSE)和巯基丙酮酸硫转移酶(MPST)。这三种酶存在于不同的组织中,可将半胱氨酸或半胱氨酸衍生物转化为H2S。研究发现,生理浓度下H2S具有多种生理活性[4-8],如抗炎、扩张血管和心血管保护、神经保护及抗肿瘤等作用,因而在治疗高血压、心脏缺血性疾病、动脉粥样硬化、炎症及肿瘤等方面具有极大的应用前景[9]。
目前,外源性的H2S供体主要有以下几种类型[10-16]。硫化盐如Na2S, NaHS及CaS等无机盐是最常见的硫化氢供体。这些盐可以快速释放H2S,但是无法控制其释放速度,因而很难控制其浓度以及控制H2S不从溶液中溢出。目前对硫化氢供体的研究多集中于有机化合物,其H2S的释放得到控制。劳森试剂(二硫代磷酸酯类衍生物),如GYY4137,溶于水即可缓慢释放H2S,天然产物如大蒜素(DATS)等;二硫代硫酮类衍生物如去甲茴三硫的衍生物、N-(苯甲酰基)-硫代苯甲酰胺类衍生物、S-乙酰基过硫类化合物及硫代氨基酸类化合物等。
在自然界中,桥二硫哌嗪二酮环类小分子epidithiapiperazinediones(ETPs)是由真菌产生的二次代谢产物,目前至少发现14种不同的ETPs(除了部分变化很小的化合物)均表现了一定的生物活性,多具有抗菌和抗病毒作用[17]。但天然产物大多结构复杂,不易合成。
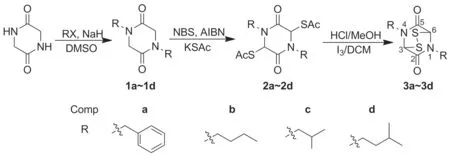
Scheme 1
小分子ETPs最早在1968年由Trown成功合成[18],接着在七十年代研究较多,先后出现几种其他的合成方法,如Hino合成[19]、Schmidt合成[20]、Srinivasan合成[21]及Aliev合成[22]。为了研究该类分子是否可以在生理条件下释放硫化氢,本文设计合成了一类简单的ETPs含硫有机化合物以供研究。采用简单易行的改良Trown合成法[23],利用甘氨酸酐为原料,通过氮烷基化、溴化、取代、酸催化下脱除乙酰基及I2的氧化反应合成了4个简单桥二硫哌嗪二酮环类小分子(3a~3d, Scheme 1),其结构经1H NMR和MS(EI)确证。
1 实验部分
1.1 仪器与试剂
Bruker AM 300型超导核磁共振仪(CDCl3为溶剂,TMS为内标);MAT-95型质谱仪(低分辨EI); Agilent 1100 Bruker Esquire 3000 plus型液相色谱质谱联用仪(LC-MS)。
硅胶H60(300-400目)和硅胶zcx-II(100-200目),青岛海洋化工厂;HSGF 254薄层层析硅胶板,烟台化工研究院;甘氨酸酐(TCI, 98%)、氢化钠(NaH, 60%分散于油中)、溴化苄(98%)、碘代正丁烷(98%)、溴代异丁烷(98%)、溴代异戊烷(96%)、N-溴代丁二酰亚胺(NBS, 98%)、 2,2-偶氮二异丁腈(AIBN, 98%)、硫代乙酸钾(KSAc, 98%);碘化钾(KI, 99%)和碘(99.5%),阿拉丁试剂公司;氯化氢甲醇溶液(HCl/MeOH),自制;其余所用试剂均为分析纯。
1.2 合成[23]
(1) 1a~1d的合成(以1a为例)
将甘氨酸酐264 mg(2.3 mmol)溶于DMSO 10 mL中,加入氢化钠200 mg(在矿物油中含量60%),搅拌下于室温反应30 min;待无气泡产生时,加入溴苄1.008 g(5.9 mmol),于室温反应过夜。加水稀释,用二氯甲烷(3×20 mL)萃取,合并有机相,依次用水和饱和食盐水洗涤,无水硫酸钠干燥,减压蒸干得1,4-二苄基哌嗪-2,5-二酮(1a)700 mg,收率100%。
用类似方法合成1b~1d。
1a: 白色粉末,收率100%;1H NMRδ: 7.34(m, 6H, ArH), 7.26(m, 4H, ArH), 4.58(s, 4H, NCH2), 3.96(s, 4H, 3,6-H); MS(EI)m/z: 294[M+]。
1,4-二正丁基哌嗪-2,5-二酮(1b): 白色粉末,收率85%;1H NMRδ: 3.96(s, 4H, 3,6-H), 3.38(t,J=7.1 Hz, 4H, NCH2), 1.52(m, 4H, CH2CH2), 1.32(m, 4H, CH2CH3), 0.90(t,J=7.0 Hz, 6H, CH3); MS(EI)m/z: 226[M+]。
1,4-二异丁基哌嗪-2,5-二酮(1c): 白色粉末,收率56.8 %;1H NMRδ: 3.96(s, 4H, 3,6-H), 3.20(d,J=7.2 Hz, 4H, NCH2), 1.96(m, 2H, CH), 0.90(d,J=7.0 Hz, 12H, CH3); MS(EI)m/z: 226[M+]。
1,4-二异戊基哌嗪-2,5-二酮(1d): 白色粉末,收率98.7%;1H NMRδ: 3.96(s, 4H, 3,6-H), 3.38(t,J=7.2 Hz, 4H, NCH2), 1.56(m, 2H, CHCH3), 1.42(m, 4H, CH2CH2), 0.90(d,J=6.5 Hz, 12H, CH3); MS(EI)m/z: 254[M+]。
(2) 2a~2d的合成(以2a为例)
将1a 470 mg(1.6 mmol), NBS 683 mg(3.8 mmol)和AIBN 5 mg溶于四氯化碳20 mL中,搅拌下回流反应1 h。冷却,过滤,滤液蒸干得粗品,用二氯甲烷20 mL溶解,加入硫代乙酸钾456 mg(4.0 mmol),于室温反应过夜。过滤,滤液减压蒸干,用正己烷/乙酸乙酯重结晶得3,6-二(硫代乙酰基)-1,4-二苄基哌嗪-2,5-二酮(2a)246 mg,收率34.8%。
用类似方法合成2b~2d。
2a: 白色粉末,收率34.8%;1H NMRδ: 7.34(m, 6H, ArH), 7.26(m, 4H, ArH), 5.84(s, 2H, 3,6-H), 5.00(d,J=14.7 Hz, 2H, NCH2), 4.00(d,J=14.7 Hz, 2H, NCH2), 2.40(s, 6H, COCH3); MS(EI)m/z: 442[M+]。
3,6-二(硫代乙酰基)-1,4-二正丁基哌嗪-2,5-二酮(2b): 白色粉末,收率35.6%;1H NMRδ: 5.62(s, 2H, 3,6-H), 3.96(m, 2H, NCH2), 2.96(m, 2H, NCH2), 2.40(s, 6H, COCH3), 1.60(m, 4H, CH2CH2), 1.34(m, 4H, CH2CH3), 0.94(t,J=7.0 Hz, 6H, CH3); MS(EI)m/z: 374[M+]。
3,6-二(硫代乙酰基)-1,4-二异丁基哌嗪-2,5-二酮(2c): 白色粉末,收率40.2%;1H NMRδ: 5.62(s, 2H, 3,6-H), 3.86(dd,J=13.7 Hz, 8.9 Hz, 2H, NCH2), 2.64(dd,J=13.7 Hz, 8.9 Hz, 2H, NCH2), 2.40(s, 6H, COCH3), 2.00(m, 2H, CH), 0.94(d,J=6.5 Hz, 6H, CH3), 0.86(d,J=6.6 Hz, 6H, CH3); MS(EI)m/z: 374[M+]。
3,6-二(硫代乙酰基)-1,4-二异戊基哌嗪-2,5-二酮(2d): 白色粉末,收率36.5%;1H NMRδ: 5.62(s, 2H, 3,6-H), 3.86(m, 2H, NCH2), 2.98(m, 2H, NCH2), 2.40(s, 6H, COCH3), 1.56(m, 2H, CH2CH3), 1.44(m, 4H, CH2CH2), 0.94(d,J=6.5 Hz, 12H, CH3); MS(EI)m/z: 402[M+]。
(3) 3a~3d的合成(以3a为例)
将2a 200 mg(0.45 mmol)溶于3 mol·L-1盐酸甲醇溶液(20 mL)中,搅拌下回流反应1 h。冷却,减压蒸干,将残留物溶于10 mL氯仿和10 mL 2%碘化钾水溶液中,滴加碘0.2 g的氯仿(10 mL)溶液,滴毕,于室温反应至反应液颜色变为棕黄色。分液,水相用氯仿(3×20 mL)萃取,合并有机相,用无水硫酸钠干燥,减压蒸干,残留物经硅胶柱层析[洗脱剂:A=V(石油醚)/V(乙酸乙酯)=8/1]纯化得1,4-二苄基-3,6-桥二硫哌嗪-2,5-二酮(3a) 100 mg,收率59.2%。
用类似方法合成3b~3d。
1,4-二苄基-3,6-桥二硫哌嗪-2,5-二酮(3a): 淡黄色粉末,收率59.2%;1H NMRδ: 7.34(m, 6H, ArH), 7.26(m, 4H, ArH), 5.22(s, 2H, 3, 6-H), 4.82(d,J=14.7 Hz, 2H, NCH2), 4.50(d,J=14.7 Hz, 2H, NCH2); MS(EI)m/z: 356[M+]。
1,4-二正丁基-3,6-桥二硫哌嗪-2,5-二酮(3b): 淡黄色粉末,收率60.0%;1H NMRδ: 5.26(s, 2H, 3,6-H), 3.48(m, 4H, NCH2), 1.60(m, 4H, CH2CH2), 1.34(m, 4H, CH2CH3), 0.94(t,J=7.0 Hz, 6H, CH3); MS(EI)m/z: 288[M+]。
1,4-二异丁基-3,6-桥二硫哌嗪-2,5-二酮(3c): 淡黄色粉末,收率59.5%;1H NMRδ: 5.26(s, 2H, 3,6-H), 3.44(m, 2H, NCH2), 3.24(m, 2H, NCH2), 2.00(m, 2H, CH2CH3), 0.98(d,J=6.5 Hz, 6H, CH3), 0.90(d,J=6.6 Hz, 6H, CH3); MS(EI)m/z: 288[M+]。
1,4-二异戊基-3,6-桥二硫哌嗪-2,5-二酮(3d): 淡黄色粉末,收率58.8%;1H NMRδ: 5.26(s, 2H, 3,6-H), 3.44(m, 4H, NCH2), 1.60(m, 2H, CH2CH3), 1.52(m, 4H, CH2CH2), 0.98(d,J=6.5 Hz, 12H, CH3); MS(EI)m/z: 316[M+]。
2 结果与讨论
2.1 合成
在甘氨酸酐经氮烷基化反应合成1a~1d的过程中,由于甘氨酸酐在其他溶剂中溶解性不好,所以选用二甲基亚砜为溶剂。所用碱为氢化钠,因此最好用干燥无水二甲基亚砜。加入氢化钠后待其充分反应完,即无气泡产生为止,可提高收率。该氮烷基化反应为双分子亲核取代反应,在双分子亲核取代反应中卤烷烃的活性顺序为:伯卤代烷烃>仲卤代烷烃>叔卤代烷烃>芳香卤代烃。因此本文选用伯卤代烷烃进行反应。实验也发现溴代异丁烷的收率要比其他几个烷烃低,仅为56.8%,分析原因可能是异丁烷β-位位阻较大所致。
在2a~2d的合成中,使用NBS为溴化剂比用溴好,收率更高。但是生成的溴取代物仍然不稳定,因此在合成中不经分离纯化直接用于下步反应,也能取得较高收率。
在2a~2d水解脱去乙酰基生成巯基后,也可不用纯化直接将生成的顺式反式产物用于下步氧化反应。因为只有顺式的产物空间上靠得近,能被氧化形成二硫键,反式的由于空间上隔得远不能发生氧化反应,所以不影响反应的进行。
2.2 2,5哌嗪二酮环的选择
当2,5-哌嗪二酮环的3,6-位有烷基时,不管用何种溴化试剂,均不能获得单一产物。在本文的研究中,我们选用了环(L-脯-L-脯)二肽作为研究对象,用NBS溴化时,薄层分析发现大量的原料点和一个少量的产物点,用LC-MS分析发现得到了四溴代产物(Scheme 2)。经查阅文献[24]推测因在3,6-位上发生溴代以后,由于3,6-位上有烷基,则可发生HBr的消除反应形成双键,双键上再加成Br生成四溴代产物。即使溴化剂少于理论量,仍然会发生上述反应。所以本文所使用的方法只能用于合成3,6-位无取代烷基或为无α-氢的取代基如苯基。当3,6-位有取代烷基时,不能采用Trown合成法。因为溴代时会发生消除加成反应形成四溴代产物,其与硫代乙酸钾反应不会生产硫代产物,而会生成脱硫产物[24]。
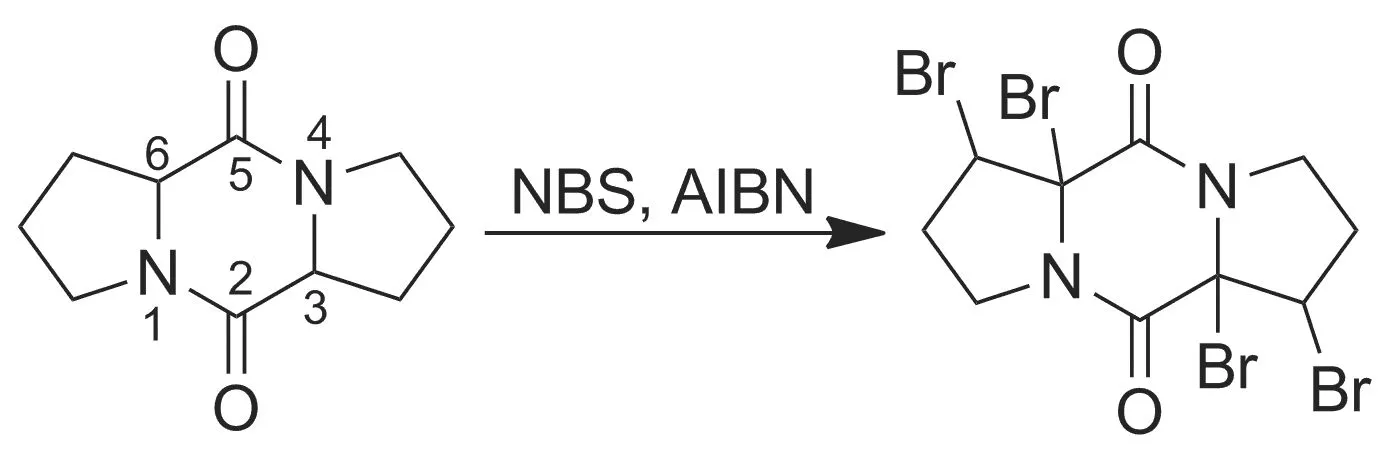
Scheme 2
以改良的Trown的合成方法,利用甘氨酸酐为原料,通过氮烷基化、N-溴代丁二酰亚胺溴化、取代、脱保护及氧化合成了4个简单的桥二硫哌嗪二酮类小分子化合物,这类小分子化合物均含有二硫键,有望作为H2S供体用于抗炎、扩张血管和心血管保护、神经保护、抗肿瘤等领域。在接下来的实验中,将研究其H2S的释放与其生物活性的关系。
[1] Wang R. Two′s company,three′s a crowd:Can H2S be the third endogenous gaseous transmitter?[J].FASEB J, 2002,16(13):1792-1798.
[2] Kamoun P. Endogenous production of hydrogen sulfide in mammals[J].Amino Acids,2004,26(3):243-254.
[3] Shibuya N, Mikami Y, Kimura Y,etal. Vascular endothelium expresses 3-mercaptopyruvate sulfurtransferase and produces hydrogen sulfide[J].J Biochem,2009,146(5):623-626.
[4] Yang G, Wu L, Jiang B,etal. H2S as a physiologic vasorelaxant:Hypertension in mice with deletion of cys-tathionine gamma-lyase[J].Science,2008,322(5901):587-590.
[5] Calvert J W, Coetzee W A, Lefer D J. Novel insights into hydrogen sulfide—mediated cytoprotection[J].Antioxid Redox Signal,2010,12(10):1203-1217.
[6] Wang X, Wang L, Sheng X,etal. Design,synthesis and biological evaluation of hydrogen sulfide releasing derivatives of 3-n-butylphthalide as potential antiplatelet and antithrombotic agents[J].Org Biomol Chem,2014,12(31):5995-6004.
[7] Kodela R, Chattopadhyay M, Kashfi K. Synthesis and biological activity of NOSH-naproxen(AVT-219) and NOSH-sulindac(AVT-18A) as potentanti-inflammatory agents with chemotherapeutic potential[J].Medchemcomm,2013,4(11):1472-1481.
[8] David J P, David J L. Emergence of hydrogen sulfide as an endogenous gaseous signaling molecule in cardiovascular disease[J].Circ Res,2014,114(4):730-737.
[9] 蔡文杰,琚立华,朱依纯. 硫化氢的治疗性应用研究进展[J].中国药理学通报,2009,25(7):854-856.
[10] Li L, Whiteman M, Guan Y Y,etal. Characterization of a novel,water-soluble hydrogen sulfide-releasing molecule(GYY4137):New insights into the biology of hydrogen sulfide[J].Circulation,2008,117(18):2351-2360.
[11] Deleon E R, Stoy G F, Olson K R. Passive loss of hydrogen sulfide in biological experiments[J].Anal Biochem,2012,421(1):203-207.
[12] Benavides G A, Squadrito G L, Mills R W,etal. Hydrogen sulfide mediates the vasoactivity of garlic[J].Proc Natl Acad Sci USA,2007,104(46):17977-17982.
[13] Wallace J L, Caliendo G, Santagada V,etal. Gastroin testinal safety and anti-inflammatory effects of a hydrogen sulfide-releasing diclofenac derivative in the rat[J].Gastroenterology,2007,132(1):261-271.
[14] Zhao Y, Wang H, Xian M. Cysteine-activated hydrogen sulfide(H2S) donors[J].J Am Chem Soc,2011,133(1):15-17.
[15] Zhao Y, Bhushan S, Yang C,etal. Controllable hydrogen sulfide donors and their activity against myocardial ischemia-reperfusion injury[J].ACS Chem Biol,2013,8(6):1283-90.
[16] Zhou Z, Rekowski M V W, Coletta C,etal. Thioglycine and L-thiovaline:Biologically active H2S donors[J].Bioorg Med Chem,2012,20(8):2675-2678.
[17] Ernst-Russell M, Chai C L, Hurne A M,etal. Structure revision and cytotoxic activity of the scabrosin esters,epidithiopiperazinediones from the lichen Xanthoparmelia scabrosa[J].Aust J Chem,1999,52:279-283.
[18] Trown P W. Antiviral activity ofN,N′-dimethyl-epidithiapiperazinedione,a synthetic compound related to the gliotoxins,LL-S88αandb,chetomin and the sporidesmins[J].Biochem Biophys Res Commun,1968,33:402-407.
[19] Hino T, Sato T. Synthesis of 3,6-diethoxycarbonyl-3,6-epipolythia-2,5-piperazinedione derivatives[J].Tetrehedron lett,1971,12(33):3127-3129.
[20] Ohler E, Poisel H, Tataruch F,etal. Studies in the synthesis of the antibiotics gliotoxin,sporidesmin,aranotin,and chaetocin.IV.Preparation of epidithio-L-prolyl-L-proline anhydride[J].Chem Ber,1972,105(2):635-641.
[21] Srinivasan A. Synthesis of sulfur-bridged piperazinediones by reaction of 3,6-dibromo-1,4-dimethyl-2,5-piperazinedione with geminal dithiols[J].J Heterocyclic Chem,1981,18(8):1545-1548.
[22] Abil E A, Stephen T H, William B M,etal. A concise approach to the epidithiodiketopiperazine(ETP) core[J].Tetrahedron Lett,2006,47(14):2387-2390.
[23] Jiang H, Nicole N, Philip S,etal. Synthesis and activity of new epipolythiopiperazine-2,5-dione compounds[J].Aust J Chem,1993,46(11):1743-1754.
[24] Yoshimura J, Sugiyama Y, Nakamura H. Synthesis and substitution of 1,3,4,6-tetra-substituted-3,6-dihalogeno-2,5-piperazinediones[J].Bull Chem Soc Japan,1973,46(9):2850-2853.
《合成化学》约稿函
尊敬的各位专家学者:
《合成化学》自1993年创刊以来,在各位专家学者的支持下得到了快速发展。于2008年和2011年两次入选“中文核心期刊要目总览(化学类)”。2003年以来被连续收录为“中国科技论文统计源期刊”(中国科技核心期刊)。为了进一步提升《合成化学》的学术质量和影响力,特向各位专家学者约稿。编辑部将采取以下鼓励性措施:
1、对于学术质量较高的研究论文进行网络优先出版,并全额免除版面费。
2、对于排队出版的快递论文、研究简报、制药技术及综合评述类文章,版面费均有所降低。
3、以上措施适用于2016年6月1日起所投稿件,未尽事宜,可来电来函咨询。
诚盼各位专家学者踊跃投稿!
投稿网址:http://hchxcioc.com, Tel. 028-85255007, E-mail: hchx@cioc.ac.cn
《合成化学》编辑部
Synthesis of Epidithiapiperazinediones(ETPs) as Hydrogen Sulfide Donors
CHEN Chuan1a,1b*, ZHANG Chun-yan1a,1b, ZHAO Yu-xi1a,1b
(a. Department of Pharmacy; b. Institute of Medicine, 1. North Sichuan Medical College, Nanchong 637000, China)
Four simple epidithiapiperazinediones(ETPs) were synthesized using glycine anhydride as starting material, by alkylation, bromination withN-bromosuccinimide, substitution, hydrolysis and oxidation with I2,viaimproved Trown’s synthetic method. The structures were confirmed by1H NMR and MS(EI).
glycine anhydride; gas transmitter; hydrogen sulfide donor; Trown’s synthetic method; epidithiapiperazinedione; synthesis
2017-01-12
川北医学院科研发展计划重点项目(CBY15-A-ZD11)
陈钏(1983-),女,汉族,四川南充人,助教,主要从事药物化学的研究。 E-mail: 176165515@qq.com
O622.6; O622.7
A
10.15952/j.cnki.cjsc.1005-1511.2017.04.17010

