鱼藤素断环结构氨基酸衍生物的合成及其抗肿瘤活性
孙婧雯, 姜志辉, 吴碧娟, 谭翠雯, 吴新荣*
(1. 华南理工大学 食品科学与工程学院,广东 广州 510641;2. 广州军区广州总医院 药学部,广东 广州 510010)
·研究论文·
鱼藤素断环结构氨基酸衍生物的合成及其抗肿瘤活性
孙婧雯1,2, 姜志辉2, 吴碧娟2, 谭翠雯2, 吴新荣1,2*
(1. 华南理工大学 食品科学与工程学院,广东 广州 510641;2. 广州军区广州总医院 药学部,广东 广州 510010)
采用化学法,以异戊烯醛和2,4-二羟基苯甲醛为起始原料,经烯醛加成和醛胺缩合反应合成了4种新的鱼藤素断环结构氨基酸衍生物(3a~3d),其结构经1H NMR,13C NMR和LC-MS表征。采用CCK8法将3a~3d作用于H1299肺癌细胞和HBE正常细胞,对其抗肿瘤活性和毒性进行初步研究。结果表明:3a~3d对肺癌H1299细胞增殖表现出不同程度的抑制作用,均呈现时间浓度依赖性。与鱼藤素相比,3a~3d的抗肿瘤活性下降, 3d的活性最好,IC50为655.8±34.7μmol·L-1,但对HBE正常肺细胞的毒性明显小于鱼藤素。
异戊烯醛; 2,4-二羟基苯甲醛; 鱼藤素; 氨基酸衍生物; 合成; 抗肿瘤活性
肺癌是目前世界上发病率和死亡率最高的恶性肿瘤之一,其中80%~85%为非小细胞肺癌(NSCLC)[1]。吸烟是引起肺癌的主要环境因素,遗传、环境污染及煤矿建筑等行业的职业暴露和饮食习惯也是导致肺癌的重要原因。近年来,肺癌的发病率不断升高,对肺癌进行有效的治疗和预防已成为我国癌症研究中一个急迫的方向。经手术、放疗和化疗等综合治疗后,其5年生存率仍低于15%[2]。因此,开发低毒可持续的抗肿瘤药物对肺癌的治疗具有重大意义。
Scheme 1
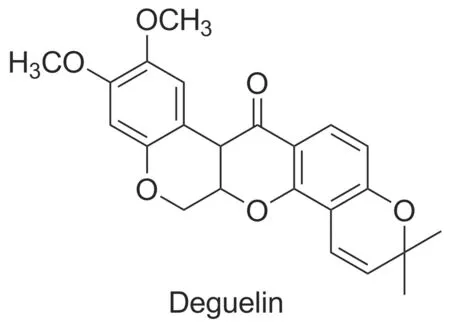
Chart 1
鱼藤素(Deguelin, Chart 1)是一种天然异黄酮类化合物,可以从豆科植物鱼藤和灰叶属的非洲山毛豆中提取获得[3]。鱼藤素起初被用作毒鱼剂,后被发现对肺癌、乳腺癌、胰腺癌、淋巴癌、骨髓瘤及肝癌等多种癌症具有化学预防和化学治疗作用[4-5],是一种具有巨大潜力的抗肿瘤前药。尽管实验表明,鱼藤素在有效浓度范围内有良好的抗肿瘤活性。但当其剂量大于有效浓度,或作用时间过长时,具有一定的毒性,实验小鼠会出现类似帕金森病的症状[6]。对鱼藤素进行结构改造,增强其抗肿瘤活性或水溶性,降低其毒性,直接或间接降低其给药浓度,从而使毒副作用减小是鱼藤素抗肿瘤研究的一个重要方向。
氨基酸是一种生命活动的基本物质,具有良好的生物相容性和细胞亲和性,氨基酸的引入可以提高活性物质对靶向细胞的选择,更容易通过细胞膜,从而提高其生物利用度[7],为寻求高效低毒的抗肿瘤药物开辟途径。目前国内有大量天然药物因水溶性问题限制了其临床应用,长春碱、桦木酸、3-氧代齐墩果酸、喜树碱、甘草酸及甘草次酸是代表性的化合物,在自然界中分布较广,个别化合物的衍生药物已进入Ⅰ期临床,但由于水溶性和一些毒副作用,限制了它们的进一步研究应用。氨基酸、短肽对天然药物活性基团进行修饰,不仅改善它们的水溶性问题,而且提高了其抗肿瘤和抗炎效果[8]。
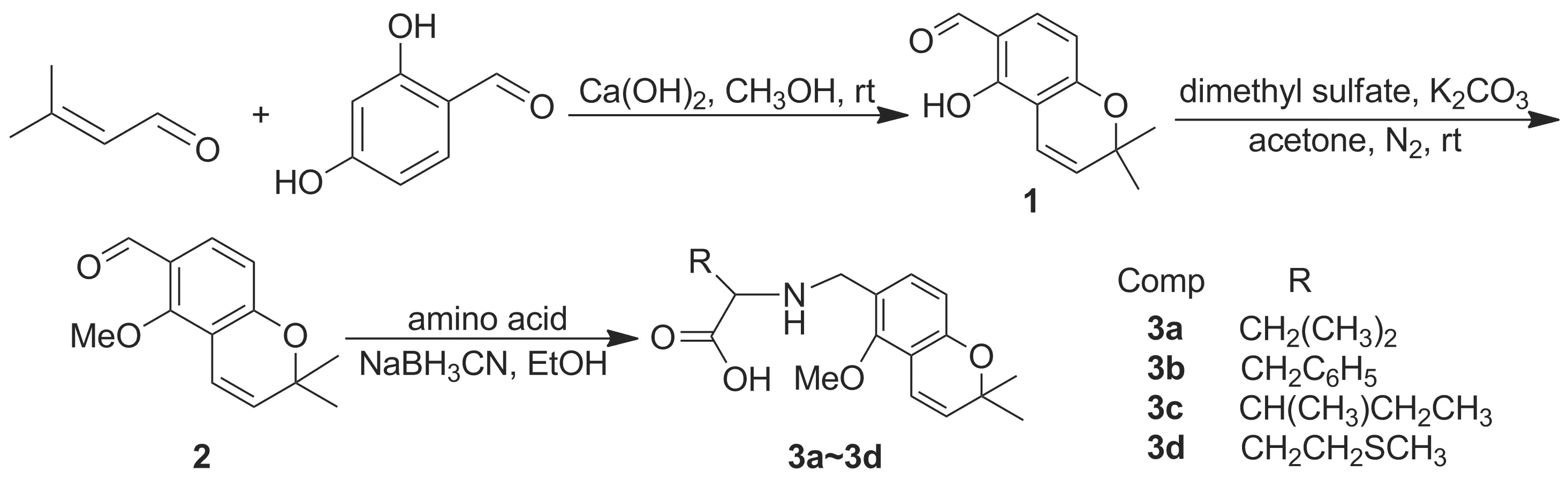
本课题组在对鱼藤素进行结构改造的过程中发现,鱼藤素具有独特的刚性五环结构,由于空间位阻的存在,不打破其刚性结构,直接与活性物质相连十分困难。基于以上考虑,本文参照鱼藤素改造的相关研究[9-11],选取鱼藤素活性部位对其进行合成,并与具有良好的生物相容性和细胞亲和性的氨基酸相连以期合成活性良好的目标物。以异戊烯醛和2,4-二羟基苯甲醛为原料,先后经加成和缩合反应合成了4种新型的5-甲氧基-2,2-二甲基-二氢-苯并吡喃-6-亚甲基氨基酸衍生物(3a~3d, Scheme 1),其结构经1H NMR,13C NMR和LC-MS表征。并对化合物的抗肿瘤活性和毒性进行了初步验证。
1 实验部分
1.1 仪器与试剂
AVANCE III HD 600型核磁共振仪(DMSO-d6为溶剂,TMS为内标);HPLC-6400型三级四级杆液质联用仪;ELX800型酶标仪。
H1299肺癌细胞和HBE正常肺细胞,广州军区广州总医院医学实验科;2,4-二羟基苯甲醛(批号Q26415,纯度99%)和硫酸二甲酯(批号Y5050,纯度99%),山东西亚化学工业有限公司;异戊烯醛(批号CK200069,纯度98%),安耐吉化学;氰基硼氢化钠(批号C10030449,纯度95%),上海麦克林生化科技有限公司;亮氨酸(批号101528664,纯度99.5%)、苯丙氨酸(批号1001465864,纯度99%)、异亮氨酸(批号101646063,纯度98%)和蛋氨酸(批号101604328,纯度98%),美国Sigma公司;其余所用试剂均为分析纯。
1.2 合成
(1) 1的合成[12]
在反应瓶中依次加入甲醇150 mL, 2,4-二羟基苯甲醛1.0 g(6.71 mmol)和氢氧化钙0.745 g(10.06 mmol),搅拌使其溶解;待其形成碱性体系(30 min),缓慢滴加异戊烯醛3.045 g(36.2 mmol),于室温反应12 h。加入1 mol·L-1盐酸淬灭反应,调至pH 1~2,蒸除甲醇,水相用乙酸乙酯(3×150 mL)萃取,萃取液依次用饱和食盐水(2×100 mL)洗涤,无水硫酸钠干燥,蒸干后经快速硅胶柱层析[洗脱剂:A=V(石油醚) ∶V(乙酸乙酯)=9 ∶1]纯化得黄色油状液体1 0.68 g,产率50%;1H NMR(600 MHz, CDCl3)δ: 11.62(s, 1H), 9.63(s, 1H), 7.37(m, 1H), 6.65(m, 1H), 6.40(d,J=8.5 Hz, 1H), 5.74(m, 1H), 1.44(s, 6H);13C NMR(100.63 MHz)δ: 194.5, 160.6, 158.7, 134.7, 128.6, 115.2, 115.1, 109.4, 108.8, 78.2, 28.4; LC-MSm/z: 203.1{[M-H]+}。
(2) 2的合成[12]
在反应瓶中加入碳酸钾2.43 g(17.6 mmol),氮气保护,缓慢注入1 1.80 g(8.8 mmol)的无水丙酮(15 mL)溶液,滴加硫酸二甲酯1.67 g(13.2 mmol),滴毕,氮气保护下于室温反应20 h。加入蒸馏水20 mL淬灭反应,蒸除丙酮,水相用1 mol·L-1盐酸酸化至pH 2~3,用乙酸乙酯(3×100 mL)萃取,萃取液依次用饱和食盐水(2×50 mL)洗涤,无水Na2SO4干燥,蒸干,粗产物经快速硅胶柱层析(洗脱剂:A=10 ∶1)纯化得黄色油状液体2 1.5 g,产率78%;1H NMR(600 MHz, CDCl3)δ: 10.18(s, 1H), 7.66(d,J=8.6 Hz, 1H), 7.27(s, 1H), 6.63(dd,J=31.4 Hz, 9.3 Hz, 2H), 5.86(m, 1H), 3.91(s, 3H), 1.47(s, 6H);13C NMR(100.63 MHz)δ: 188.3, 160.0, 159.9, 130.5, 129.8, 122.5, 115.9, 114.4, 113.4, 64.4, 28.2; LC-MSm/z: 219.2{[M+H]+}。
(3) 3a~3d的合成
在反应瓶中依次加入2 0.22 g(1 mmol),氰基硼氢化钠0.13 g(2 mmol),亮氨酸0.26 g(2 mmol)和甲醇150 ml,搅拌下回流(60 ℃)反应12 h。蒸除甲醇,水相用乙酸乙酯(3×150 mL)萃取,萃取液依次用饱和食盐水(2×100 mL)洗涤,无水Na2SO4干燥,蒸除溶剂,残余物经硅胶柱层析(洗脱剂:A=3 ∶1)纯化得淡黄色固体3a 0.17 g。
用类似方法合成3b~3d。
3a: 产率52%;1H NMR(600 MHz)δ: 7.18(d,J=8.4 Hz, 1H), 6.53(t,J=8.6 Hz, 2H), 5.78(d,J=10.0 Hz, 1H), 3.77(d,J=13.0 Hz, 2H), 3.70(s, 3H), 3.62(d,J=13.1 Hz, 2H), 3.02(t,J=7.1 Hz, 1H), 2.50(dt,J=3.5 Hz, 1.7 Hz, 1H), 1.78(dp,J=13.4 Hz, 6.7 Hz, 1H), 1.35(s, 6H), 1.23(s, 1H), 0.84(d,J=6.6 Hz, 3H), 0.79(d,J=6.6 Hz, 3H);13C NMR(151 MHz, DMSO-d6)δ: 175.35, 154.76, 153.29, 131.38, 130.58, 117.01, 114.65, 112.22, 76.09, 62.74 , 60.70, 45.44, 41.95, 40.34, 40.13, 39.99, 39.85, 39.71, 39.57, 27.82, 24.95, 23.22, 22.73; LC-MSm/z: 334.9{[M+H]+}。
3b: 淡黄色固体,产率51%;1H NMR(600 MHz)δ: 7.20(m, 4H), 7.13(t,J=6.7 Hz, 1H), 6.95(d,J=8.1 Hz, 1H), 6.45(dd,J=20.2 Hz, 9.1 Hz, 2H), 5.74(d,J=9.9 Hz, 1H), 3.61(d,J=13.0 Hz, 2H), 3.54(s, 3H), 3.42(d,J=13.0 Hz, 1H), 3.16(t,J=6.4 Hz, 1H), 2.98(dd,J=13.5 Hz, 4.8 Hz, 1H), 2.73(dd,J=13.4 Hz, 8.1 Hz, 1H), 2.50(m, 1H), 1.33(s, 6H);13C NMR(151 MHz)δ: 176.33, 154.53, 152.82, 140.43, 131.21, 130.12, 129.80, 128.24, 126.10, 124.88, 117.04, 114.56, 111.98, 75.96, 64.34, 62.49, 46.11, 40.32, 40.15, 40.05, 39.83, 39.83, 39.76, 39.50, 27.85; LC-MSm/z: 368.2{[M+H]+}。
3c: 黄色固体,产率55%;1H NMR(600 MHz)δ: 7.15(d,J=8.4 Hz, 1H), 6.48(dd,J=9.0 Hz, 6.9 Hz, 2H), 5.74(d,J=10.0 Hz, 1H), 3.70(d,J=13.0 Hz, 2H), 3.56(d,J=13.0 Hz, 4H), 2.84(d,J=4.8 Hz, 1H), 2.46(dt,J=3.5 Hz, 1.7 Hz, 2H), 1.31(s, 6H), 0.80(d,J=6.8 Hz, 3H), 0.75(t,J=7.4 Hz, 3H);13C NMR(151 MHz)δ: 154.78, 153.20, 131.33, 130.55, 117.02, 114.62, 112.20, 76.07, 66.65, 62.73, 46.26, 40.35, 40.27, 40.13, 40.00, 39.92, 39.71, 39.57, 37.42, 27.84, 25.67, 16.28, 12.13; LC-MSm/z: 333.3{[M+H]+}。
3d: 白色固体,产率61%;1H NMR(600 MHz)δ: 7.18(d,J=8.4 Hz, 1H), 6.53(d,J=3.1 Hz, 1H), 6.51(d,J=4.7 Hz, 1H), 5.77(d,J=9.9 Hz, 1H), 3.75(m, 1H), 3.70(s, 3H), 3.61(m, 4H), 3.03(t,J=6.0 Hz, 1H), 2.52(m, 3H), 2.00(s, 3H), 1.35(s, 6H);13C NMR(151 MHz)δ: 154.73, 153.20, 131.33, 130.56, 117.02, 114.62, 112.18, 76.07, 62.75, 61.75, 45.78, 40.37, 40.16, 40.09, 39.90, 39.81, 39.68, 39.54, 32.47, 30.66, 27.85, 15.05; LC-MSm/z: 352.2{[M+H]+}。
1.3 抗肿瘤活性及毒性测定
参照文献方法[13],采用CCK8(Cell Counting Kit-8)法测定化合物的抗肿瘤活性。取对数生长期的H1299肺癌细胞和HBE正常肺细胞,以5×104个/mL的密度接种于96孔板,于5%CO2, 37 ℃培养箱中培养过夜,待细胞贴壁后,分别加入不同浓度(0.5 mmol·L-1, 1.0 mmol·L-1, 1.5 mmol·L-1, 2.0 mmol·L-1和2.5 mmol·L-1)待测化合物3a~3d,作用于H1299细胞评价其抗肿瘤活性,作用于HBE细胞评价其毒性。每个浓度设5个平行组,并设不加细胞和药液的培养基空白组和只加细胞不加药的对照组,培养24 h, 48 h和72 h,以酶标仪分别测其450 nm处的吸光度值(A),实验重复3次。按公式[(A药液-A空白)/(A对照-A空白)×100%]计算其存活率,使用GraphPad Prism 6软件计算72 h的半数抑制浓度(IC50),并以其存活率绘制时间剂量图。
2 结果与讨论
2.1 合成
异戊烯醛与2,4-二羟基苯甲醛在碱催化下发生加成反应合成1,对该步反应条件进行优化。结果显示在催化剂用量为2,4-二羟基苯甲醛的1.5 eq.,反应效果较佳。2的醛基与氨基酸的氨基在氰基硼氢化钠催化下进行反应,合成3a~3d。该步反应虽然理论上醛基与甲氧基共轭,但由于处于邻位增大其反应活性,并且在反应过程中加热回流,延长反应时间,实际缩合效果不错。
2.2 抗肿瘤活性
3a~3d的抗肿瘤活性筛选结果见表1。由表1可见,经过结构改造所得化合物3a~3d的IC50分别为901.0±7.1, 704.1±34.9, 682.8±38.4, 655.8±34.7 μmol·L-1,远大于鱼藤素(2.0±0.21 μmol·L-1),说明其抗肿瘤活性降低。

表1 化合物对H1299的半数抑制浓度
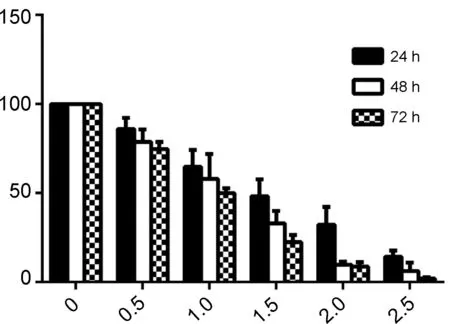
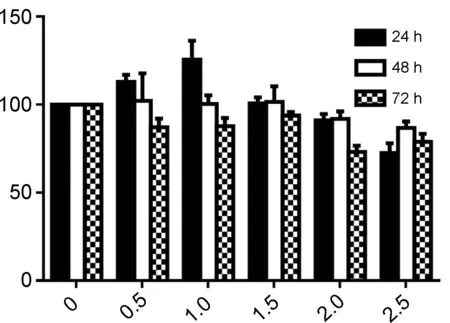
浓度分别为0 mmol·L-1, 0.5 mmol·L-1, 1.0 mmol·L-1, 1.5 mmol·L-1, 2.0 mmol·L-1和2.5 mmol·L-1的3a~3d作用于H1299细胞24 h, 48 h和72 h后,细胞存活率见图1。由图1可见,与对照组相比,3a~3d作用于H1299肺癌细胞对增殖的抑制作用均均呈时间依赖性和浓度依赖性。本课题组以往的实验数据表明,鱼藤素处理H1299细胞72 h,在10~2 000 nmol·L-1浓度范围,细胞的增殖抑制率为20.1%~54.1%,其半数抑制浓度约为2 μmol·L-1[14]。
所合成的4种鱼藤素断环结构与氨基酸的衍生物,对H1299肺癌细胞有不同程度的抑制作用,均表现出了时间浓度依赖性。计算其半数抑制浓度,相比鱼藤素而言,其抗肿瘤活性下降。该文所进行的结构改造研究保留了鱼藤素一半的结构,虽与氨基酸相连,活性仍丧失较大。研究表明,A环中的两个甲氧基对其活性同样非常关键[11],在今后的改造中,应尝试保留其A、D、E环,打开BC环,这样既打破其刚性结构,降低合成难度,又可保证其活性。
2.3 毒性测定
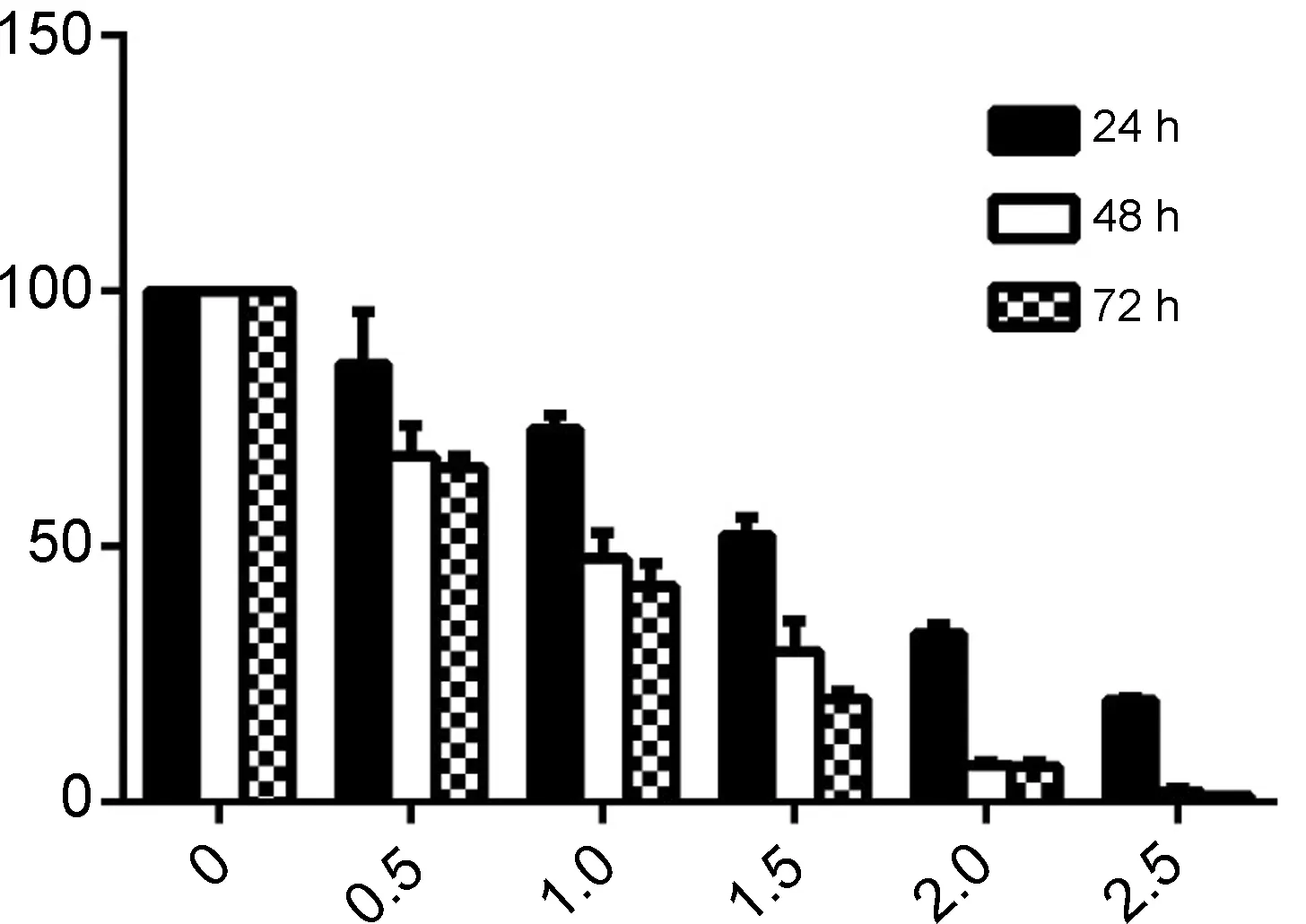
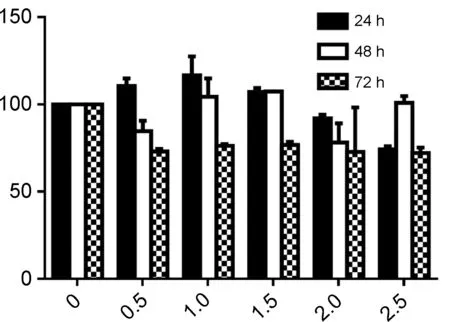
毒性成为限制鱼藤素的一个很重要的因素,文献报道,1 μmol·L-1鱼藤素作用于HBE正常细胞,其抑制率达到40% 左右[9],其对正常细胞毒性大,限制其抗肿瘤应用。本文将化合物3a~3d作用于HBE细胞,结果见图2。由图2可见,3a~3d对HBE细胞的增殖物明显抑制,在低剂量时,有促进其生长的作用。在对肺癌H1299细胞的抑制率50%左右的时候,在24 h和48 h时对其增殖有促进作用,72 h时出现轻微抑制。在对肺癌H1299细胞的抑制率达到80%以上时,对HBE细胞的抑制在20%左右,可判定其毒性大大降低,具有应用于肿瘤治疗的潜力。
c(3a)/mmol·L-1
c(3b)/mmol·L-1
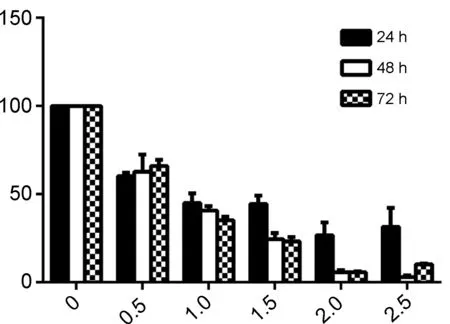
c(3c)/mmol·L-1
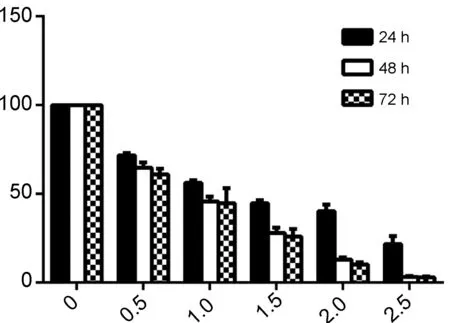
c(3d)/mmol·L-1
设计并合成了4种鱼藤素断环结构氨基酸衍生物,其对肿瘤细胞的增殖有不同程度抑制作用。与鱼藤素比,改造后的化合物对肿瘤细胞的抑制活性降低,但其对正常肺细胞的毒性也大大降低。还目标化合物的生物利用度、神经毒性及体内活性有待进一步研究。
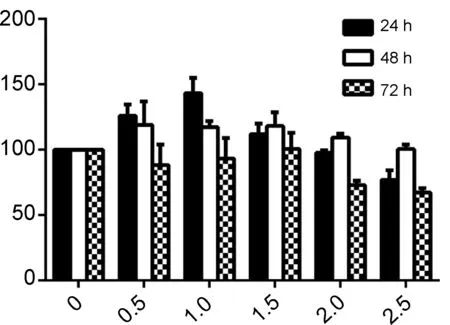
c(3a)/mmol·L-1
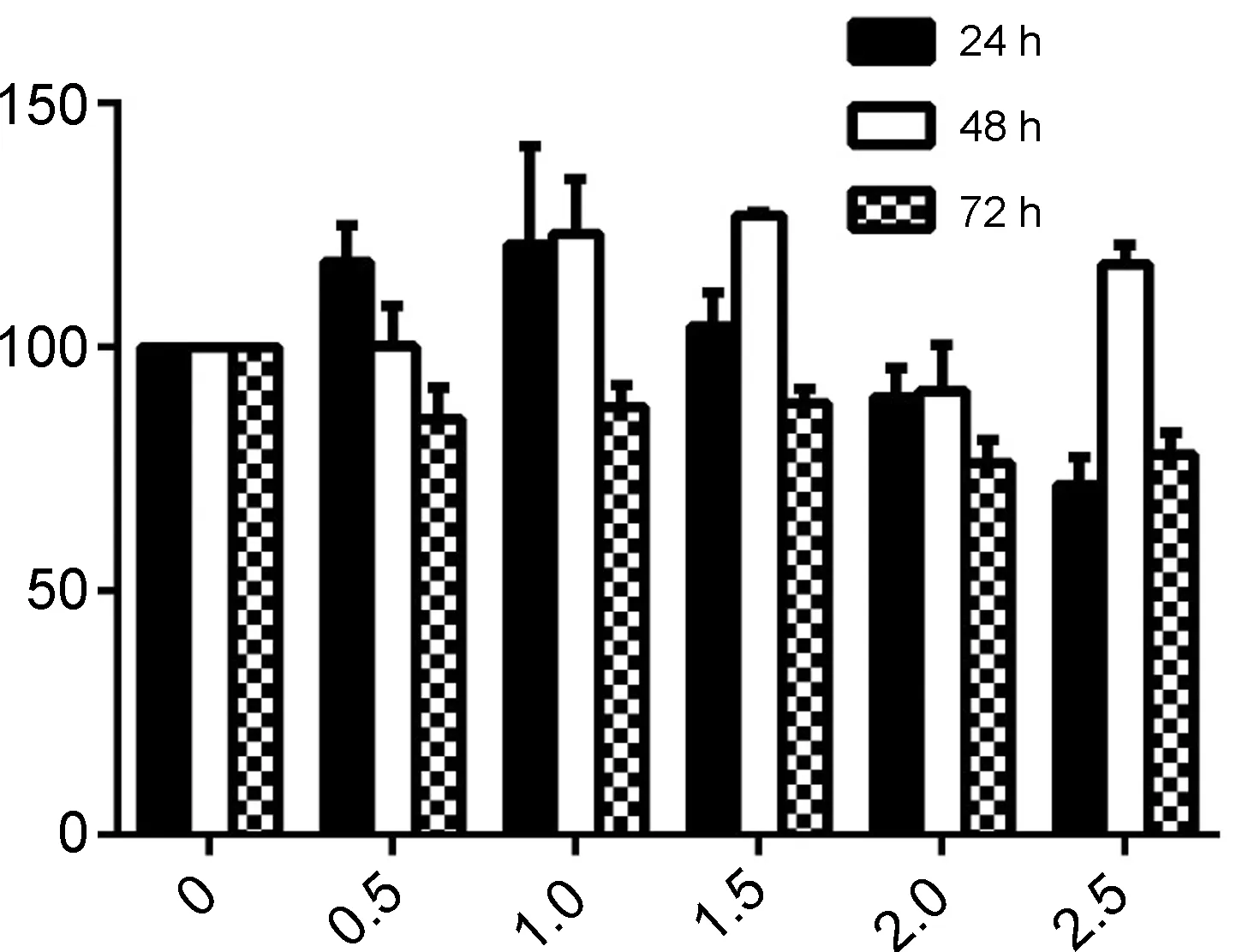
c(3b)/mmol·L-1
c(3c)/mmol·L-1
c(3d)/mmol·L-1
[1] Gupta N, Hatoum H, Dy G K. First line treatment of advanced non-small-cell lung cancer-specific focus on albumin bound paclitaxel[J].International Journal of Nanomedicine,2014,9:209-221.
[2] Leong D, Rai R, Nguyen B,etal. Advances in adjuvant systemic therapy for non-small-cell lung cancer[J].World Journal of Clinical Oncology,2014,5(4):633-645.
[3] Wang Y, Ma W, Zheng W. Deguelin,a novel anti-tumorigenic agent targeting apoptosis,cell cycle arrest and anti-angiogenesis for cancer chemoprevention[J].Mol Clin Oncol,2013,1(2):215-219.
[4] Mehta R R, Katta H, Kalra A,etal. Efficacy and mechanism of action of Deguelin in suppressing metastasis of 4T1 cells[J].Clin Exp Metastasis,2013,30(7):855-866.
[5] Boreddy S R, Srivastava S K. Deguelin suppresses pancreatic tumor growth and metastasis by inhibiting epithelial-to-mesenchymal transition in an orthotopic model[J].Oncogene,2013,32(34):3980-3991.
[6] Kim W Y, Chang D J, Hennessy B,etal. A novel derivative of the natural agent Deguelin for cancer chemoprevention and therapy[J].Cancer Prevention Research,2008,1(7):577-587.
[7] Bender D M, Bao J, Dantzig A H,etal. Synthesis,crystallization,and biological evaluation of an orally active prodrug of gemcitabine[J].Journal of Medicinal Chemistry,2009,52(22):6958-6961.
[8] 王军,胡小丽,文伟河,等. 氨基酸及短肽对天然药物的结构修饰[J].中国现代应用药学,2011,28(12):1095-1100.
[9] Lee S C, Min H Y, Choi H,etal. Synthesis and evaluation of a novel Deguelin ferivative,L80,which disrupts ATP binding to the C-terminal domain of heat shock protein 90[J].Molecular Pharmacology,2015,88(2):245-255.
[10] Wang L, Chen G, Lu X,etal. Novel chalcone derivatives as hypoxia-inducible factor(HIF)-1 inhibitor:Synthesis,anti-invasive and anti-angiogenic properties[J].European Journal of Medicinal Chemistry,2015,89:88-97.
[11] Chang D, An H, Kim K,etal. Design,synthesis,and biological evaluation of novel Deguelin-based heat shock protein 90(HSP90) inhibitors targeting proliferation and angiogenesis[J].Journal of Medicinal Chemistry,2012,55(24):10863-10884.
[12] Azevedo C M G, Afonso C M M, Soares J X,etal. Pyranoxanthones:Synthesis,growth inhibitory activity on human tumor cell lines and determination of their lipophilicity in two membrane models[J].European Journal of Medicinal Chemistry,2013,69:798-816.
[13] Fukuda T, Takeda S, Xu R,etal. Sema3A regulates bone-mass accrual through sensory innervations[J].Nature,2013,497(7450):490-493.
[14] 海洋. 鱼藤素对斑马鱼胚胎CyclinD1的表达调控及相关抗肿瘤机制研究[D].广州:华南理工大学,2015.
《合成化学》再次入选中国科技核心期刊
根据中国科学技术信息研究所发布的最新中国科技论文统计结果,《合成化学》被“中国科学论文与引文数据库”再次编入《2016年中国科技核心期刊目录(自然科学卷)》,有效期至2017年12月,这也是《合成化学》连续第12次入选中国科技核心期刊。
《合成化学》编辑部
Synthesis and Antitumor Activities of Ring-truncated Deguelin-amino Acid Conjugates
SUN Jing-wen1,2, JIANG Zhi-hui2, WU Bi-juan2, TAN Cui-wen2, WU Xin-rong1,2*
(1. School of Light Industry and Food, South China University of Technology, Guangzhou 510641, China 2. Department of Pharmacy, Genenral Hospital of Guangzhou Military Command of PLA, Guangzhou 510010, China)
Four novel ring-truncated deguelin-amino acid conjugates(3a~3d) were synthesized by olefine aldehyde addition and aldimine condensation from 3-methylcrotonaldehyde and 2,4-dihydroxybenzaldehyde. The structures were characterized by1H NMR,13C NMR and LC-MS. The anticancer effects and toxicities were investigated by CCK8 method. The results showed that 3a~3d exhibited good inhibition activities and time dose dependence. Although compared with deguelin, antitumor activities of 3a~3d declined, IC50of 3d which has the best activity was 655.8±34.7 μmol·L-1, however their toxicity towards immortalized HBE lung cell were also settled.
3-methylcrotonaldehyde; 2,4-dihydroxybenzaldehyde; deguelin; amino acid conjugate; synthesis; antitumor activity
2016-12-29;
2017-02-27
广东省科技计划项目(2011A080300004); 广州市科技计划项目(201509010012)
孙婧雯(1991-),女,汉族,山东滨州人,硕士研究生,主要从事鱼藤素的合成及抗肿瘤活性的研究。 E-mail: shero1121@126.com
吴新荣,教授,副主任药师, Tel. 020-36653476, E-mail: gzwxrong@yahoo.com
O621.3; O629.71
A
10.15952/j.cnki.cjsc.1005-1511.2017.04.16333

