气血并治方有效组分对缺氧/复氧损伤心肌保护作用的机制研究*
于永慧,张 佩,刘剑刚,李 澎,张大武,王承龙
(中国中医科学院西苑医院心血管病中心 北京 100091)
越来越多的研究表明,心肌能量代谢障碍是急性心肌梗死(Acute myocardial infarction,AMI)后心力衰竭形成的重要原因之一[1],优化心肌能量代谢已成为治疗缺血性心脏病的一个新靶点[2,3]。高能磷酸化合物尤其三磷酸腺苷(Adenosine triphosphate,ATP)是心肌能量的直接提供者,可直接进入细胞通过磷酸化反应参与能量传递。正常心肌每天大约需要消耗30 kg的ATP[4],从而维持膜电位水平和心肌细胞的舒缩功能。ATP储备水平的高低不仅直接关系着细胞正常生理功能的维持,还与细胞生长及凋亡密切相关[5]。因此,增加高能磷酸化合物含量可以促进心肌膜电位和舒缩功能的维持,防止细胞凋亡,对心肌具有保护作用。
气血并治方是由传统活血化瘀名方--血府逐瘀汤化裁而来,是中国中医科学院西苑医院治疗治疗心血管疾病的一种有效制剂。课题组前期实验研究表明,气血并治方全方提取物具有降低血脂、改善血液流变、保护内皮功能以及减轻炎症反应等心血管保护作用[6-7]。但对于心肌能量代谢,尤其是缺氧/复氧(Hypoxia/Reoxygenation,H/R)后心肌细胞高能磷酸化合物代谢的影响尚不明确。本实验采用高效液相色谱分 析 法(High Performance Liquid Chromatograph,HPLC)观察气血并治方对H/R心肌细胞高能磷酸化合物代谢的影响,酶联免疫吸附法(Enzyme-linked immuno sorbent assay,Elisa)检测心肌细胞损伤标志物水平,流式细胞术检测心肌细胞早期凋亡率,探索性观察气血并治方改善H/R心肌细胞能量代谢,从而防止细胞损伤和凋亡的药理作用。
1 材料与方法
1.1 材料
1.1.1 实验动物
出生1-2天的SD乳鼠,雄性,清洁级,体质量16-18 g,北京维通利华实验动物技术有限公司提供,合格证号:SCXK-(京)2012-0001。饲养环境为环境温度0-25℃,湿度40-70%,动物自由饮水和饮食。
1.1.2 实验药物
气血并治方(CWQB)由川芎、赤芍、桃仁、红花、柴胡、枳壳按照3∶3∶3∶2∶2组成,全方水提取物组分由浙江大学药学院提供,主要成分为芍药苷、总黄酮、总酸类物质,每克CWQB相当于含生药33.16 g[8];盐酸曲美他嗪,中国食品药品检定研究所提供,批号100889-201302。
1.1.3 实验试剂
0.25%胰蛋白酶(美国Gibco公司,批号:25200056),脱氧核糖核酸酶(德国Roche,批号:104159),II型胶原酶(美国Sigma,批号:17101015),青霉素-链霉素双抗(美国Gibco公司,批号15140-122),胎牛血清(美国Gibco公司,批号10099-144),高糖DMEM培养基(美国Gibco公司,批号C11995500BT),无糖DMEM培养基(美国Gibco公司,批号11966025)。5′-ATP钠盐(美国Sigma公司,批号A2383)、5′-ADP钠盐(美国Sigma公司,批号01897)、5′-AMP钠盐(美国Sigma公司,批号 A1752),5′-IMP钠盐(美国 Sigma公司,批号I4625);cTnT试剂盒(批号10053),CK-MB试剂盒(批号50057),由北京华英生物技术研究所提供;AnnexinV-FITC/PI Kit凋亡试剂盒(美国Becton Dickinson公司,批号556547)。
1.1.4 实验仪器
AC2-4S1型超净台(新加坡Esco公司),KDC-140HR型高速冷冻离心机(安徽中科中佳科学仪器有限公司),Ultimate3000-API 3200Q TRAP型HPLCMS/MS(美国Thermo Fisher公司),STAT FAX 2100型全自动酶免仪(美国AWARENESS公司),EPICSELITE型流式细胞仪(美国Bekman-Coulter公司)。
2 方法
2.1 原代心肌细胞的提取、培养
出生1-2天的SD大鼠乳鼠12只,雄性,脱臼处死,75%酒精浸泡,消毒皮肤,在无菌条件下剪开皮肤,开胸,切取心脏,放入含有普通肝素的冷(4℃)磷酸盐缓冲液(Phosphate Buffer Solution,PBS)中,挤除血液,去掉心房及主动脉组织,用眼科剪将心脏组织剪碎成约1 mm3大小的组织粒,移入15 mL离心管中。PBS清洗数遍后弃去上清液,分别加入0.125%胰蛋白酶及0.5%(II型胶原酶+DNA酶)的混合液在37℃条件下分次消化(每次25 min),收集除首次消化的细胞悬液,经离心、洗涤后加入等体积含10%胎牛血清、1%青链霉素双抗的DMEM培养基终止消化,吹打均匀后经200目筛网过滤,置于37℃的5%CO2孵箱中差速贴壁去除成纤维细胞,每次30 min,共2次。
将去除成纤维细胞、未贴壁的原代心肌细胞再次接种于含10%胎牛血清、10%马血清、1%双抗的DMEM培养基中,以5×105/mL的细胞密度接种于培养皿,置于37℃的5%CO2孵箱培养,24 h后换液,此后每隔2天及实验干预前换液,取培养第3-4天的细胞进行实验研究。
2.2 原代心肌细胞H/R损伤模型的建立方法
用无糖DMEM培养液洗净旧培养液,同时向盛有无糖DMEM培养液的离心管充入缺氧混合气体(95%N2+5%CO2)15 min,关闭缺氧混合气罐,弃去第3遍清洗的无糖DMEM培养液,将无氧无糖DMEM培养液置于培养皿中,混匀,置于自制密闭盒中持续充入95%N2+5%CO2混合气15 min,充分排尽自制密闭盒中的残余氧气,置于37℃的5%CO2孵箱中培养3 h后,取出换为复氧培养液(1∶4(完全DMEM培养液∶高糖无血清DMEM培养液))继续培养2 h。
2.3 实验分组及处理
取培养第3-4天的原代心肌细胞进行实验,细胞所用缺氧培养液为无糖无血清DMEM培养液,复氧培养液为1份完全DMEM培养液:4份高糖无血清DMEM培养液。实验分组如下:①正常氧组(Control):原代心肌细胞于37℃的5%CO2孵箱中培养3 h后取出,换成复氧培养液继续培养2 h,不加药物干预;②模型组(H/R):原代心肌细胞进行缺氧3 h复氧2 h处理,不加药物干预;③曲美他嗪+H/R组(TMZ):原代心肌细胞进行缺氧3 h和复氧2 h处理,缺氧培养液及复氧培养液中均加入浓度为100 μmol/L的TMZ;④气血并治方有效组分+H/R组(CWQB):原代心肌细胞进行缺氧3 h和复氧2 h处理,缺氧培养液及复氧培养液中均加入1 mmol/L的CWQB。
2.4 各组心肌细胞高能磷酸化合物含量测定
采用标准加入法将ATP、二磷酸腺苷(Adenosine diphosphate,ADP) 、一 磷 酸 腺 苷 (Adenosine monophosphate, AMP) 、 肌 苷 酸 (Inosine 5′-monophosphate,IMP)的标准钠盐各称取10 mg,加入1 mL反应液中(含1 mmol/L的乙二胺四乙酸(EthyleneDiamineTetraaceticAcid,EDTA)和 0.5 mmol/的 HClO4),3 500 rpm 离心 10 min。吸取 0.5 mL上清液放入另一试管中,加入0.175 mL浓度为2.1 mmol/L的KHCO3。充分反应后,3 500 rpm离心10分钟,从样本中吸取20μL进行色谱分析。HPLC参数如下,反相色谱柱:5 μm,15 mm×4.6 mm,柱温:30℃,流动相:30 mmol/L磷酸盐缓冲溶液(pH=5.85,K2HPO4-KH2PO4,含5%甲醇)。根据加入标准钠盐前后的色谱峰高变化,从而计算样品中ATP、ADP和AMP含量,并计算出总腺苷酸量(Total Adenylic Ncid,TAN=(ATP+ADP+AMP))和心肌细胞的能量状态用能荷(Energy Charge,EC=(ATP+1/2ADP)/TAN)。
2.5 各组心肌细胞损伤与早期凋亡情况测定
取各组心肌细胞培养液,采用酶联免疫法测定心肌损伤标志物肌酸激酶同工酶B(Creatinine kinase MB,CK-MB)和心肌肌钙蛋白T(Cardiac troponin T,cTnT)含量。另外,将各组心肌细胞洗涤、消化后,加入AnnexinV-FITC/PI Kit凋亡试剂,4℃避光孵育30 min,同时用等量PBS做阴性对照,离心后加入100 μL PBS重悬,上Bekman流式细胞仪检测,FITC(+)/PI(-)的细胞为早期凋亡细胞。
3 统计学分析
4 结果
4.1 各组心肌细胞高能磷酸化合物含量
HPLC检测细胞裂解液中高能磷酸化合物含量,结果显示,与Control组比较,H/R组、TMZ组、CWQB组AMP的含量显著上升(p<0.05),H/R组、CWQB组ADP含量显著下降(p<0.05),H/R组、TMZ组、CWQB组ATP的含量和TAN、EC水平显著下降(p<0.05)。与H/R组比较,TMZ组、CWQB组的AMP含量下降,ATP、ADP的含量和TAN、EC水平均有所升高(p<0.05),其中TMZ组ADP、ATP、TAN升高程度和CWQB组比较,具有显著性差异(p<0.05)。见表1。
4.2 各组心肌细胞损伤与凋亡情况的测定
采用ELISA法检测心肌损伤标志物CK-MB、cTnT的结果显示,与Control组比较,H/R组CK-MB、cTnT的含量明显上升(p<0.05),说明H/R使心肌细胞受到损伤;与H/R组比较,TMZ组、CWQB组CK-MB、cTnT含量显著下降,其中CWQB组cTnT含量下降更为显著(p<0.05),说明TMZ、CWQB能够减少H/R条件下心肌细胞的损伤,起到一定的保护作用。见表2。
表1 CWQB对H/R损伤心肌细胞高能磷酸化合物含量的影响(±s)
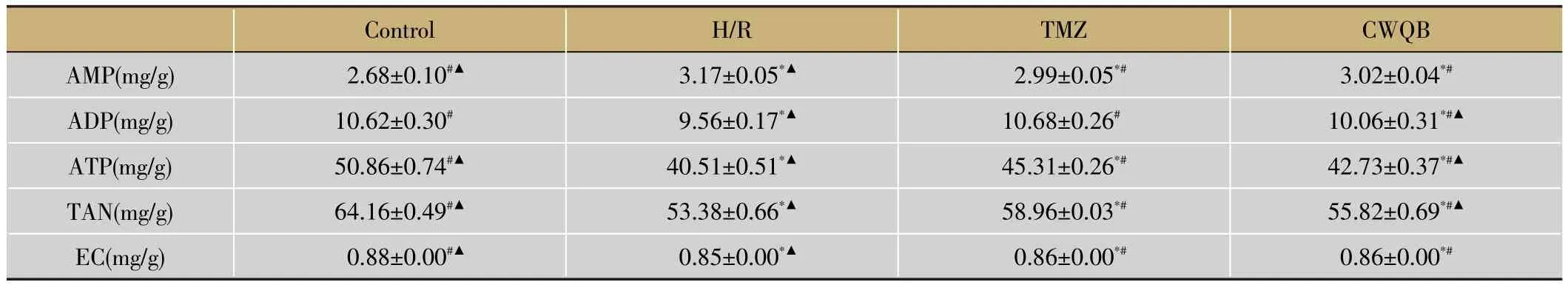
表1 CWQB对H/R损伤心肌细胞高能磷酸化合物含量的影响(±s)
注:与Control组比较,*p<0.05;与H/R组比较,#p<0.05;与TMZ组比较,▲P<0.05。
表2 CWQB对H/R心肌细胞损伤标志物和早期凋亡的影响(±s)

表2 CWQB对H/R心肌细胞损伤标志物和早期凋亡的影响(±s)
注:与Control组比较,*p<0.05;与 H/R 组比较,#p<0.05;与 TMZ组比较,▲p<0.05。
采用流式细胞法测定各组细胞早期凋亡率的结果显示,与Control组比较,各组心肌细胞早期凋亡率显著上升(p<0.01),说明H/R损伤条件下心肌细胞早期凋亡增多;与H/R组比较,TMZ组、CWQB组早期凋亡率有所下降,TMZ组下降更为显著(p<0.05),说明TMZ和CWQB均能降低H/R心肌细胞早期凋亡的发生。见表2。各组代表性早期凋亡率检测结果见图1。
4.3高能磷酸化合物含量与心肌损伤标志物、早期凋亡率的相关性分析
各组心肌细胞高能磷酸化合物含量与心肌损伤标志物进行Pearson相关性分析显示,AMP、ADP、ATP浓度与CK-MB存在直线相关关系(r1=0.613,P=0.034<0.05;r2=-0.738,P=0.006<0.05;r3=-0.620,P=0.038<0.05),ADP浓度与cTnT存在直线相关关系(r4=-0.613,P=0.034<0.05)。其中CK-MB(y)ADP(x)与的直线关系的回归系数R2=0.544,P<0.01,回归方程y=2.058-0.146x。见图2。说明CK-MB水平与ADP浓度呈良好的负相关关系,即ADP水平降低时,心肌损伤标志物CK-MB增多。
各组心肌细胞高能磷酸化合物含量与心肌早期凋亡率进行Pearson相关性分析显示,AMP、ADP、ATP浓度与心肌细胞早期凋亡率存在直线相关关系(r1=0.938,P<0.01;r2=-0.769,P=0.003<0.01;r3=-0.976,P<0.01)与直线回归关系(见图2)。说明早期凋亡率与AMP浓度呈显著正相关,与ADP、ATP浓度呈显著负相关,即AMP浓度升高、ADP与ATP浓度下降时,心肌细胞早期凋亡率增加。
5 讨论
气血并治方是由传统化瘀名方--血府逐瘀汤化裁而来,由川芎、赤芍、桃仁、红花、柴胡、枳壳组成,具有活血理气、化瘀通脉的功效。现代药理学研究表明,血府逐瘀汤组方可以从抗氧化应激[9]、保护血管内皮[10]等方面减轻H/R对心肌细胞的损伤。课题组前期研究也发现,气血并治方有效组分配伍可以通过拮抗蛋白激酶C(Protein Kinase C,PKC)途径、丝裂素活化蛋白激酶(Mitogen activated protein kinase,MAPK)途径[11],抑制内皮细胞损伤条件培养基诱导的平滑肌细胞增殖[12]和内皮素的释放[13],通过多途径、多靶点实现对平滑肌细胞、内皮细胞的保护作用。但气血并治方对缺氧/复氧条件下心肌细胞能量代谢的调节作用尚未见报道,因此本实验在前期研究基础上观察其对H/R损伤心肌细胞能量代谢的影响,为通过改善心肌能量代谢来保护H/R损伤心肌提供科学依据。

图1 流式细胞法测定各组心肌细胞早期凋亡率的免疫荧光二维点图
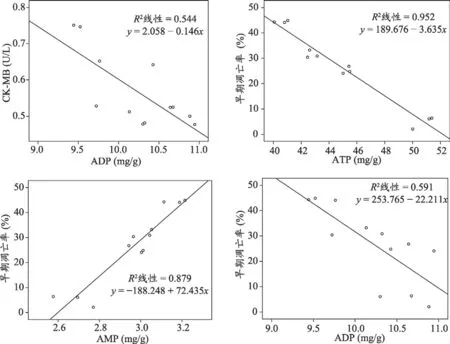
图2 心肌细胞高能磷酸化合物含量与心肌损伤标志物、早期凋亡率的回归分析
本实验研究发现,心肌细胞在缺氧/复氧条件下AMP含量明显升高,而ATP、ADP含量及TAN、EC水平显著下降(P<0.05),说明H/R造成了细胞利用ATP等直接供能物质的能力下降,能量代谢发生障碍。加入TMZ或CWQB进行干预后,ATP、ADP含量及TAN、EC水平有一定程度的升高,表明直接供给心肌细胞的能量相对增多,能量代谢障碍得到改善。心肌损伤标志物及早期凋亡率检测结果支持TMZ或CWQB对缺氧/复氧后的心肌细胞具有保护作用。进一步的相关性分析发现,高能磷酸化合物水平与心肌细胞早期凋亡率存在良好的相关性,AMP浓度与早期凋亡率呈显著正相关,ADP、ATP浓度与早期凋亡率呈负相关(P<0.01)。提示气血并治方可以通过提高ATP、ADP等高能磷酸化合物的含量改善H/R心肌细胞能量代谢障碍,从而防止细胞早期凋亡的发生。
缺氧/复氧造成的心肌细胞损伤与多种病理环节密切相关[14],如大量炎性反应、细胞内钙超载、氧自由基释放等,同时也伴随着心肌高能磷酸化合物储备能力下降[15]、ATP的生成和利用障碍[16],这些病理因素的持续存在将导致细胞凋亡的发生[5]。细胞自身存在一些保护性的内在机制,如降低的ATP浓度可以激活一磷酸腺苷酸活化蛋白激酶(AdenosineMono Phosphate activated Protein Kinase,AMPK)信号通路[17],增加底物的摄取和利用以促进ATP的生成[18]。课题组下一步将从AMPK相关葡萄糖、脂肪酸代谢通路研究气血并治方改善H/R心肌细胞能量代谢的机制。
气血并治方作为由经典方剂化裁而来的中药小复方,可以通过抑制平滑肌细胞增殖、保护内皮细胞、促进心肌细胞能量代谢、防止细胞损伤和凋亡的发生干预心血管疾病的多个治疗靶点,在防治缺血性心脏病中具有显著的临床应用价值。随着现代中药制剂分析和药理学研究的不断深入,以气血并治方为代表的中药小复方多组分在心血管疾病防治中的作用将被更加凸显。
致谢:心肌细胞培养由中国中医科学院西苑医院基础医学研究室李澎副研究员指导完成,谨致谢忱。
1 Ussher J R,Elmariah S,Gerszten R E,et al.The Emerging Role of Metabolomics in the Diagnosis and Prognosis of Cardiovascular Disease. Journalofthe American College of Cardiology,2016,68(25):2850.
2 Jaswal J S,Cadete V J J,Lopaschuk G D.Optimizing cardiac energy substrate metabolism:A noveltherapeuticintervention for ischemic heart disease.Heart&Metabolism,2008,38(1):5-14.
3 SergienkoIV,BugriyM E,BalahonovaT V,et al.The possibility ofusage ofmetabolic correction therapyin patients with ischemic heart disease and heart failure. Rational Pharmacotherapy in Cardiology,2015,3(4):25-31.
4 Azevedo PS, Minicucci MF, Santos PP, etal. Energy metabolism in cardiac remodeling and heart failure.Cardiology in Review,2013,21(3):135-40.
5 Kolwicz SC Jr1,Purohit S,Tian R.Cardiac metabolism and its interactions with contraction, growth,and survival of cardiomyocytes.Circulation Research,2013,113(5):603-616.
6 董国菊,刘剑刚,史大卓,等.气血并治方胶囊治疗颈动脉粥样硬化的临床研究.世界中西医结合杂志,2008,3(1):29-31.
7 刘剑刚,徐浩,董国菊,等.血府逐瘀口服液对冠心病心绞痛血瘀证病人血管内皮功能及血液流变学的影响.中西医结合心脑血管病杂志,2006,4(8):659-661.
8 刘剑刚,马鲁波,张大武,等.均匀设计筛选理气活血中药提取物优化配伍的实验研究.世界科学技术:中医药现代化,2013(9):1882-1889.
9 侯泽,康文英,沃兴德,等.血府逐瘀汤对乳鼠心肌细胞缺血再灌注损伤的影响.中国药物与临床,2006,6(8):590-593.
10 唐汉庆,赵善民,黄俊杰,等.血府逐瘀汤对冠心病血瘀模型家兔心功能、心肌及血管的影响.中国实验方剂学杂志,2015,21(2):165-169.
11 嵇波,史大卓,刘剑刚,等.ox-LDL诱导内皮细胞损伤条件培养基及气血并治方有效组分配伍对平滑肌细胞MAPK、PKC活性和胞内Ca~(2+)荧光强度的影响.北京中医药大学学报,2005,28(2):29-32.
12 嵇波,刘剑刚,史大卓,等.气血并治方有效组分不同配伍对血管内皮细胞损伤条件培养基诱导血管平滑肌细胞增殖的影响.北京中医药大学学报,2005,28(1):30-33.
13 刘剑刚,马迁,史大卓,等.气血并治方有效组分配伍对内皮细胞损伤相关基因调控表达的影响.世界中西医结合大会,2007:56.
14 Jennings RB. Historical perspective on the pathology of myocardial ischemia/reperfusion injury.Circulation Research,2013,113(4):428-438.
15 Lygate C A,Schneider J E,Neubauer S.Investigating cardiac energetics in heart failure.Experimental Physiology,2013,98(3):601-605.
16 Dashty M. A quick look at biochemistry: Carbohydrate metabolism.Clinical Biochemistry,2013,46(15):1339-1352.
17 SaltIP, Hardie DG.AMP-Activated Protein Kinase:An Ubiquitous Signaling Pathway.With Key Roles in the Cardiovascular System..Circulation Research,2017,120(11):1825-1841.
18 BaskinK K,TaegtmeyerH.AnExpandedRoleforAMP-activated Protein Kinase Regulator of Myocardial Protein Degradation.Trends in Cardio-vascular Medicine,2011,21(4):124-127.

