桑黄孔菌属的研究进展
梁晓薇, 刘远超, 黄龙花, 谢意珍, 贺 凤, 胡惠萍*
(1.广东省微生物研究所 省部共建华南应用微生物国家重点实验室 广东省菌种保藏与应用重点实验室 广东省微生物应用新技术公共实验室,广东 广州 510070;2.广东粤微食用菌技术有限公司,广东 广州 510663)
“桑黄”古时亦称“桑耳、桑臣、桑鸡、胡孙眼等”,首次出现“桑黄”之名是唐代甄权撰写的《药性论》。然而流传千年的“桑黄”在本草古籍记载的名称和来源未曾统一,关于其性味归经和功效应用的描述也大相径庭。《药性论》:“桑黄,味甘、辛,无毒”,而《本草纲目》:“桑上寄生(桑耳)”、“桑耳,味甘、性平、有毒。黑者主女子漏下赤白汁,血病,癥瘕积聚,阴痛,阴阳寒热,无子”[1]。我国真正的野生桑黄属于濒危药材,资源极其稀少且生长缓慢[2],与其相似的菌株种类和产量较多,在东亚地区尤其是韩国、日本常被当作“桑黄”广泛应用于保健品与药物制剂[3-4]。研究者也只能对这些疑似“桑黄”菌株进行研究和报道,由此可见“桑黄”的物种问题严重制约着其研究与开发。
1 桑黄物种正名的发展及桑黄孔菌属的分类考证
1.1 桑黄物种正名的发展
桑黄属于真菌界担子菌门Basidiomycota、蘑菇纲Agaricomycetes[5]、锈革孔菌目Hymenochaetales、锈革孔菌科Hymenochaetaceae真菌。20世纪前后,Phellinuslinteus裂蹄层孔菌(裂蹄木层孔菌)[6]、Phellinusbaumii鲍姆层孔菌(鲍氏层孔菌、鲍氏针层孔菌、鲍氏木层孔菌)[7-9]、Phellinusigniarius火木层孔菌[10]、Phellinusvaninii瓦宁木层孔菌(瓦尼木层孔菌)[11]等均被用作桑黄的学名。对此,Wagner等[12]对多种“桑黄”的nlSUrDNA序列开展聚类分析,将P.linteus、P.baumii、P.vaninii归类于Inonotussensustricto狭义纤孔菌属分支内,并分别命名为Inonotuslinteus(Berk. et Curt.)T. Wagner et M. Fischer comb. nov.裂蹄纤孔菌、Inonotusbaumii(Pila′t)T. Wagner et M. Fischer comb. nov.鲍姆纤孔菌和Inonotusvaninii(Ljub.) T. Wagner et M. Fischercomb. nov.瓦宁纤孔菌。依据其分类结果以及P.igniarius的地理分布、担孢子形态,可初步确定P.igniarius不是桑黄物种。韩国学者Jeong等[13]结合ITS和mt-SSU rDNA序列进行分析,表明其种属划分结果与Wagner的存在不一致,但是认同并采用Wagner分类方式的学者居多。
目前“桑黄”的研究主要集中在I.linteus、I.baumii、I.vaninii等,但这些菌株的子实体表观性状非常相似,单纯通过外观形态难以区分。宋吉玲等[14]采用酯酶同工酶图谱分析发现不同“桑黄”菌种的同工酶酶带虽具有较明显的区别,但表示物种分析仍需结合分子生物技术。谢丽源等[15]比较了形态、rDNA ITS分子标记法和成分HPLC 指纹图谱分析方法,认为ITS分析技术更为准确可靠。Lim等[16]结合ITS序列扩增和限制性内切酶酶切验证,结果表明RFLP技术也是区分I.baumii和I.linteus的有效方法。ITS序列鉴定发现我国各主要桑黄真菌保藏单位的菌种基源为I.baumii和I.linteus[17],秦巴山区野生发现的疑似“桑黄”菌株实为I.baumii和I.linteus[18-19]。戴玉成早在1998年考证I.baumii和I.linteus的地理分布位置时已经表示中国、韩国、日本等东亚国家以学名裂蹄纤孔报道的“桑黄”实为鲍姆纤孔菌,因为I.linteus只分布在热带美洲,曾念开等也论证了该说法[20-21]。其后,戴玉成等整理中国药用菌的名称,将P.linteus和P.baumii划分为同一物种[22-23]。王丹等[24]也对朝鲜和韩国学者定义为“桑黄”的I.linteus与中国I.baumii进行ITS序列比对,依据分子进化树与I.linteus的自然分布分析,再次确定朝鲜和韩国所认为的“桑黄”就是I.baumii。由于“桑黄”拉丁名混淆,导致GenBank中提交的序列信息存在不完整或名称有误,因此不能单纯通过序列比对匹配的菌株名称确定其亲缘关系。采用形态学、分子生物技术、物种的分布和寄主植物进行综合分析才得以更准确地区分“桑黄”种类。
直至2012年,吴声华等[4,25]通过形态特征和ITS序列分析才成功发现传统本草记载中真正的桑黄:InonotussanghuangSheng H. Wu, T. Hatt.& Y. C. Dai桑黄纤孔菌,桑黄的物种因此得以正名。并于2016年 归于新属:SanghuangporusSheng H. Wu, L.W.Zhou & Y.C.Dai桑黄孔菌属,更名为Sanghuangporussanghuang桑树桑黄。S.sanghuang仅长在桑属树木上,且野生资源极其稀少,所以目前科研材料和市场流通一般为桑黄孔菌属内物种的菌株。
1.2 桑黄孔菌属的分类考证
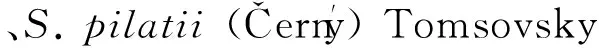
2 桑黄孔菌属的生物活性研究进展
2.1 抗氧化作用
Jin等[38]研究发现暴马桑黄的多糖为抗氧化的成分之一,其中的PPB-2组分(海藻糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖)能有效防止DNA氧化损伤,且其胞外多糖对脾细胞增殖反应具有直接的免疫激活特性,对腹腔巨噬细胞具有酸性磷酸酶活性。暴马桑黄的甲醇提取物也能显著抑制脂肪氧化酶活性[39]。Yang等发现暴马桑黄乙醇提物具有抗氧化活性、保护PC12细胞避免氧化损伤及清除自由基能力[40],但表示其抗氧化活力与黄酮含量不具有相关性[41],而且子实体的清除自由基活性优于菌丝体[42]。另外,暴马桑黄多酚类代谢物也具有较好的清除自由基的活性[43],其苯乙烯吡喃酮骨架化合物能通过铁离子螯合作用和清除自由基而发挥抗氧化作用[44]。大孔忍冬桑黄的醇提物能抗肝纤维化,其作用机制可能是由于大孔忍冬桑黄具有抗氧化活性,抑制肝星状细胞被氧化应激,降低血清转化生长因子-β和细胞因子,上调基质金属蛋白酶-1的表达,从而达到防治肝纤维化的作用[45]。杨树桑黄和小孔忍冬桑黄的多酚类成分也具有清除自由基的能力[46-47],且后者已被证明其抗氧化活性与多酚含量呈正相关关系。比较发现,桑树桑黄清除自由基的能力较杨树桑黄和暴马桑黄更优[35]。
2.2 抗肿瘤作用
暴马桑黄的乙醇提取物对人体肿瘤细胞(L1210、SW620、MCF-7)有抑制作用,三萜化合物能明显抑制乳腺癌细胞(MCF-7)的增殖和诱导其凋亡,且子实体比菌丝体的活性更强[48]。Xue等分析细胞周期,表明暴马桑黄水溶性多糖成分可引起细胞周期停滞在DNA合成期,导致细胞凋亡,由此产生体外免疫刺激和抗肿瘤活性[49];其胞外漆酶具有抑制HepG2和L1210肿瘤细胞增生和扩散的作用[50]。杨树桑黄的提取物能有效抑制结肠癌细胞增生,王超儀等比较暴马桑黄、杨树桑黄的石油醚提取物抑制肿瘤效果发现后者更佳[51-52]。大孔忍冬桑黄提取分离得到的hispolon具有双重调节雌性激素的作用,能有效阻止乳腺癌癌前病变[53-55]。吴声华等[35]研究发现桑树桑黄子实体和菌丝体醇提取均能抑制肺癌细胞、肝癌细胞的生长。
2.3 改善动脉粥样硬化
Noh等研究表明暴马桑黄提取物能显著减少动脉粥样化小鼠体内的甘油三酯含量,降低血浆肿瘤坏死因子和白介素水平,抑制血管细胞黏附分子、细胞间粘附分子的表达,还可降低巨噬细胞的浸润、脂质堆积、动脉粥样硬化病变[56]。暴马桑黄的原儿茶酸能诱导产生一氧化氮,改善动脉粥样硬化血栓形成[57]。
2.4 抗炎作用
暴马桑黄对急性肺部炎症有抑制作用[58],其乙酸乙酯萃取物能下调炎性介质使其发挥抗炎作用[59]。与杨树桑黄和暴马桑黄相比,桑树桑黄的菌丝体和子实体提取物更具有显著的抗炎活性[60]。
2.5 抗菌抗病毒作用
Hwang等研究表明暴马桑黄的5个酚类化合物均能抑制非竞争流感病毒(H1N1、H5N1、H3N2)的神经氨酸酶活性,减少病毒诱导致细胞病变效应的数量[61]。暴马桑黄乙酸乙酯提取物能显著降低青霉素(苯唑西林、头孢唑啉、头孢吡肟、盘尼西林)的最低抑菌浓度,通过抑制盘尼西林结合蛋白2a的产生,从而具有杀菌作用[62]。
2.6 其他作用
口服暴马桑黄提取物能显著减低体增重、肝脏脂质含量、附睾的脂肪细胞的脂肪堆积,抑制甘油三酸酯合成途径中基因的mRNA表达以及脂肪酸合成酶的活性[63]。暴马桑黄还具有降血糖作用[64],其菌丝体内的原儿茶醛、柚皮素和黄芩素分别能提升胰岛素抵抗HepG2模型细胞内己糖激酶、丙酮酸激酶酶活性,而原儿茶醛显著抑制α-葡萄糖苷酶酶活,从而达到降糖效果[65]。桑树桑黄的菌丝体和子实体已有毒理性研究证明其不具有急毒性和遗传毒性[36,66]。
3 桑黄孔菌属的栽培研究进展
3.1 暴马桑黄
通过比较不同培养基条件下暴马桑黄菌丝生长效果发现,木屑固体培养的菌丝体醇提物清除H2O2自由基效果最好;米饭培养的菌丝体醇提物在低浓度下对超氧阴离子和DPPH自由基清除作用较液体和木屑固体培养强;木屑以及米饭培养方法得到的菌丝体能有效修复PC12神经细胞损伤,液体发酵培养的菌丝体醇提物浓度在适当浓度下对肿瘤细胞HepG2 的抑制率达70%[67]。刘红锦等[68]根据单因素试验确定暴马桑黄固体培养基基本成分,得出最佳配比及条件为葡萄糖20g,蛋白胨2.2g,磷酸二氢钾0.46g,磷酸氢二钾1.0g,硫酸镁0.5g,琼脂20.0g,水1 000mL,pH7,28 ℃培养。赵子高等[69]以暴马桑黄菌丝体生物量和多糖产量为主要指标,通过单因素试验和四因素三水平正交试验筛选出最适液体培养基:葡萄糖、玉米粉、豆饼粉、KH2PO4、MgSO4,以及最佳培养条件:28 ℃、140r/min,pH自然,装液量100mL(250mL三角瓶) 的接种量10%,发酵周期132h。Luo等[70]正交试验结果表明有利于暴马桑黄的乳酸菌胞外多糖生产的最佳液体培养基成分为葡萄糖、蛋白胨、酵母提取物、草酸铵、KH2PO4、MgSO4、VB1。Li等比较了子实体、液体培养和固体培养的菌丝体内多糖含量,发现液体培养的菌丝体内多糖含量和提取率也是三者中最高的[71],液体摇瓶培养中pH影响菌丝的生长和形态及其胞外多糖的生产[72]。雷萍等[73]研究发现20L搅拌式发酵罐中,转速为150r/min以及通气量为1∶ 0.65vvm时获得的暴马桑黄菌丝体生物量和胞外多糖得率最高。杜萍等[74]采用代料栽培,找出暴马桑黄子实体生长发育的最适湿度、温度、光照等环境因子,并针对其生长发育过程出现的情况推出管理措施,优化暴马桑黄子实体人工栽培方法 。
3.2 桑树桑黄
曲明等[75]对桑树桑黄固体培养进行优化,其最佳培养条件为pH6、30 ℃,最适碳源为玉米粉、葡萄糖、蔗糖、麦芽糖和甘露醇,最适氮源为牛肉膏、蛋白胨。Tian等优化桑树桑黄菌丝体液体培养基,在该配方下(玉米粉38.96g/L,酵母提取物4.15g/L,麸皮20.55g/L和pH6.39)通过摇瓶和静止两个阶段培养可提高总黄酮和总酚类的产量[43]。桑黄液体发酵最佳培养基及培养条件为玉米粉2%,葡萄糖3%,酵母膏0.5%,蛋白胨0.5%,KH2PO40.3%,MgSO4·7H2O0.15%,VB1 20μg/100mL,pH5.5,接种量8%,28 ℃、180r/min震荡培养82h[76]。姜福春等通过添加乙酸镁,提高了桑树桑黄发酵液中黄酮类化合物的含量[77];通过添加桑树水提液考察对菌丝体生长的影响,结果表明添加桑树粉和桑树枝的固体培养基、种子液体培养基均能促进桑树桑黄的菌丝体生长,而在发酵液中只有桑树粉具有促进作用[78]。桑树桑黄母种培养基最佳配方为木屑100g,马铃薯100g,葡萄糖20g,琼脂粉10g,水1 000mL,pH自然[79]。虽然桑树桑黄已发展了树干或代料栽培子实体,但仍存在生长缓慢及表观性状差别问题,可能与野生桑树桑黄极依赖其寄主植物桑树的生长情况有关。
3.3 小孔忍冬桑黄
余海尤等对小孔忍冬桑黄进行一系列研究发现,菌丝体生物量在培养168~216h时可达到最大值,胞内多酚和胞外多酚含量分别在168h和216h时达到最大值;也发现液体培养过程中,光照轻微抑制了菌丝体的生长,但能促进多酚的合成积累和提高对DPPH自由基的抑制作用;在偏酸性条件下,小孔忍冬桑黄生长良好且能产生较多的胞内外多酚,清除自由基活性更高。初始pH为5.3最适合小孔忍冬桑黄的液体培养,得到的菌丝体生物量和胞内外多酚含量高,胞内外提取物的活性也较高[80]。
3.4 杨树桑黄
胡伟等[81]研究认为杨树桑黄菌株的最佳培养碳源为葡萄糖和甘露糖,氮源为麦麸和玉米,pH6.5,28 ℃。李延生等[82]却表明最佳碳源为果糖,最佳氮源为黄豆粉。张跃新等研究通过三元二次通用旋转组合实验优化了纯培养模式条件,得到最佳培养基配方(g/100mL):马铃薯2,琼脂粉2,葡萄糖3,麦麸1.5,硫酸镁0.2,磷酸二氢钾0.3,研究杨树桑黄代用料栽培方法得到最佳模式为菱形口、“墙式两端出菇法”,并确定了培养料最佳配方及出菇期的最佳出菇温度[83-84]。杨树桑黄在5L发酵罐发酵8d后,其乙酸乙酯提取物对结肠癌LOVO细胞增生的抑制率得到提高[85]。胡伟等[86]选用杨木木屑作为代料栽培的原料对杨树桑黄进行栽培,范宇光等[87]采用椴木栽培得到杨树桑黄。
4 展 望
桑黄孔菌属作为极具价值和潜力的药用资源,是东亚地区医药制剂与保健品行业研究开发的热点食药用菌。该属内物种仍在更新,大部分物种均具有很大的研究与发展空间。目前,国内外在其生物活性方面研究已略有成就,抗肿瘤、抗氧化、抗炎和抗菌抗病毒等重要的药理作用逐渐被发掘。但其栽培研究尚处于起步阶段,桑树桑黄等物种的野生资源处于濒危状态,而且桑树桑黄、大孔忍冬桑黄、锦带花桑黄、高山纤孔菌、环区纤孔菌等中国境内生长的桑黄孔菌属内物种栽培研究鲜有报道。韩国、日本等东亚国家虽然对桑黄开发较早,采用室外荫棚木段埋畦等方式栽培获得经济效益[88],但这些国家误将裂蹄纤孔菌、火木层孔菌等当做“桑黄”品种开展研究和生产。我国真菌专家已初步确立国内的桑黄孔菌属并取得共识,在桑黄孔菌属初步确立的情况下开展其栽培研究、选育优良品种、加强人工栽培技术研究有助于我国开拓桑黄孔菌属的市场以及保证其研究和开发应用的可持续发展。
[1] 包海鹰, 王超儀, 图力古尔. “桑黄”的本草考证 [J]. 菌物学报,2013,32(增刊):7078.
[2] 吴声华. 珍贵药用菌“桑黄” 物种正名[J]. 食药用菌,2012,20(3):177-179.
[3] 张维博, 王家国, 李正阔, 等. 药用真菌桑黄的研究进展 [J]. 中国中药杂志,2014,39(15):2838-2845.
[4] 潘学仁, 邹利, 户岩岩, 等. 东亚地区“桑黄”物种问题讨论 [J]. 中国食用菌,2008, 27(1):63-64.
[5] 李玉, 李泰辉, 杨祝良, 等. 中国大型真菌资源[M]. 郑州:中原农民出版社,2015:72.
[6] 张问, 焦燕, 李航, 等. 裂蹄木层孔菌抗肿瘤作用及其机制研究 [J]. 中草药,2011,42(10):2047-2050.
[7] 戴玉成. 药用担子菌—鲍氏层孔菌(桑黄)的新认识 [J]. 中草药,2003,34(1):94-95.
[8] 刘春辉, 陈体强, 林跃鑫. 药用真菌桑黄的研究进展 [J]. 菌物研究,2004,2(2):53-59.
[9] 黄丽洋, 石卉, 王晓婷. 野生桑黄菌株的分离、鉴定和次生代谢物分析 [J]. 中草药,2013,44(23):3394-3399.
[10]杨全, 胡旭光, 王琦, 等. 药用真菌桑黄菌丝体多糖抗肿瘤作用的研究[J]. 中国中药杂志,2006,31(20):1713-1715.
[11]戴玉成. 一种新的药用真菌—瓦尼木层孔菌(杨黄)[J].中国食用菌,2003,22(5):7-8.
[12]WagnerT,FischerM.ProceedingstowardsanaturalclassificationoftheworldwidetaxaPhellinuss.l.andInonotuss.l., and phylogenetic relationships of allied genera[J]. Mycologia,2002,94(6):998-1016.
[13]Jeong WJ, Lim YW, Lee JS, et al. Phylogeny of Phellinus and Related Genera Inferred from Combined Data of ITS and Mitochondrial SSU rDNA Sequences [J]. Journal of Microbiology and Biotechnology,2005,15(5):1028-1038.
[14]宋吉玲, 周祖法, 陆娜. 杭州野生桑黄与引进桑黄亲缘关系和生物学特性研究 [J]. 食用菌,2015,(6):16-18.
[15]谢丽源, 张勇, 彭卫红, 等. 不同方法鉴定桑黄真菌的比较 [J]. 食品与生物技术学报,2011,30(5):794-800.
[16]Lim YW, Lee JS, Jung HS. Type studies onPhellinusbaumiiandPhellinuslinteus[J]. Mycotaxon,2003,85:201-210.
[17]谢丽源, 张勇, 彭金华, 等. 桑黄真菌分子鉴定及遗传多样性分析 [J].菌物学报,2010,29(3):347-356.
[18]张文隽, 吴亚召, 雷萍, 等. 秦巴山区野生桑黄rDNA ITS序列及亲缘关系 [J]. 中国食用菌,2015,34(1):50-52.
[19]高凯, 杜明, 吕英华, 等. 10株桑黄菌基于rDNA ITS序列的分子鉴定 [J]. 蚕业科学,2010,36(4):0584-0589.
[20]Dai YC, Xu MQ. Studies on the medicinal polypore,Phellinusbaumii, and its kin,P.linteus[J].Mycotaxon, 1998,67(1):191-200.
[21]曾念开, 王秋颖, 苏明声. 桑黄基原物种的探讨 [J]. 中国食用菌,2008,27(2):56-59.
[22]Dai YC,Yang ZL,Cui BK, et al.Species Diversity and Utilization of Medicinal Mushrooms and Fungi in China(Review)[J]. International Journal of Medicinal Mushrooms,2009,11(3):287-302.
[23]Dai YC, Zhou LW, Cui BK. Current advances inPhellinussensulato:medicinal species,functions, metabolites and mechanisms [J].AppliedMicrobiologyBiotechnology,2010,87:1587-1593.
[24]王丹, 邹莉, 杨民宝.药用真菌桑黄的系统发育分析 [J]. 中国食用菌,2010,29(5):40-42.
[25]Wu SH, Dai YC, Tsutomu H, et al. Species clarification for the medicinally valuable‘sanghuang’ mushroom[J]. Botanical Studies,2012,53(1):135-149.
[26]Parmaso E, Parmasto I.Phellinusbaumiiand related species of the Ph. lintelts group (Hymenochaetaceae, Hymenomycetes)[J]. Folia CryptogamicaEstonica,2001,38:53-61.
[27]Dai YC. Hymenochaetaceae(Basidiomycota)in China [J]. Fungal Diversity,2010,45(1):131-343.
[28]Zhou LW, Qin WM.Inonotustenuicontextussp. nov.(Hymenochaetaceae)from Guizhou, southwest China with a preliminary discussion on the phylogeny of its kin [J]. Mycological Progress,2012,11(3):791-798.
[29]Tian XM, Yu HY, Zhou LW. Phylogeny and taxonomy of theInonotuslinteuscomplex [J]. Fungal Diversity,2013,58(1):159-169.
[30]Lee JS, Jung HS. Taxonomic study on Korean Aphyllophorales(5)-on some unrecorded genera and species-[J]. Mycobiology,2006,34(4):166-175.
[31]戴玉成, 崔宝凯. 药用真菌桑黄种类研究[J]. 北京林业大学学报,2014,36(5):1-6.
[32]Ghobad-Nejhad M. Collections on Lonicera in Northwest Iran represent an undescribed species in theInonotuslinteuscomplex (Hymenochaetales)[J]. Mycological Progress,2015,14:90.
[33]Zhou LW,Vlasák J, Decock C, et al. Global diversity and taxonomy of theInonotuslinteuscomplex(Hymenochaetales, Basidiomycota):Sanghuangporusgen.nov.,TropicoporusexcentrodendriandT.guanacastensisgen. et spp.nov., and 17 new combinations [J]. Fungal Diversity,2016,77:335-347.
[34]Han J G, Hyun M W, Kim C S, et al. Species identity ofPhellinuslinteus(sanghuang) extensively used as a medicinal mushroom in Korea [J]. Journal of Microbiology,2016,54(4):290-295.
[35]吴声华,黄冠中,陈愉萍,等.桑黄的分类及开发前景[J].菌物研究,2016,14(4):187-200.
[36]胡伟, 张跃新, 邓勋, 等. 基于rDNA ITS 序列和RAPD 分子标记的桑黄菌遗传多样性分析 [J]. 安徽农业科学,2013,41(29):11597-11600.
[37]Tomsovsky M.Sanghuangporuspilatii, a new combination, revealed as European relative of Asian medicinal fungi[J].Phytotaxa,2015,239(1):82-88.
[38]Jin QL, Zhang ZF, Lv GY, et al. Antioxidant and DNA damage protecting potentials of polysaccharideextracted fromPhellinusbaumiiusing a delignification method[J]. Carbohydrate Polymers,2016,152:575-582.
[39]Lee SW, Song JG, Hwang BS, et al. Lipoxygenase Inhibitory Activity of Korean Indigenous Mushroom Extracts and Isolation of an Active Compound fromPhellinusbaumii[J]. Mycobiology,2014,42(2):185-188.
[40]Yang Y, Hu J, Liu Y. Antioxidant and cytotoxic activities of ethanolic extracts and isolated fractions of species of the genusPhellinusQuél.(Aphyllophoromycetideae)[J].International Journal of Medicinal Mushroom,2011,13(2):145-52.
[41]胡金霞, 杨焱, 张劲松, 等. 桑黄醇提物抗氧化和保护神经细胞损伤的研究 [J].上海农业学报,2009,25(2):58-61.
[42]吴娜,王钦博,冯娜,等.鲍姆木层孔菌子实体与菌丝体醇提物抗氧化活性的比较 [J].食用菌学报,2013,20(1):70-74.
[43]Tian XM, Dai YC , Song AR, et al. Optimization of Liquid Fermentation Medium for Production ofInonotussanghuang(Higher Basidiomycetes)Mycelia and Evaluation of their Mycochemical Contents and Antioxidant Activities [J]. International Journal of Medicinal Mushrooms,2015,17(7):681-691.
[44]Lee IK, Han MS, Lee MS, et al. Styrylpyrones from the medicinal fungusPhellinusbaumiiand their antioxidant properties [J].Bioorganic & Medicinal Chemistry Letters,2010,20:5459-5461.
[45]汪鋆植, 武玲, 罗友成, 等. 忍冬木层孔菌醇提物对肝纤维化大鼠肝星状细胞的影响[J].中药材,2015,38(8):1680-1684.
[46]程鑫颖, 包海鹰, 丁燕, 等. 瓦宁木层孔菌中多酚和黄酮类成分分离及清除自由基活性的研究 [J]. 菌物学报,2011,30(2):281-287.
[47]余海尤,曹春蕾, 崔宝凯. 忍冬木层孔菌液体培养过程中多酚含量及抗氧化活性研究 [J]. 菌物学报,2012,31(6):933-939.
[48]张林芳, 孙婷婷, 邹莉. 鲍姆纤孔菌总三萜的提取及其体外抗乳腺癌细胞MCF-7活性 [J]. 药物评价研究,2015,38(5):497-502.
[49]Xue Q, Sun J, Zhao MW, et al. Immunostimulatory and anti-tumor activity of a water-soluble polysaccharide fromPhellinusbaumiimycelia [J]. World Journal of Microbiology & Biotechnology,2011,27:1017-1023.
[50]Sun J, Chen QJ, Zhu MJ, et al. An extracellular laccase with antiproliferative activity from the sanghuang mushroomInonotusbaumii[J]. Journal of Molecular Catalysis B:Enzymatic,2014,99(1):20-25.
[51]王超儀, 包海鹰. 6 种“桑黄”石油醚提取物的体内抗肿瘤活性 [J]. 菌物研究,2013,11(3):196-201.
[52]张跃新, 胡伟, 邓勋, 等. 瓦尼木层孔菌发酵液提取物对人结肠癌LoVo细胞增殖的影响 [J]. 中国食用菌,2015,34(4):62-66.
[53]罗友成, 汪鋆植, 曹丹, 等. 忍冬木层孔菌对乳腺癌癌前病变大鼠的保护作用 [J] . 中药药理与临床,2013,29(1):93-97.
[54]Wang JZ, You FH, Luo C, et al. Estrogenic and anti-estrogenic activities of hispolon fromPhellinuslonicerinus(Bond.)Bond. et sing [J]. Fitoterapia,2014,95(10):93-101.
[55]胡芳, 汪鋆植, 武玲, 等. 忍冬木层孔菌醇提物雌激素样作用研究 [J]. 中药材,2016,39(3):634-640.
[56]Noh JR, Lee IK, Kim YH, et al. Antiatherogenic effect of antioxidant polyphenols fromPhellinusbaumiiin apolipoprotein E-deficient mice [J] . Annals of Nutrition & Metabolism,2011,59(2-4):145-153.
[57]Lim Y, Lee S, Kim JY, et al. APhellinusbaumii-based supplement containingSalviamiltiorrhizaBungeimproves atherothrombotic profiles through endothelial nitric oxide synthase and cyclooxygenase pathwaysinvitroandinvivo[J]. Journal of Functional Foods,2016,24:231-243.
[58]Jang BS, Kim JC, Bae JS, et al. Extracts ofPhellinusgilvusandPhellinusbaumiiinhibit pulmonary inflammation induced by lipopolysaccharide in rats [J]. Biotechnology Letters,2004,26(1):31-33.
[59]Yayeh T, Oh WJ, Park SC, et al.Phellinusbaumiiethyl acetate extract inhibits lipopolysaccharide-induced iNOS, COX-2, and proinflammatory cytokine expression in RAW264.7 cells [J]. Journal of Natural Medicines,2012,66:49-54.
[60]Lin W C, Deng J S, Huang S S, et al. Anti-Inflammatory Activity ofSanghuangporussanghuangMycelium [J].International Journal of Molecular Sciences,2017, 18(2): 347.
[61]Hwang BS, Lee IK, Choi HJ, et al. Anti-influenza activities of polyphenols from the medicinal mushroomPhellinusbaumii[J]. Bioorganic & Medicinal Chemistry Letters,2015,25:3256-3260.
[62]Hong SB, Rhee MH, Yun BS, et al. Synergistic Anti-bacterial Effects ofPhellinusbaumiiEthyl Acetate Extracts and β-Lactam Antimicrobial Agents Against Methicillin-Resistant Staphylococcus aureus[J]. Annals of Laboratory Medicine,2016,36:111-116.
[63]Noh JR, Lee IK, Ly SY, et al. APhellinusbaumiiextract reduces obesity in high-fat diet-fed mice and absorption of triglyceride in lipid-loaded mice[J]. Journal of Medicinal Food,2011,14(3):209-218.
[64]Hwang HJ, Kim SW, Lim JM, et al. Hypoglycemic effect of crude exopolysaccharides produced by a medicinal mushroomPhellinusbaumiiin streptozotocin-induced diabetic rats [J]. Life Sciences,2005,76:3069-3080.
[65]张超,汪雯翰,杨焱,等.鲍姆木层孔菌菌丝体活性化合物对胰岛素抵抗HepG2细胞内糖代谢关键酶活性的影响 [J].食用菌学报,2015,22(2):35-39.
[66]张赫男,杨焱,张劲松,等. 桑黄子实体粉的毒理研究[J] .菌物学报,2016,(3):28.
[67]Shao Q, Yang Y, Li TT, et al. Biological activities ofInonotusbaumiimycelium extract obtained by different cultivation methods [J]. Mycosystema,2014,33(1):1103-1111.
[68]刘红锦, 张苏珍, 蒋宁, 等. 桑黄菌丝固体培养基及培养条件研究 [J]. 江西农业学报,2012,24(11):123-124.
[69]赵子高, 杨焱, 刘艳芳, 等. 药用真菌桑黄液体深层发酵条件的优化 [J]. 微生物学通报,2007,34(3):459-463.
[70]Luo JG, Liu J, Ke CL, et al. Optimization of medium composition for the production of exopolysaccharides fromPhellinusbaumiiPilát in submerged culture and the immuno-stimulatingm activity of exopolysaccharides [J]. Carbohydrate Polymers,2009,78:409-415.
[71]Li TT, Yang Y, Liu YF, et al. Physicochemical characteristics and biological activities ofpolysaccharide fractions fromPhellinusbaumiicultured with different methods [J].International Journal of Biological Macromolecules,2015,81:1082-1088.
[72]Hwang HJ, Kim SW,Xu CP, et al. Morphological and rheological properties of the three different species of basidiomycetes Phellinus in submerged cultures[J]. Journal of Applied Microbiology,2004,96:1296-1305.
[73]雷萍,吴亚召,张文隽,等.不同搅拌转速和通气量对桑黄深层发酵培养的影响 [J].食用菌学报,2014,21(2):57-62.
[74]杜萍, 张春凤, 崔宝凯, 等. 药用真菌桑黄的人工栽培技术研究 [J]. 中国食用菌,2009,28(3):35-37.
[75]曲明, 王波, 李玉. 桑黄菌种生长条件的研究 [J]. 西南农业学报,2013,26(5):2173-2175.
[76]李剑梅,王艳华, 郭玲玲,等.桑黄液体发酵工艺的研究[J]. 微生物学杂志,2014,34(6):74-78.
[77]姜福春, 张赫男, 冯杰, 等.乙酸镁对桑黄液态发酵合成黄酮类物质的促进研究[J]. 菌物学报,2017,36(4):1-11.
[78]姜福春, 冯杰, 张赫男, 等.桑树水提物对桑黄液态深层发酵的影响[J]. 上海农业学报,2017,33(1):56-62.
[79]龚光禄,桂阳,雷震, 等.药用真菌桑黄(I.sanghuang)母种培养基的筛选[J]. 北方园艺,2016,16(24):139-141.
[80]余海尤,陈佳佳, 田雪梅. 光照和pH 对忍冬纤孔菌液体培养的影响 [J]. 菌物学报,2014,33(2):469-476.
[81]胡伟, 张跃新, 邓勋, 等. 瓦尼木层孔菌WN-3分类地位的分子生物学验证及生理学特性研究 [J]. 安徽农业科学,2013,41(32):12551-12553.
[82]李延生, 赵婷, 陈艳秋, 等. 瓦尼木层孔菌菌丝培养特性初探 [J]. 食用菌,2008,(4):7-8.
[83]张跃新, 胡伟, 闫宝松, 等. 杨黄菌丝体纯培养条件优化模式的研究 [J]. 中国林副特产,2011,(6):4-6.
[84]张跃新, 胡伟, 闫宝松, 等. 瓦尼木层孔菌不同模式代料栽培对比试验 [J]. 中国林副特产,2015,(3):13-15.
[85]Hu W, Liu S, Zhang YX, et al. Mycelial fermentation characteristics and antiproliferative activity ofPhellinusvaniniiLjup [J].Pharmacognosy Magazine,2014,10(40):430-434.
[86]胡伟, 王春生, 张晶. 杨黄代用料栽培初探 [J]. 中国林副特产,2007(1):12-13.
[87]范宇光, 秦立武, 吴秀玲, 等. 瓦尼木层孔菌及其人工栽培技术[J].中国食用菌, 2009,28(2):24-25.
[88]许彪, 吴佳琳, 孙婷婷, 等. 桑黄人工栽培研究[J]. 中国林副特产,2015,(2):91-93.

