海洋来源塔宾曲霉LWG-42菌株的鉴定及其抗氧化活性化合物的分离
郭 雷, 王 聪, 郭家才, 郑洪伟
(1.淮海工学院 海洋生命与水产学院 江苏省海洋生物技术重点实验室,江苏 连云港 222005;2.江苏省海洋资源开发研究院,江苏 连云港 222004;3.中国海洋大学 医药学院 教育部海洋药物重点实验室,山东 青岛 266003)
自由基是具有不成对电子的原子或基团,通常是在细胞正常新陈代谢过程中产生的中间产物。其反应能力很强,能够使细胞中的多种物质发生氧化,损害细胞膜,还能引起蛋白的损伤和DNA的变异。自由基在人体内的积累最终可引起许多慢性疾病的发生,如心血管疾病、动脉粥样硬化、关节炎、糖尿病、癌症和阿尔茨海默病[1-3]。为了降低自由基对人体的损伤及改善食品的贮存稳定性,合成的抗氧化剂如叔丁基羟基茴香醚 (BHA)、二叔丁基对甲酚 (BHT) 和没食子酸丙酯 (PG) 已被广泛应用于产品加工中。但研究表明合成抗氧化剂可能引起营养价值的损失,甚至产生毒性效应[4-5]。因此,开发天然的抗氧化剂引起了人们越来越多的兴趣[6-8]。海洋真菌与陆生真菌的生存环境不同,使其形成了独特的代谢和防御系统,能够产生结构独特和活性特异的代谢产物[9-10]。自20世纪90年代开始一直到现在,已从海藻、海绵、红树林生态系统、海洋沉积物、海洋软体动物、海鞘、珊瑚、鱼类及其他海洋动植物等来源海洋真菌的发酵产物中发现了1 000多个新的次生代谢产物,化合物类型包括生物碱、多肽、聚酮、萜类、甾类等多种结构类型。这些代谢产物表现出良好的抗肿瘤、抗菌、抗病毒等生物活性[11-12]。据估计,海洋真菌有6 000种以上,但到2009年止,已鉴定的海洋真菌仅有321属530种,其中424种属于子囊菌门、94个种属于变形菌门、12个种属于担子菌门,仅占陆地真菌总数(约5万种)的1%左右[13-14]。因此,海洋真菌仍处于探索和研究的阶段。从海水养殖贝类文蛤共生微生物中分离出来的真菌LWG-42菌株,其发酵液具有显著的DPPH自由基清除活性。本研究对LWG-42菌株进行了鉴定,对其产生的抗氧化活性化合物进行活性追踪分离并鉴定化合物的结构,为进一步的研究提供参考。
1 材料与方法
1.1 材料
1.1.1 供试菌株 菌株LWG-42为海水养殖贝类文蛤共生微生物中分离到的1株真菌,保存于淮海工学院海洋微生物天然产物化学研究室。
1.1.2 培养基(质量分数,%) 菌株保存及鉴定培养基均为沙氏固体培养基SDA:葡萄糖 4, 蛋白胨 1,琼脂 1.5;种子培养基为沙氏液体培养基;发酵培养基:葡萄糖 2,麦芽糖 2,谷氨酸钠 2, 酵母膏 0.3,KH2PO40.05,MgSO4·7H2O 0.03,玉米粉 0.03。培养基均用陈海水配制。
1.1.3 分离试剂 柱层析用硅胶 (200~300目,青岛海洋化工厂);GF254硅胶薄层板(10~40 μm,青岛海洋化工厂);Sephadex LH-20 (Amersham Biosciences,瑞典)。
1.1.4 仪器 扫描电子显微镜HITACHI JSM-6390LA用于菌株分生孢子的观察;分析型高效液相色谱柱CAPCELL PAK C18 column ((4.6×250) mm,5 μm);制备型高效液相色谱柱YMC-pack ODS-A column ((10×250)mm,5 μm);紫外光谱 (UV) 测定采用Waters 2487紫外检测器,甲醇为溶剂;核磁共振 (NMR) 测定JEOL JNM-ECP 600型核磁共振波谱仪,DMSO-d6为溶剂,以四甲基硅烷(TMS)为内标;质谱(ESI-MS)测定采用Q-TOF GAA076 LC型质谱仪。
1.2 方法
1.2.1 形态特征 将菌株LWG-42接种于SDA平板上,28 ℃培养7 d,观察并描述菌落形状、质地和颜色等形态特征;石碳酸棉兰染色法观察分生孢子囊特征;扫描电子显微镜观察分生孢子特征[15]。
1.2.2 ITS序列分析 将菌株LWG-42接种于SDA平板上,28 ℃培养7 d,送至北京三博远志生物科技有限公司进行ITS 序列分析,PCR程序参照文献[16]。ITS序列提交至GenBank (序列号KF494190),采用BLAST软件进行相似序列搜索,继而利用Clustal X (Ver. 1.83) 软件对高同源序列进行多序列联配分析,最后利用MEGA (Ver. 4.0) 软件中的N-J法 (Neighbor-Joining) 构建系统发育树,设置自展次数为1 000次。
1.2.3 菌株LWG-42的发酵及活性浸膏的制备 将菌株LWG-42 的斜面孢子接种到装有200 mL种子培养基的500 mL三角瓶内,28 ℃、160 r/min振荡培养24 h。随后将收获的种子培养液按1%的接种量接种于装有200 mL发酵培养基的500 mL三角瓶内,共接种50 瓶,28 ℃静置培养30 d。用8层纱布过滤发酵产物,将获得的发酵滤液用等量乙酸乙酯萃取3次,合并滤液,将滤液浓缩蒸发至干燥,获得活性浸膏7.8 g。
1.2.4 活性化合物的分离纯化及鉴定 将乙酸乙酯浸膏进行硅胶减压柱层析,依次用石油醚-二氯甲烷 (1∶0 ~0∶1,体积比) 和二氯甲烷-甲醇 (1∶1 ~0∶1,体积比) 梯度洗脱,每个梯度洗脱1 L。将各梯度下的洗脱液分别浓缩蒸发,共获得7个组分,测定7个组分的抗氧化活性,其中二氯甲烷-甲醇 (25∶1,体积比) 洗脱的组分4 具有抗氧化活性。将活性组分4 (0.30 g) 进行Sephadex LH-20 柱层析,甲醇洗脱,收集洗脱液,10 mL为一个馏分。将收集的洗脱液依据其TLC图谱,合并为4个亚组分(4-1、 4-2、 4-3和4-4)。分别对上述4个亚组分进行HPLC分析,显示亚组分4-2 可以在甲醇-水 (70∶30,体积比) 浓度梯度下制备。用半制备HPLC对亚组分4-2 (0.11 g) 进行分离,得到化合物1 (4.5 mg, tR14.0 min) 和 2 (7.0 mg, tR8.0 min),基于化合物的波谱特征 (UV,1H-NMR,13C-NMR, DEPT和ESI-MS) 鉴定其结构。
1.2.5 抗氧化活性测定 抗氧化活性测定采用DPPH自由基清除试验[6]。化合物分别用甲醇溶解后,按二倍稀释法配成不同浓度的溶液,分别取100 μL 加至96 孔板孔内,每个浓度设3 个平行。然后将100 μL 0.2 mmol/L的DPPH 乙醇溶液加入孔内,混合均匀,室温下放置20 min,用酶标仪测定517 nm处的吸光度。3 个平行的吸光度平均值记为Ai,同时以甲醇代替样品测定Ac,以乙醇代替DPPH溶液测定Aj,按下列公式计算清除率。
2 结果与分析
2.1 菌株LWG-42的鉴定
2.1.1 形态特征 菌株LWG-42在沙氏琼脂上生
长迅速,28 ℃培养7 d,直径可达65~70 mm,平坦,质地丝绒状;菌丝初生时为白色,渐变为棕、黑色,无渗出液,菌落背面黄褐色;在光学显微镜和扫描电镜下,分生孢子头呈球形,褐黑色;顶囊膨大,顶囊上放射状密生着两轮小柄;分生孢子呈球形,直径约3~4 μm,表面不光滑,有小刺,常串生(图1)。参考文献[17],初步鉴定菌株LWG-42为曲霉属黑色组曲霉。

图1 菌株LWG-42的形态特征Fig.1 Morphological characteristics of strain LWG-42a:菌落;b:分生孢子梗;c:分生孢子(Bar=5 μm)a:Colony;b:Conidiphore;c:Conidium (Bar=5 μm)
2.1.2 ITS序列分析 经过PCR扩增后,获得的菌株LWG-42的ITS序列全长为573 bp, 将其序列提交至GenBank (序列号为KF494190)。BLASTn分析结果显示该序列与曲霉属真菌 (Aspergillussp.)的ITS序列具有很高的同源性,其中与菌株AspergillustubingensisCs/9/7 (JN585944.1)、AspergillustubingensisA1KA (AM745112) 的ITS序列同源性为99%,在以N-J法构建的系统发育树上聚为同一簇群(图2)。因此,结合形态学特征,该菌株被鉴定为塔宾曲霉Aspergillustubingensis,菌株命名为Aspergillustubingensisstrain LWG-42。

图2 基于ITS序列的菌株LWG-42系统发育分析Fig.2 Polymeric analysis of strain LWG-42 based on the ITS sequences
2.2 活性化合物的分离及结构鉴定
从菌株LWG-42发酵液的乙酸乙酯浸膏中,采用活性追踪的分离方法,共分离得到2个次生代谢产物。
化合物1: 黄色粉末 (甲醇);HPLC-UV检测发现紫外吸收在226、281、325、405 nm处分别有中、强,弱、弱的吸收,提示为一萘并吡喃酮类化合物;阳离子ESI-MS在m/z571处给出准分子离子峰[M+H]+,提示分子量为570,结合其1H-NMR和13C-NMR数据 (表1),确定该化合物的分子式为C32H26O10;该化合物的1H-NMR和13C-NMR数据与文献报道的aurasperone A一致[18],故将化合物1鉴定为aurasperone A (图3)。
化合物2: 黄色粉末 (甲醇); HPLC-UV检测发现紫外吸收在234、282、334、408 nm处分别有中、强、弱、弱的吸收,提示也为一萘并吡喃酮类
化合物;阳离子ESI-MS分别在m/z607、608处给出准分子离子峰[M+H]+和[M+2H]+,提示分子量为606,结合其1H-NMR和13C-NMR数据 (表1),确定该化合物的分子式为C32H30O12;该化合物的1H-NMR和13C-NMR数据与文献报道的aurasperone B一致[19-20],故将化合物2鉴定为aurasperone B (图3)。
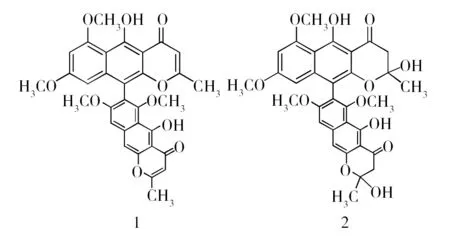
图3 化合物1、2的化学结构式Fig.3 Chemical structures of Compound 1,2
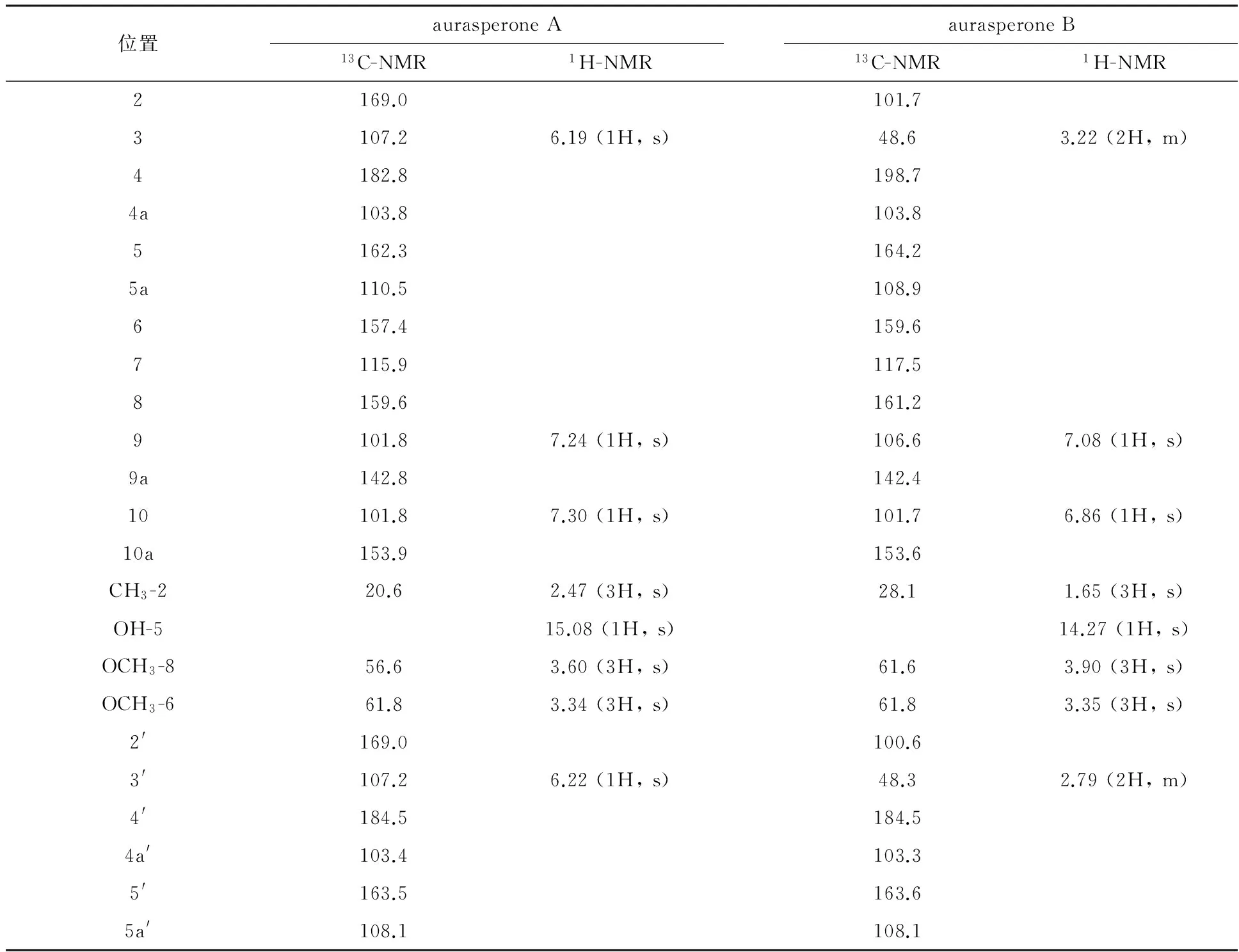
位置aurasperoneAaurasperoneB13C-NMR1H-NMR13C-NMR1H-NMR2169.0101.73107.26.19(1H,s)48.63.22(2H,m)4182.8198.74a103.8103.85162.3164.25a110.5108.96157.4159.67115.9117.58159.6161.29101.87.24(1H,s)106.67.08(1H,s)9a142.8142.410101.87.30(1H,s)101.76.86(1H,s)10a153.9153.6CH3-220.62.47(3H,s)28.11.65(3H,s)OH-515.08(1H,s)14.27(1H,s)OCH3-856.63.60(3H,s)61.63.90(3H,s)OCH3-661.83.34(3H,s)61.83.35(3H,s)2'169.0100.63'107.26.22(1H,s)48.32.79(2H,m)4'184.5184.54a'103.4103.35'163.5163.65a'108.1108.1

续表1
2.3 化合物对DPPH自由基的清除活性
DPPH自由基清除试验被广泛应用于评价化合物的自由基清除活性的测定中[6]。Aurasperone A、aurasperone B和阳性对照抗坏血酸对DPPH自由基的清除能力如图4所示。从图4中可以看出,随着化合物浓度的增加,其对DPPH自由基的清除活性也逐渐提高。当试验化合物的浓度从0.062 5 mg/mL增加到1.0 mg/mL, 抗坏血酸,aurasperone A和aurasperone B对DPPH自由基的清除活性分别从(63.37±3.86)%、(34.93±1.17)%和(38.33±1.29)% 提高到(95.05±1.49)%、(71.02±2.35)% 和(76.74±1.82)%,EC50值分别为0.035、0.18和0.11 mg/mL。结果显示aurasperone A和aurasperone B具有一定的DPPH自由基清除活性,但低于对照抗坏血酸的活性。

图4 Aurasperone A、B对DPPH自由基的清除活性Fig.4 The scavenging activities of aurasperone A and B on DPPH free radical
3 讨 论
塔宾曲霉是属于曲霉属的一种真菌,已有报道显示塔宾曲霉能够产生吲哚二萜dihydrotubingensin A、B[21],环五肽malformin A1[22],萘并吡喃酮类化合物如asperpyrone A、D, aurasperone A-E, rubasperone A-C及rubrofusarin、 rubrofusarin B等次生代谢产物[23-24]。这些化合物具有一定的抗烟草花叶病毒、细胞毒,抑制酪氨酸酶和α-葡萄糖苷酶的活性。本研究从塔宾曲霉LWG-42菌株的发酵产物中分离得到2个具有一定程度的清除DPPH自由基活性的化合物aurasperone A 和aurasperone B。Aurasperone A可以从植物共生塔宾曲霉菌株[24]、链格孢霉D2006[25]、黑曲霉IFB-E003[19]和JV-33-48[26]以及木苹果内生曲霉[18]中分离得到,具有一定的黄嘌呤氧化酶抑制活性 (IC50: 10.9 μmol/L),中等程度的卤虫毒性和TaqDNA聚合酶抑制活性。Aurasperone B 能够从链格孢霉D2006、木苹果内生曲霉[18]和黑曲霉C-433[27]的发酵产物中分离得到,显示出弱的卤虫毒性。据文献所知,本文是第一次报道aurasperone A和aurasperone B具有DPPH自由基清除活性。
本研究通过形态学特征和ITS序列分析,将1株具有DPPH自由基清除活性的海洋来源真菌LWG-42菌株鉴定为塔宾曲霉 (A.tubingensis);利用抗氧化活性追踪分离的方法,通过溶剂萃取和柱层析技术,从LWG-42菌株的发酵产物中分离得到2个化合物;基于化合物的波谱特征,将其鉴定为aurasperone A 和 aurasperone B,aurasperone A、B具有一定的清除DPPH自由基的活性,为进一步开发这两个化合物在药品、化妆品和食品工业中的应用提供参考。
[1] Halliwell B, Gutteridge JM, Cross CE. Free radicals, antioxidant and human disease: where are we now?[J]. Journal of Lab and Clinical Medicine, 1992, 119(6):598-620.
[2] Guo L, Zhu WC, Liu YT, et al. Response surface optimized extraction of flavonoids from Mimenghua and its antioxidant activities in vitro[J]. Food Scicence and Biotechnology, 2013, 22(5):1285-1292.
[3] Keunho J, Jang NY, Kim YT. Isolation of lactic acid bacteria showing antioxidative and probiotic activities from kimchi and infant feces[J]. Journal of Microbiology and Biotechnology, 2015, 25(9):1568-1577.
[4] Dolatabadi JEN, Kashanian S. A review on DNA interaction with synthetic phenolic food additives[J]. Food Research International, 2010, 43(5):1223-1230.
[5] Zhang G, He L, Hu M. Optimized ultrasonic-assisted extraction of flavonoids fromPrunellavulgarisL. and evaluation of antioxidant activitiesinvitro[J]. Innovative Food Science & Emerging Technologies, 2011, 12(1):18-25.
[6] Guo L, Zhu W, Xu F, et al. Optimized ultrasonic-assisted extraction of polysaccharides fromCyclinasinensisand evaluation of antioxidant activities in vitro[J]. CyTA-Journal of Food, 2014, 12(1):32-39.
[7] Horta A, Pinteus S, Alves C, et al. Antioxidant and antimicrobial potential of theBifurcariabifurcataepiphytic bacteria[J]. Marine Drugs, 2014, 12(3):1676-1689.
[8] Xia S, Wang K, Wan L, et al. Production, characterization, and antioxidant activity of fucoxanthin from the marine diatomOdontellaaurita[J]. Marine Drugs, 2013, 11(7):2667-2681.
[9] Sun K, Li Y, Guo L, et al. Indole diterpenoids and isocoumarin from the fungus,Aspergillusflavus, isolated from the prawn,Penaeusvannamei[J]. Marine Drugs, 2014, 12(7): 3970-3981.
[10]Wang Y, Zheng J, Liu P, et al. Three new compounds fromAspergillusterreusPT06-2 grown in a high salt medium[J]. Marine Drugs, 2011, 9(8):1368-1378.
[11]Gomes NG, Lefranc F, Kijjoa A, et al. Can some marine-derived fungal metabolites become actual anticancer agents?[J]. Marine Drugs, 2015, 13(6):3950-3991.
[12]Rateb ME, Ebel R. Secondary metabolites of fungi from marine habitats[J]. Natural Product Reports, 2011, 28(2):290-344.
[13]Jones EBG, Sakayaroj J, Suetrong S, et al. Classification of marineAscomycota,AnamorphictaxaandBasidiomycota[J]. Fungal Diversity, 2009, 35(4):1-187.
[14]尚卓, 王斌贵. 海洋真菌来源的抗菌活性物质研究方法与进展[J]. 生命科学, 2012, 24(9):997-1011.
[15]叶波平, 贾阳阳, 许婷婷, 等. 来自红海榄根际土壤的曲霉属真菌F7菌株及其生物活性分析[J]. 菌物学报, 2010, 29(2): 241-248.
[16]郭雷, 朱文成, 刘玮炜, 等. 抗菌活性海洋真菌HN4-13的鉴定及其发酵优化[J]. 微生物学通报, 2013, 40(6):951-958.
[17]齐祖同. 中国真菌志(第5卷): 曲霉属及其相关有性型[M]. 北京: 科学出版社, 1997: 92-93.
[18]Siriwardane AM, Kumar NS, Jayasinghe L, et al. Chemical investigation of metabolites produced by an endophyticAspergillussp. isolated fromLimoniaacidissima[J]. Natural Product Research, 2015, 29(14): 384-1387.
[19]Song YC, Li H, Ye YH, et al. Endophytic naphthopyrone metabolites are co-inhibitors of xanthine oxidase, SW1116 cell and some microbial growths[J]. FEMS Microbiology Letter, 2004, 241(1): 67-72.
[20]Nielsen KF, Mogensen JM, Johansen M, et al. Review of secondary metabolites and mycotoxins from theAspergillusnigergroup[J]. Analytical & Bioanalytical Chemistry, 2009, 395(5):1225-1242.
[21]Sings HL, Harris GH, Dombrowski AW. Dihydrocarbazole alkaloids fromAspergillustubingensis[J]. Journal of Natural Product, 2001, 64(6):836-838.
[22]Tan QW, Gao FL, Wang FR, et al. Anti-TMV activity of malformin A1, a cyclic penta-peptide produced by an endophytic fungusAspergillustubingensisFJBJ11[J]. International Journal of Molecular Sciences, 2015, 16(3):5750-5761.
[23]Huang HB, Feng XJ, Liu L, et al. Three dimeric naphtho-γ-pyrones from the mangrove endophytic fungusAspergillustubingensisisolated fromPongamiapinnata[J]. Planta Medica, 2010, 76(16):1888-1891.
[24]Zhan J, Gunaherath GM, Wijeratne EM, et al. Asperpyrone D and other metabolites of the plant-associated fungal strainAspergillustubingensis[J]. Phytochemistry, 2007, 68(3):368-372.
[25]Shaaban M, Shaaban KA, Abdel-Aziz MS. Seven naphtho-γ-pyrones from the marine-derived fungusAlternariaalternata: structure elucidation and biological properties[J]. Organic& Medicinal Chemistry Letters, 2012, 2(1):1-8.
[26]Akiyama K, Teraguchi S, Hamasaki Y, et al. New dimeric naphthopyrones fromAspergillusniger[J]. Journal of Natural Products, 2003, 66(1):136-139.
[27]Bouras N, Mathieu F, Coppel Y, et al. Aurasperone F-a new member of the naphtho-gamma-pyrone class isolated from a cultured microfungus,AspergillusnigerC-433[J]. Natural Product Research, 2005, 19(19):653-659.

