响应面法优化短短芽胞杆菌ch2-22的发酵工艺
孙 文, 刘倩倩, 胡彦婷, 王雅娜, 程辉彩, 张根伟, 张丽萍*
(1.河北工业大学 化工学院,天津 300130;2.河北省科学院生物研究所,河北 石家庄 050081;3.河北省主要农作物病害微生物控制工程技术研究中心,河北 石家庄 050081)
灰葡萄孢(Botrytiscinerea)能够侵染番茄、黄瓜、西葫芦等多种植物,会造成不同程度的损失,严重时可减产50%以上,由其引起的灰霉病是农作物最主要的病害之一。短短芽胞杆菌(Brevibacillusbrevis)是一种革兰阳性菌,在生长过程中能够产生短杆菌肽、脂类、碱性蛋白酶、几丁质酶等活性代谢产物[1-4],在植物保护、食品、医药、保健等领域有很好的应用前景。本研究室从土壤中分离筛选出1株拮抗菌株短短芽胞杆菌ch2-22,研究室前期试验结果表明该菌株发酵能够产生唯一的抗菌物质—3 kD的短杆菌肽,可以有效抑制灰霉病原菌、炭疽病原菌、叶枯病原菌等多种病原真菌,具有广谱的抗真菌活性,且应用试验结果也表明ch2-22发酵液对黄瓜灰霉病、棉花枯萎病具有很好的防治效果,对植物生长有明显的促进作用[5-6]。短短芽胞杆菌ch2-22菌株及其代谢产物有望开发为生防制剂,用于多种真菌引起的植物病害,可以促进化学农药的减施,解决化学农药带来的一系列食品安全与环境方面的问题,从而促进环境生态平衡和农业的可持续发展。提高菌株的发酵芽胞数量与发酵液抑菌活性是制备高质量生防制剂的前提。本研究以灰霉病菌为指示菌,旨在菌株抑菌活性有所提高的情况下,着重优化了提高发酵芽胞数量的发酵培养基和培养条件,为开发高质量的ch2-22生防菌剂和该菌株的工业化生产奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株 短短芽胞杆菌ch2-22菌株,由河北省科学院微生物研究室保存。
1.1.2 培养基 NB培养基:葡萄糖10 g,蛋白胨10 g,酵母膏1 g,调节pH至7.0,定容1 L;115 ℃高压蒸汽灭菌30 min,用于菌株的种子液培养;PB培养基:蛋白胨10 g,牛肉膏5 g,氯化钠5 g,琼脂12 g,调节pH至7.0,定容1 L,用于平板活菌计数;马铃薯培养基(PDA): 马铃薯200 g,葡萄糖20 g,琼脂12 g,水1 L,用于抑菌活性检测。
1.1.3 主要试剂及仪器 培养基所需试剂均购自天津市永大化学试剂有限公司与天津博迪化工股份有限公司;SPX-100B-Z型恒温培养箱(上海博迅实业有限公司医疗设备厂),Innova 43R Shaker摇床(英国New Brunswick)。
1.2 方法
1.2.1 种子液的制备 将4 ℃保存的ch2-22菌株斜面取一环转接到NB液体培养基中,32 ℃、200 r/min摇床培养18 h,得到种子液。
1.2.2 芽胞浓度的测定 将发酵液于80 ℃水浴20 min,稀释后平板计数。
1.2.3 发酵培养基单因素试验 ①碳源的筛选:分别以1%可溶性淀粉、蔗糖、葡萄糖、木糖、乳糖、柠檬酸三钠、乙酸钠和玉米粉代替NB培养基中的碳源。以5%的接种量将种子液分别接种到液体培养基中(80 mL/500 mL),32 ℃、200 r/min培养30 h取样,测其抑菌活性,培养36 h后取样,测定其芽胞数量,每个处理重复3次。②氮源的筛选:分别以1%大豆饼粉、鱼粉、硫酸铵、硝酸铵、硝酸钠、尿素、蛋白胨、牛肉膏和胰蛋白胨代替NB培养基中的氮源。以5%的接种量将种子液分别接种到液体培养基中(80 mL/500 mL),32 ℃、200 r/min培养30 h取样,测其抑菌活性,培养36 h后取样,测定其芽胞数量,每个处理重复3次。
1.2.4 响应面试验设计 用Design expert 8软件进行响应面设计,并且对实验数据进行回归性分析,用t反映回归系数的显著性,F反映模型方程的显著性,R2反映方程的拟合效果[7-10]。
1.2.5 发酵培养条件的优化 根据培养基优化结果,选取pH、温度、接种量、装液量、转速为液体发酵影响因素[11-14],进行单因素试验,逐个进行优化,在进行优化后一个因素时,采用前一个优化好的因素,选出最佳发酵条件。
1.2.6 抑菌物质效价的测定 以两性霉素B为标准品,利用琼脂扩散法测抑菌圈直径,得到效价对数与抑菌圈直径线性关系的标准曲线。将发酵液8 000 r/min离心20 min,过滤,稀释适当倍数使抑菌圈直径在标准曲线范围内,根据标准曲线得到发酵液的效价。
2 结果与分析
2.1 发酵培养基单因素试验结果
2.1.1 碳源的筛选 由图1可知,碳源为可溶性淀粉、葡萄糖、蔗糖时,发酵芽胞数量与抑菌活性较木糖、乳糖、玉米粉、乙酸钠、柠檬酸三钠为碳源时的高,且由于葡萄糖高温灭菌时会产生糖醛,对菌体生长有一定副作用,所以选取可溶性淀粉为最佳碳源,蔗糖为辅助碳源。
2.1.2 氮源的筛选 由图2可知,菌株ch2-22对无机氮源的利用率较低,产生的菌体量少且发酵液抑菌活性较低,而在豆饼粉、鱼粉、牛肉膏等有机氮源中菌体产生量较多,并且抑菌活性都比其他氮源高,考虑到鱼粉廉价且研究中发现其对芽胞形成有促进作用,所以选取豆饼粉为最佳氮源,鱼粉为辅助氮源。
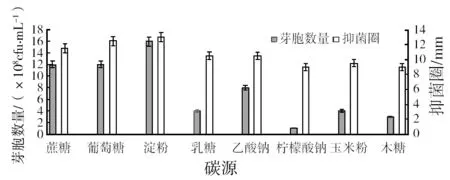
图1 碳源单因素试验结果Fig.1 The results of single factor experiments of carbon source
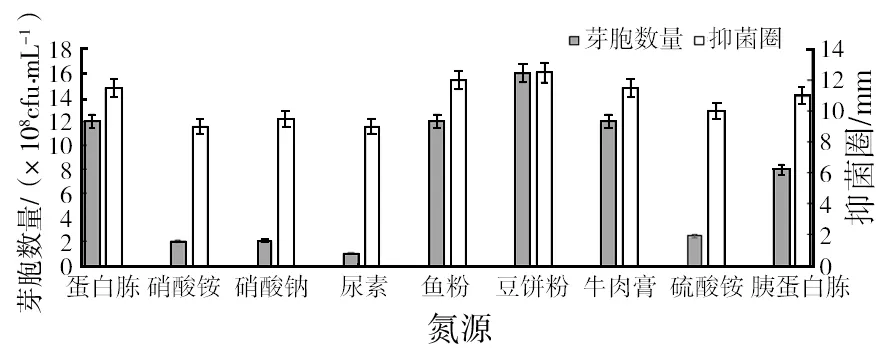
图2 氮源单因素试验结果Fig.2 The results of single factor experiments of nitrogen source
2.1.3 无机盐的筛选 以优化的碳氮源培养基为基础,分别添加10种无机盐,其含量及试验结果见表1,单因素试验结果显示K2HPO4、(NH4)2SO4、CaCO3、NaCl、MgSO4、MnSO4对提高芽胞数量和提高发酵液抑菌活性有影响,其他无机盐则无明显作用或有负作用。
2.1.4 爬坡实验 由表1可知6种目标无机盐对发酵液抑菌活性影响不大,选取对短短芽胞杆菌ch2-22芽胞浓度影响最大的3种无机盐即K2HPO4、(NH4)2SO4、CaCO3进行梯度爬坡实验,结果见表2,K2HPO4为0.3%、(NH4)2SO4为0.3%、CaCO3为0.2%时芽胞浓度最高。
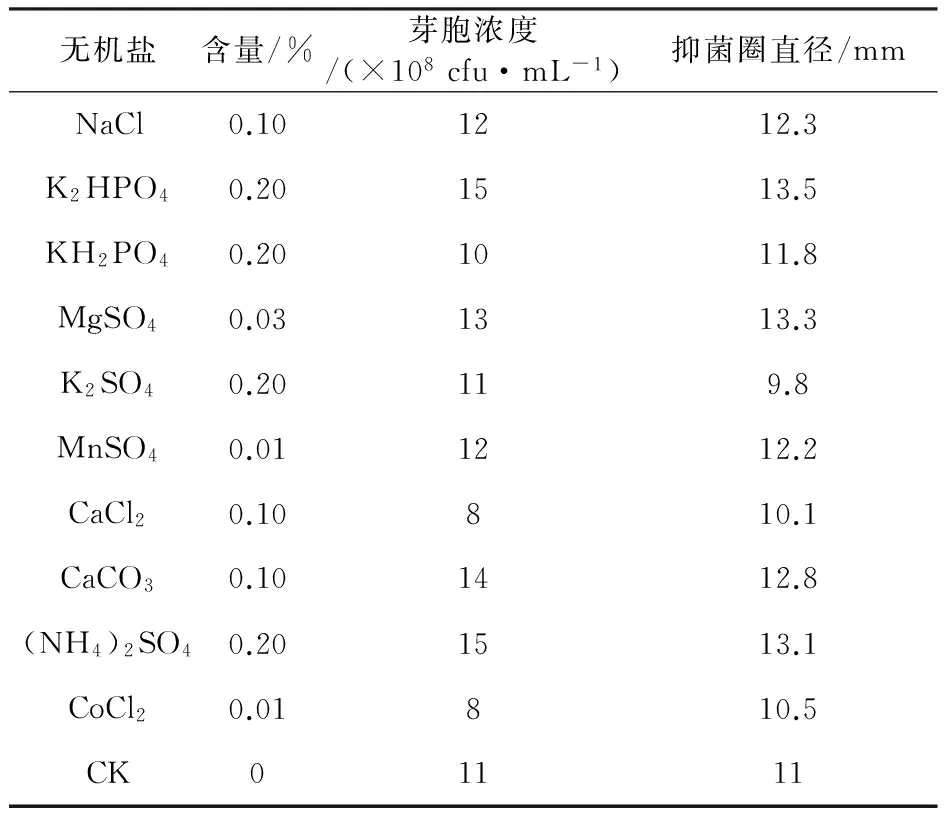
表1 无机盐单因素试验设计及结果
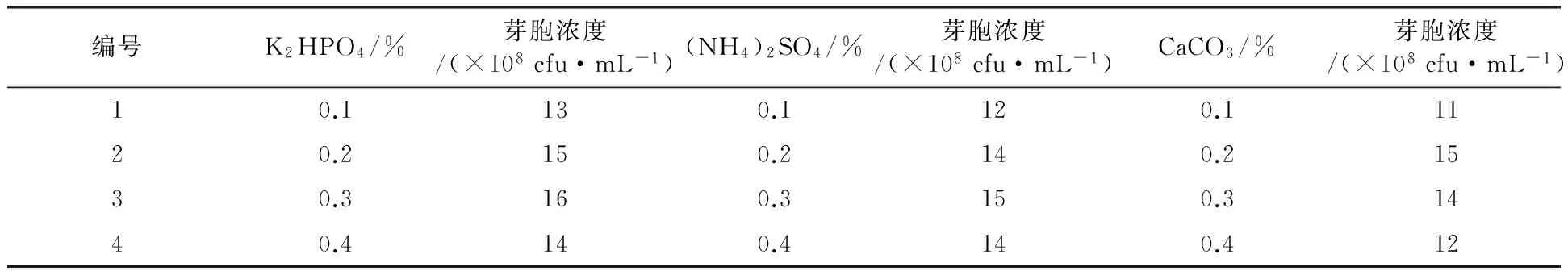
表2 无机盐梯度爬坡试验
2.2 响应面法确定发酵培养基组分浓度
2.2.1 Plackett-Burman试验确定初始发酵培养基中的重要影响因子 以发酵芽胞数量为判断标准,对初始发酵培养基中的7个因素淀粉 X1、豆饼粉 X2、蔗糖 X3、鱼粉 X4、(NH4)2SO4X5、K2HPO4X6、CaCO3X7进行考察,设计实验,实验结果见表3、4。由表3和表4可以看出,各因素按重要性依次为淀粉、豆饼粉、蔗糖、鱼粉、K2HPO4、CaCO3、(NH4)2SO4。其中淀粉、豆饼粉和蔗糖对菌株生长繁殖影响最大,是影响菌株发酵生长的主要影响因子,均为正效应。
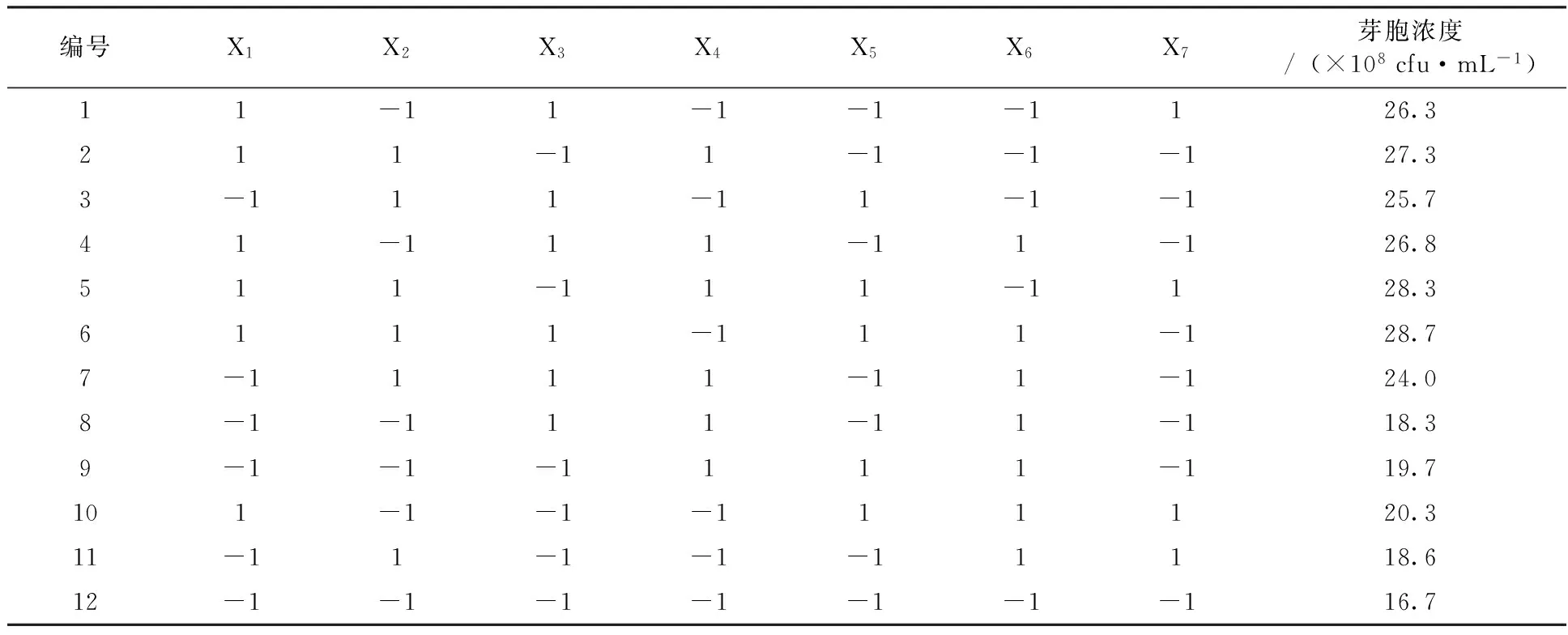
表3 Plackett-Burman实验设计与结果

表4 Plackett-Burman实验分析
2.2.2 最陡爬坡实验确定培养基重要影响因子的最适浓度范围 重要影响因子淀粉、豆饼粉、蔗糖浓度变化的实验设计及结果见表5,可以看出随着重要影响因子浓度的增加,发酵液活菌浓度的变化趋势为先上升后下降,淀粉3.5%、豆饼粉2.6%、蔗糖1.0%时对应的发酵芽胞数最高,为三因子的最大响应值区域。
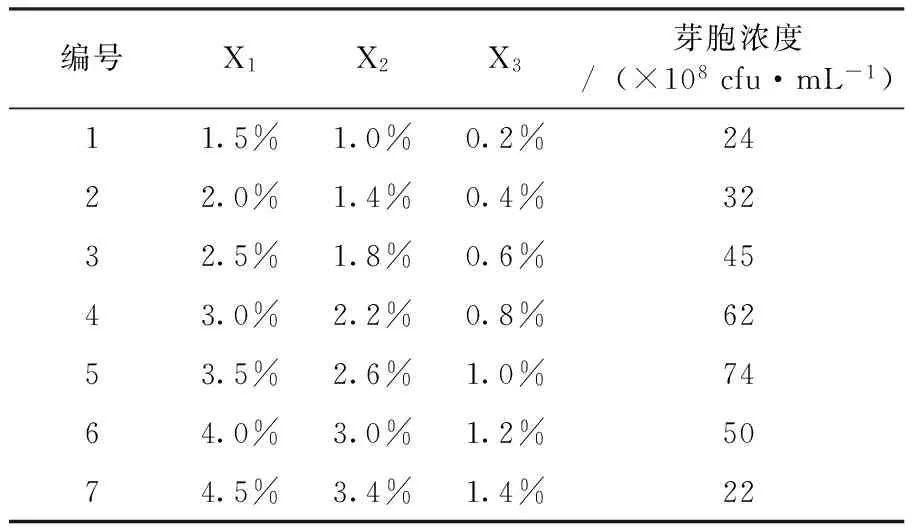
表5 爬坡实验梯度设计与结果
2.2.3 Box-Behnken试验确定培养基重要影响因子的最佳浓度 试验确定培养基重要影响因子的最佳浓度,三个重要因子的最适浓度范围确定后,以淀粉3.5%、豆饼粉2.6%、蔗糖1.0%为中心点施行响应面分析,各因素水平见表6,实验设计及结果见表7。由Design expert 8拟合出的回归方程模型为:Y=76.67+5X1+3.12X2+0.62X3-5.25X1X2-0.75X1X3+1.5X2X3-26.83X12-12.58X22-10.58X32,方程回归分析见表8。
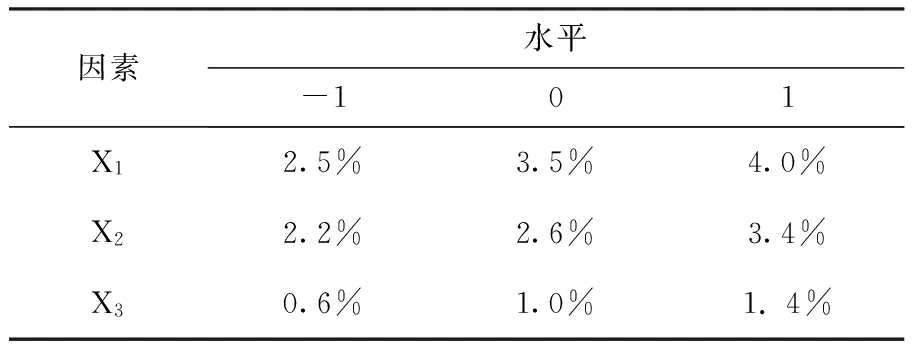
表6 Box-Behnken设计因子及水平列表
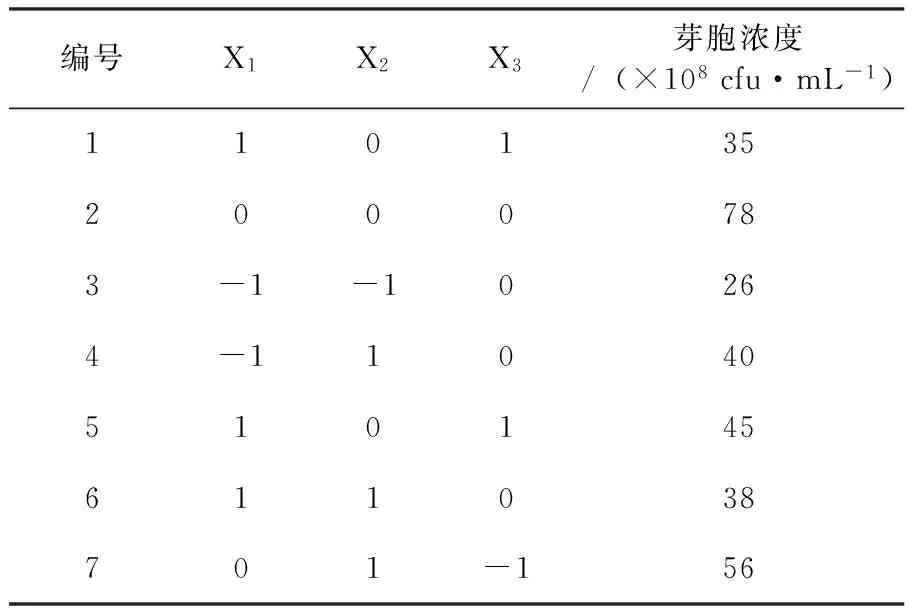
表7 Box-Behnken实验设计及结果

续表7
由方差分析得出P=0.000 1,表明回归方程显著性很好,且R2=91.34%,说明响应模型可以解释91.34%菌体发酵水平的变化,能够很好地反映ch2-22的发酵过程。响应面回归分析和回归方程绘制的响应面图形如图3、4、5所示。观察上述图形的变化趋势,可以看出X1、X2、X3在试验范围内存在极大值。这三个组分的最优试验点为(0.1、0.1、0),即淀粉35.05 g/L、豆饼粉26.08 g/L、蔗糖10 g/L,在此点预测的发酵芽胞浓度为7.1×109cfu/mL。由图3、4、5可以看出X1X2、X1X3等高线呈椭圆形,交互作用显著,X2X3等高线近似圆形,交互作用不显著。
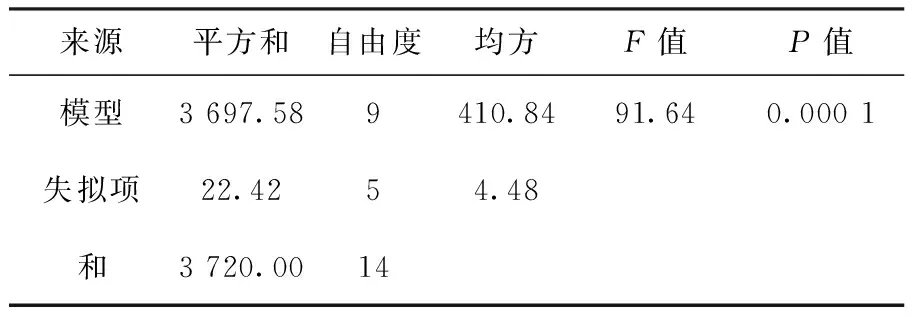
表8 回归模型的方差分析

图3 淀粉与豆饼粉交互作用对芽胞浓度预测的响应面图和等高线图Fig.3 Response surface plot and contour plot of spore concentration versus starch and soybean powder

图4 淀粉与蔗糖交互作用对芽胞浓度预测的响应面图和等高线图Fig.4 Response surface plot and contour plot of spore concentration versus starch and sucrose
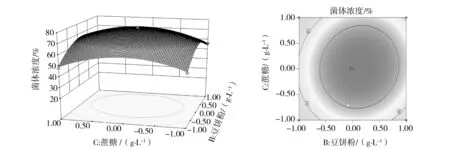
图5 豆饼粉与蔗糖交互作用对芽胞浓度预测的响应面图和等高线图Fig.5 Response surface plot and contour plot of spore concentration versus soybean powderand sucrose
2.2.4 模型验证 为了验证模型预测的准确性,在优化条件下进行3组装液量为80 mL/500 mL发酵实验,测得的平均芽胞浓度为7.2×109cfu/mL,与模型预测值非常相近,说明设计的模型,能够很好地预测短短芽胞杆菌ch2-22的发酵情况而且此时与灰霉的对峙试验测得抑菌圈直径为15 mm,抗菌物质效价为3 350 IU/mL,比之前的1 600 IU/mL提高了109%。图6为未稀释的发酵液与灰霉的对峙实验结果。
2.3 发酵条件的单因子试验
2.3.1 初始pH和温度对菌株生长和发酵液活性的影响 由图7可知,pH为7.0时,芽胞浓度与抑菌活性都达到最高,所以最适pH为7.0。在28~32 ℃范围内随着温度上升,芽胞数量逐渐升高,32 ℃时发酵液也显示出较强的抑菌活性,温度高于32 ℃时,发酵液芽胞数量与抑菌活性均下降,可能是因为温度过高,菌体不宜生长导致自溶,所以ch2-22的最适培养温度为32 ℃。
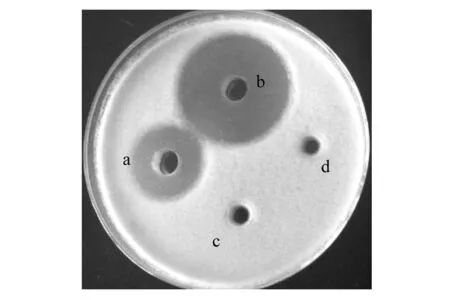
图6 发酵液与灰霉对峙试验结果Fig.6 The results of Broth confrontation with gray mold test a:优化前发酵液(接种);b:优化后发酵液(接种);c:优化前发酵液(未接种);d:优化后发酵液(未接种)a: the broth of pre-optimization (inoculated); b: the broth of optimized (inoculated); c: the broth of pre-optimization (uninoculated);d: the broth of optimized (uninoculated)
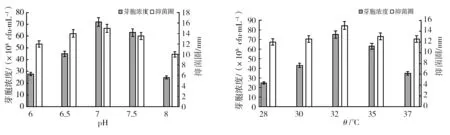
图7 pH和温度对发酵芽胞浓度与抑菌活性的影响Fig.7 Effects of temperature and pH on the spore concentration and anti-fungal activity
2.3.2 接种量对菌体生长和抑菌活性的影响 由图8可知,接种量在1%~4%范围内,芽胞数量与抑菌活性逐渐上升,当接种量大于4%时,随着接种量的增大,芽胞数量开始减少,可能是因为培养基营养成分的过度消耗引起的,所以最佳接种量为4%。
2.3.3 装液量和转速对菌体生长和抑菌活性的影响 由图9可知,当500 mL三角瓶装液量为100 mL时,芽胞数量与抑菌活性都达到最高。当装液量高于或低于100 mL时,芽胞数量下降,且抑菌活性也降低,说明ch2-22菌株对通气量有一定要求,装液量过多过少都不利于菌体发酵,所以100 mL为最佳装液量;转速在120~180 r/min时,芽胞数量与抑菌活性都逐渐增加,在180 r/min时达到最大值,当转速超过180 r/min时,芽
胞数量与发酵液抑菌活性逐渐降低,可能是因为转速太高导致菌体细胞损伤而影响其生长,所以最佳转速为180 r/min。
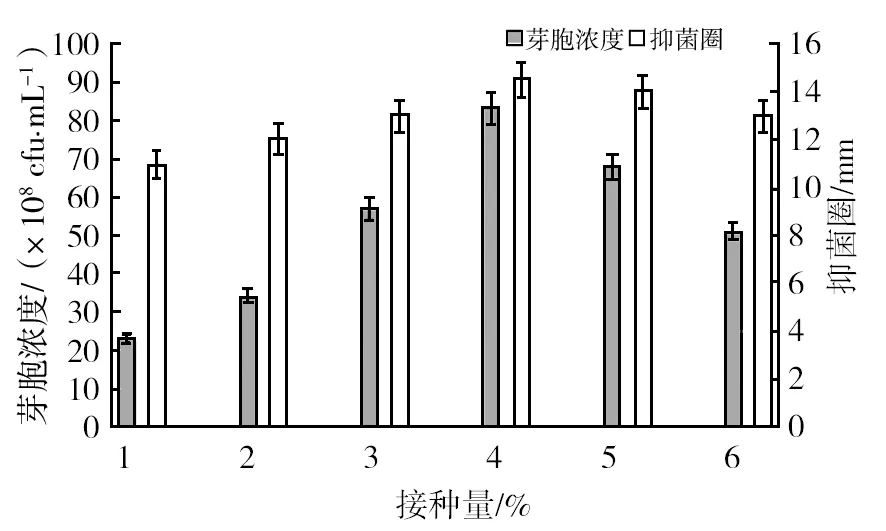
图8 接种量对发酵芽胞浓度与抑菌活性的影响Fig.8 Effect of inoculum on the spore concentration and anti-fungal activity
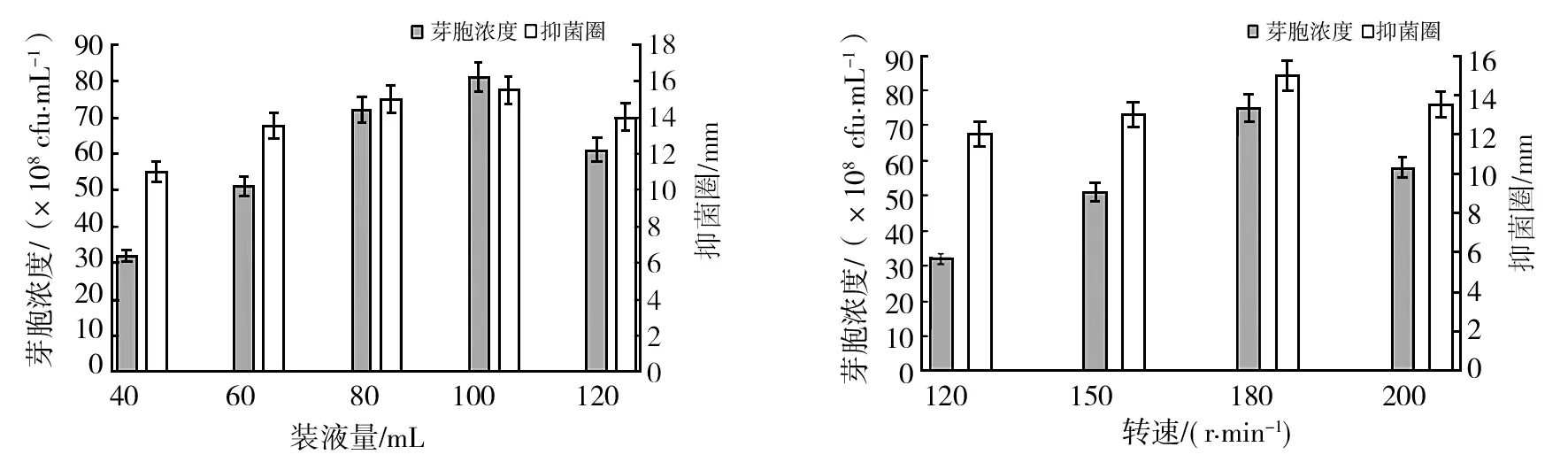
图9 装液量和转速对发酵芽胞浓度与抑菌活性的影响Fig.9 Effect of liquid volume and shaking speed on the spore concentration and anti-fungal activity
2.3.4 最佳培养条件验证 使用优化后的发酵培养基与发酵条件,测得芽胞数量为8.1×109cfu/mL,抑菌效价为3 350 IU/mL。
3 讨 论
本研究以发酵芽胞浓度和抑菌活性为衡量指标,从培养基碳源、氮源和无机盐种类与含量及温度、转速、pH、装液量和接种量等发酵条件进行了优化[15-18]。采用廉价且易获得的原料进行液体发酵并且优化结果显著。
Plackett-Burman试验设计优点在于试验次数少、精度高,能够在众多因素中挑选出影响试验的主要因素[19]。本研究优化后的培养基配方为可溶性淀粉35.05 g/L,豆饼粉26.08 g/L,蔗糖10 g/L,鱼粉5 g/L,NaCl 1 g/L,MgSO40.3 g/L,(NH4)2SO43 g/L,MnSO40.1 g/L,K2HPO43 g/L,酵母膏1 g/L,CaCO32 g/L。优化结果显示可溶性淀粉、豆饼粉和蔗糖对提高菌株发酵芽胞浓度影响最大,且鱼粉作为辅助氮源时能够有效提高菌体芽胞率,从而提高菌株抗性,对生防制剂的制备有很大帮助[20]。
优化后培养条件为温度32 ℃,转速180 r/min,装液量100 mL/500 mL,接种量4%,初始pH为7.0,发酵时间45 h。菌体最佳装液量100 mL,比解淀粉芽胞杆菌、枯草芽胞杆菌等芽胞杆菌要多,说明菌株ch2-22对溶氧要求比其他芽胞杆菌低,而且研究中发现菌株ch2-22在发酵过程中pH往碱性方向变化,与其他芽胞杆菌[21-]有所差异,原因可能是该菌株的代谢途径与其他菌株不同,有待研究。
优化后菌株发酵结束时pH稳定在7.5~8.0,芽胞浓度达到8.1×109cfu/mL,比优化前提高3.7倍,高于其他芽胞杆菌一般发酵水平的6.0×109cfu/mL;发酵液效价达到3 350 IU/mL,比优化前提高109%,优化水平高于同类菌株的2 000 IU/mL,且该菌株作为生防制剂的主要原料,对解决土壤酸化问题,提高土地资源利用率及化学农药的减施和复合菌肥的开发与应用具有重要意义。
[1] 苏明慧, 胡雪芹, 顾东华, 等. 短短芽胞杆菌几丁质酶的分离纯化及酶学性质[J]. 食品科学, 2015, 36(19): 176-179.
[2] 汪茜, 胡春锦, 柯仿刚, 等. 生防菌株1404的鉴定及其对采后柑橘炭疽病的防治效果[J]. 微生物学报, 2010, 50(9): 1208-1217.
[3] 马桂美, 车建美, 刘波, 等. 短短芽胞杆菌功能基因的研究及其应用[J]. 生物技术进展, 2012, 2(2): 92-97.
[4] Arutchelvan V, Kanakasabai V, Elangovan R, et al. Kinetics of high strength phenol degradation usingBacillusbrevis[J]. Journal of Hazardous Materials, 2006, 129: 216-222.
[5] 仇艳肖. 黄瓜灰霉病高效拮抗菌的筛选鉴定及其作用研究[D]. 石家庄:河北师范大学, 2012.
[6] 吴月, 李海群, 乔雪, 等. 辣椒枯萎病拮抗细菌Ljb002菌株发酵条件的优化[J]. 微生物学杂志, 2015, 35(5): 67-72.
[7] Che JM, Liu B, Chen Z, Shi H, et al. Identification of ethylparaben as the antimicrobial substance produced byBrevibacillusbrevisFJAT-0809-GLX[J]. Microbiological research, 2015, 172: 48-56.
[8] 陈志谊. 芽胞杆菌类生物杀菌剂的研究开发与应用[J]. 中国生物防治学报, 2015, 31(5): 723-732.
[9] Arrebola E, Jacobs R, Korsten L. Iturin A is the principal inhibitor in the biocontrol activity ofBacillusamyloliquefaciensPPCB004 against postharvest fungal pathogens[J]. Journal of Applied Microbiology, 2010, 108: 386-395.
[10]刘京兰, 薛雅荣, 刘常宏. 内生解淀粉芽胞杆菌CC09产Iturin A摇瓶发酵条件优化[J]. 微生物学通报, 2014, 41(1): 75-82.
[11]Lizotte DJ, Greiner R, Schuurmans D. An experimental methodology for response surface optimization methods[J]. Journal of Global Optimization, 2012, 53(4): 699-736.
[12]芮广虎, 胡雪芹, 殷坤, 等. 响应面法优化短短芽胞杆菌FM48的发酵培养基[J]. 食品科学, 2012, 33(15): 257-261.
[13]祝赛峰, 吴建峰, 赵希荣. 响应面法优化枯草芽胞杆菌S0507产四甲基吡嗪的培养条件[J]. 食品科学, 2014, 35(9): 218-223.
[14]章小洪, 汪琨, 朱廷恒, 等. 解淀粉芽胞杆菌BW-13培养基和培养条件优化[J]. 浙江工业大学学报, 2013, 41(1): 35-39.
[15]周喻, 吴文惠, 苏同伟, 等. 响应面法优化海洋镰刀腐皮菌产出HMG-CoA还原酶抑制剂的培养条件[J]. 微生物学通报, 2014, 41(8):1516-1524.
[16]洪鹏, 安国栋, 胡美英, 等. 解淀粉芽胞杆菌HF-01发酵条件优化[J]. 中国生物防治学报, 2013, 29(4):569-578.
[17]王新磊, 闫巧娟, 江正强, 等. 地衣芽胞杆菌发酵淀粉产乳酸条件的优化[J]. 中国酿造, 2010, 7: 23-27.
[18]Chen XC, Bai JX, Cao JM, et al. Medium optimization for the production of cyclic adenosine 3′,5′-monophosphate byMicrobacteriumsp. no. 205 using response surface methodology[J]. Bioresource Technology, 2009, 100(2):919-924.
[19]成莉凤, 戴小阳, 冯湘沅, 等.BacillussubtilisBE-91生长及其胞外表达β-甘露聚糖酶的发酵条件优化[J]. 微生物学通报, 2015, 42(12): 2300-2307.
[20]杨代凯, 陈守文, 黎煊. 解淀粉芽胞杆菌ZM9液体发酵伊枯草菌素A培养基优化[J]. 应用化工, 2015, 44(3): 428-430.
[21]Ye JJ, Cao NN, Zhang JF, et al. Research Application Progress on theBacillussp. in Plant Pathogenic Fungi Biocontrol[J]. Agricultural Science & Technology, 2013, 14(5): 695-698.

