一种黄秋葵病原真菌的分离鉴定
曹 亮, 宋 荣, 周佳民, 朱校奇, 谢 进, 徐 瑞, 黄艳宁
(湖南省农业科学院 农业生物资源利用研究所,湖南 长沙 410125)
黄秋葵(Abelmoschusesculentus(L.) Moench)又名咖啡秋葵、羊角豆、美人指 (lady′s finger) 等,是锦葵科秋葵属一年生草本植物,在我国引种栽培已经有较长时间[1]。黄秋葵嫩荚含有丰富的蛋白质、多糖、不饱和脂肪酸、凝集素等多种营养功能成分[2],有降血脂[3]、抗氧化[4-5]、抗疲劳[6-8]、抗菌[9]及治疗糖尿病[10]等药用保健价值。在印度、巴基斯坦等地是主要蔬菜品种,在我国逐渐成为一种新型的保健蔬菜,受到人们的青睐,在我国热带及亚热带地区广泛栽培[11],但是黄秋葵忌连作,其病害发生较普遍,国外报道的主要有黄脉花叶病毒(YVMV)[12]、束顶病[13],以及卷叶病毒[14]等,黄秋葵在国内也有关于烟粉虱传双生病毒[15]的报道;此外还有疫病[16]、立枯病等病害的报道[17]及虫害[18]的研究。作者也于 2011 年在湖南衡阳和长沙的黄秋葵种植大田发现一种黄秋葵花蕾真菌病害,此后,一直在田间能观察到此病害的发生,特别是在 6~7 月份的高温多雨季节发生尤为严重,该病害主要感染黄秋葵花蕾,表现为花蕾表面覆盖一层毛茸茸的霉层,花冠腐败,黏覆在子房的外围,阻碍子房发育;如遇持续的阴雨天气,会进一步导致子房腐烂,影响果实形成(图 1)。该病在不同植株间传播,可导致黄秋葵严重减产。因此,明确该病害的病原菌,对于黄秋葵的栽培生产尤为重要,本研究对发现的黄秋葵病原菌进行了鉴定,同时对田间致病力进行了研究。
1 材料与方法
1.1 材料
1.1.1 带病组织材料 带病的黄秋葵花蕾材料于2012年自衡阳市衡南县江口镇九龙生态农业有限公司基地采集(图 1)。用牛皮纸袋包装后放入事先装有冰袋的保鲜盒,带回实验室进行病原菌的分离。
1.1.2 试剂与仪器 PDA培养基(含链霉素100 μg/mL,防止细菌生长),查氏琼脂(CA)培养基,Taq酶(东洋纺),琼脂糖 (biowest),引物及测序(上海生工);灭菌锅(LDZH-100KBS,上海申安医疗器械厂),净化工作台(SW-CJ-1D,江苏苏净集团),生化培养箱(上海一恒科学仪器有限公司),PCR仪(德国Eppendorf),EPS 300电泳系统、凝胶成像系统(北京六一仪器厂),光学显微镜(UB100i, 重庆澳浦光电技术有限公司)。
1.2 方法
1.2.1 病原菌分离纯化 用无菌镊子从带病组织表面挑取真菌孢子至灭菌蒸馏水中,平板划线法接种到装有15 mL PDA培养基的培养皿中,28 ℃ 培养箱中培养 2~5 d。待产孢子后,挑取孢子制备孢子悬浮液,划线接种法接种到新的 PDA 平板培养基,采用相同接种方法,连续接种 5 次对菌株进行纯化,然后挑取菌丝接种到 PDA 试管斜面中,4 ℃ 保存。
1.2.2 病原菌形态观察及鉴定 观察染病花蕾组织表面病原菌的生长情况及形态特征。并将分离的待测菌株在PDA 和 CA 培养基上培养 7 d,观察菌落形态特征,在光学显微镜下观察待测菌株产孢结构和孢子形态特征,对菌株进行形态学鉴定。
1.2.3 病原菌的分子鉴定 使用真菌分子鉴定的 ITS 序列通用引物 ITS 1 (5′-TCCGTAGGTGAACCTGCGG-3′) 和 ITS 4 (5′-TCCTCCGCTTATTGATATGC-3′) 对真菌核糖体DNA内转录间隔区 (ITS 1- 5.8 S- ITS 2) 的序列进行扩增,测序后使用 BioEdit 软件打开测序图谱,去掉两端引物信号,在 NCBI 中进行 Blast 比对,并构建发育树,确定菌株 ITS 序列的分类特征,进行分子鉴定。
1.2.4 致病性测定 ① 花蕾回接测试:将分离得到的菌株在 PDA平板培养 3 d,获得活化的病原菌。剪取健康花蕾,整齐放入灭菌保鲜盒中带回实验室作为供试材料。将花蕾用酒精表面消毒,放入装有 20 mL PDA 培养基的培养瓶中;使用无菌水冲洗培养基表面,获得孢子悬浮液,在无菌条件下过滤,稀释并用血球计数板测定孢子浓度,使用浓度约为 1×106个/mL 的孢子悬浮液 10 μL 接种,用移液枪吸取孢子悬浮液滴加到花冠上,对照组用无菌水 10 μL 接种,每组设置 3 个重复。在生化培养箱中 28 ℃恒温培养,每天观察花蕾变化并记录,花蕾发病后从带病组织再次分离培养病原菌,并与原接种菌株进行比较。② 田间致病性测试:选择晴天上午 10 点至 12 点之间进行,利用上述分离病原菌进行大田致病性测定。选取没有病害发生的栽培地块,接种 100 μL 浓度约为 1×106个/mL 的孢子悬浮液到健康花蕾上,空白对照接种 100 μL 灭菌蒸馏水,每个处理设置 3 个重复,每个重复选取 5 朵花蕾,接种后用透明袋套住花蕾。每天观察发病情况及发病特征并做记录,持续 1 周。该实验重复 1 次。对染病花蕾进行病原菌分离,并与原接种菌株进行比较。
2 结果与分析
2.1 真菌形态观察及分离纯化
病菌在花蕾组织表面生长旺盛,肉眼可见白色,长度为 3~5 mm 分生孢子梗及暗褐色微小的分生孢子头密集分布于花蕾表面,使整个花蕾呈毛茸茸状(图 1)。通过分离纯化方法获得了 1 株真菌的纯化菌株。该菌株在 PDA 培养基上生长迅速,28 ℃培养 3 d 菌落直径达 4~5 cm,中心呈暗褐色,菌落背面平坦呈放射状。

图1 染病的黄秋葵花蕾及子房Fig.1 infected bud and ovary of A. esculentus A:染病花蕾;B:染病子房A: infected bud; B: infected ovary
2.2 病原菌致病性测定
2.2.1 花蕾回接测试 利用上述菌株进行室内回接致病性测定,结果显示在 28 ℃培养 2 d 后,接种孢子的花蕾染病,症状与染病花蕾相同,而空白没有染病。从接种发病的花蕾上,重新分离纯化获得的真菌株,其培养性状与前期接种菌株的性状相同,见图 2。

图2 黄秋葵花蕾回接试验Fig.2 Pathogenicity test on flower of A. esculentus A:接种前;B:接种后;图3同A: before inoculation;B: after inoculation
2.2.2 病原菌田间致病性测定 田间试验表明黄秋葵的花蕾在接种孢子后 2 d 左右表现出病害,见图3。接种孢子致病率为 80%,空白对照的致病率为零。花蕾染病后,整个花蕾外观为毛茸茸的球状,后期枯死变黑,发病特征与田间取样的病害特征一致。染病花蕾经再分离试验发现分离菌株与接种菌株一致。根据柯赫氏法则 (Koch′s postulate),该菌株为黄秋葵花蕾的致病菌。
2.3 病原菌的鉴定
2.3.1 形态鉴定 菌株在 CA 培养基上生长缓慢,28 ℃ 培养 7 d 菌落直径为 2.5~4.0 cm,菌落中心下凹、四周突起、边缘呈放射状,质地疏松,生长初期呈白色,后期表面产生褐色干粉,菌落呈圆形;在PDA培养基上生长迅速,28 ℃培养 7 d 菌落布满整个平板,质地紧密,呈丝绒状,气生菌丝较多,中心下凹、四周突起,背面平坦放射状,呈褐色,菌落表面有干粉,无渗出液。镜检可见足细胞,分生孢梗茎不分枝也不具分隔,表面光滑,无色或淡褐色,顶囊明显,初生时呈椭圆形,后呈球形,直径 50~65 μm,顶囊和孢梗茎接连处无缢缩现象,表面可育,呈褐色,可见瓶梗细胞,分生孢子球形,表面粗糙具小刺、疣,直径约 5 μm,可见不分枝的分生孢子链,分生孢子头呈球形(图 4)。参照传统的真菌分类方法[19],初步鉴定此病原菌属于曲霉属 (Aspergillus) 真菌。

图3 田间测试棘孢曲霉对黄秋葵花蕾的致病性Fig.3 Pathogenicity of A. aculeatus to the buds of A. esculentus in culture field
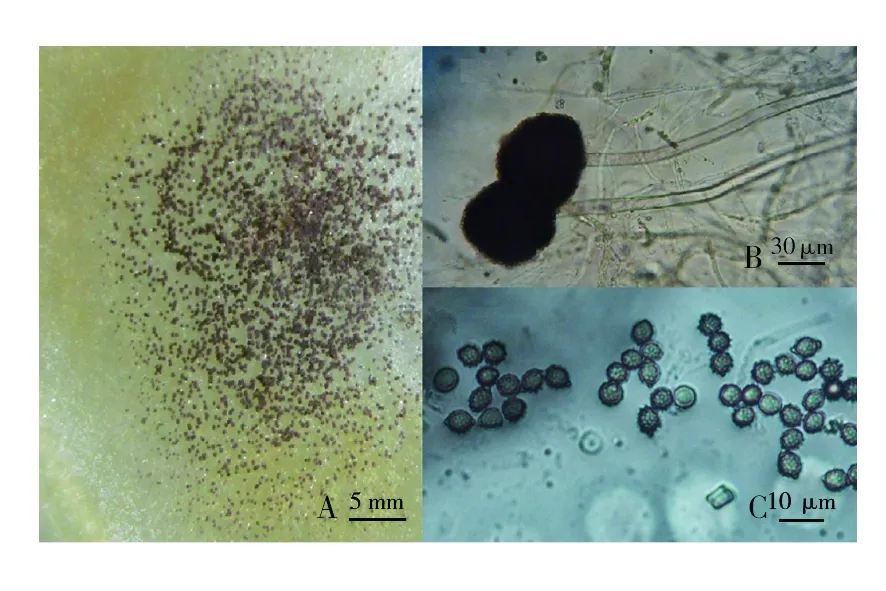
图4 病原真菌培养特征和产孢形态Fig.4 Cultural features and sporulation structure of the pathogen A. aculeatus A:PDA培养基上菌落;B:分生孢子梗及分生孢子头;C:孢子A:Colony features on PDA;B:conidiophone and conidial head;C:Conidium
2.3.2 分子鉴定 通过 ITS 通用引物扩增,测序后进行序列分析,获得 537 bp 的 DNA 片段。该菌株ITS 序列在 GenBank 登录序列号为 KM014690.1。通过 Blast 分析,获得该序列与 GenBank 中序列的比对结果,下载与该序列比对结果最相近的前 20 条序列,它们的 E 值都为零,相似度(Ident)都在 99%以上,使用 bioedit 和 mega 5.05 软件进行序列比对分析,使用 UPGMA、邻接(neighbour joining)及最大相似度(maximum likelihood)算法构建树形图(图 5)。发现以上三种树形图中该序列都与已登录的棘孢曲霉Aspergillusaculeatus序列聚集为一类,因此鉴定该病原真菌为棘孢曲霉。

图5 原菌序列 (KM014690.1) 与比对序列的聚类(邻接法 )Fig.5 Cluster tree of pathogenic sequence(KM014690.1)and the significant alignments (neighbour joining)
3 讨 论
目前报道的棘孢曲霉主要分离自谷物及土壤等,能产生丰富的酶类,具有良好的降解活性,如产生多糖降解酶[20],可用于农业废弃物的降解,产生甜菊糖降解酶能将甜菊糖转化为其他产物[21],能与蚕砂发酵产生果胶酶[22],可产生果糖寡聚体酶[23],此外棘孢曲霉产生柚苷酶的发酵条件及柚苷酶在柑橘果汁脱苦中的应用也有较多报道[24]。而黄秋葵花蕾富含多糖和果胶等营养成分,这可能为棘孢曲霉的繁殖提供了良好的碳源,从而使该真菌迅速繁殖,导致了花蕾的快速腐败并影响子房发育,这可能是该菌成为黄秋葵花蕾致病菌的原因之一。
黄秋葵的主要食用部位为嫩果,花期后5~7 d即可采收黄秋葵嫩果食用[25],在此期间营养品质最高[26]。由于采收期较短,因此对该病害的防治不宜喷洒农药及抗菌剂。从病害发生的环境条件及发病规律来看,该病主要发生在高温多雨季节,因此,可能是一种条件致病菌。如何降低病害的发生,减少病害的影响,是保障黄秋葵产量和品质的重要因素,因此本课题组下一步将对该病原菌的综合防治进行研究。
[1] 本刊通讯员. 油用植物黄秋葵[J]. 农业科技通讯,1975,5(3):30-40.
[2] Soares GSF, Assreuy AMS, Gadelha CAA, et al. Purification and biological activities ofAbelmoschusesculentusseed lectin [J]. Protein Journal, 2012, 31(8): 674-680.
[3] 王宏. 黄秋葵降血脂的功能与作用机理研究[D]. 广州:华南理工大学,2013.
[4] 李加兴,陈选,邓佳琴,等. 黄秋葵黄酮的提取工艺和体外抗氧化活性研究[J]. 食品科学,2014,35(10):121-125.
[5] Wang R, Liu Q, Wu Z, et al. Target-guided isolation of polar antioxidants fromAbelmoschusesculentus(L). Moench by high-speed counter-current chromatography method coupled with wavelength switching and extrusion elution mode[J]. J Sep Sci, 2016, 39(20): 3983-3989.
[6] 徐明. 黄秋葵种子中生物碱提取及抗疲劳活性的研究[D]. 长春:吉林农业大学,2014.
[7] Li YX, Yang ZH, Lin Y, et al. Antifatigue effects of ethanol extracts and polysaccharides isolated fromAbelmoschusesculentus[J]. Pharmacogn Mag, 2016, 12(47): 219-224.
[8] 徐天姿,单雪峰,孙炜,等. 黄秋葵黄酮抗小鼠运动性疲劳的作用及其机理研究[J]. 中华中医药学刊,2014,32(4):880-882.
[9] Carvalho CCCR, Cruz PA, Fonseca MMR, et al. Antibacterial properties of the extract ofAbelmoschusesculentus[J]. Biotechnology and Bioprocess Engineering, 2011, 16(5): 971-977.
[10]Mishra N, Kumar D, Rizvi SI. Protective effect ofAbelmoschusesculentusagainst Alloxan-induced Diabetes in Wistar Strain Rats[J]. J Diet Suppl, 2016, 13(6): 634-646.
[11]曹亮,周佳民,朱校奇,等. 黄秋葵种质资源、引种栽培及功效成分研究进展[J]. 中南药学,2012,10(9):695-697.
[12]Ali M, Hossain MZ, Sarker NC. Inheritance of Yellow Vein Mosaic Virus (YVMV) tolerance in a cultivar of Okra (Abelmoschusesculentus(L.) Moench)[J]. Euphytica, 2000, 111(3): 205-209.
[13]Kumar S, Singh V, Lakhanpaul S. Molecular characterization and phylogeny of phytoplasma associated with bunchy top disease in its new host Okra (Abelmoschusesculentus) in India reveal a novel lineage within the 16SrI group[J]. European Journal of Plant Pathology, 2012, 133(2): 371-378.
[14]Chandran SA, Packialakshmi RM, Subhalakshmi K, et al. First report of an alpha-satellite associated with Okra elation leaf curl virus[J]. Virus Genes, 2013, 46(3): 585-587.
[15]董迪,何自福,柴兆祥. 广东黄秋葵黄脉曲叶病样中检测到烟粉虱传双生病毒[J]. 植物保护,2010,36(1):65-68.
[16]窦传峰. 25%嘧菌酯悬浮剂防治黄秋葵疫病药效试验[J]. 现代农业科技,2011,6(6):176+182.
[17]周淑荣,郭文场,刘佳贺. 黄秋葵的病虫害防治[J]. 特种经济动植物,2015,17(1):51-54.
[18]陈杰,吴寒冰,潘龙金,等. 上海地区棉大卷叶螟在黄秋葵上的发生规律与绿色防控技术[J]. 中国蔬菜,2015,1(11):85-88.
[19]齐祖同.中国真菌志(第5卷) 曲霉属及其相关有性型[M]. 北京:科学出版社,1997.
[20] Suwannarangsee S, Arnthong J, Eurwilaichitr L, et al. Production and characterization of multi-polysaccharide degrading enzymes fromAspergillusaculeatusBCC199 for saccharification of agricultural residues[J]. Journal of Microbiology and Biotechnology, 2014, 24(10): 1427-1437.
[21]马迎迎,陈育如,张伟娜,等. 棘孢曲霉转化甜菊糖为甜菊醇及纯化莱鲍迪苷A[J]. 微生物学报,2014,54(1):62-68.
[22]何海燕,黎凤华,涂新凤,等. 棘孢曲霉利用蚕沙发酵产果胶酶的条件优化研究[J]. 中国食品添加剂,2015,22(3):92-96.
[23]Virgen-Ortíz JJ, Ibarra-Junquera V, Escalante-Minakata P, et al. Identification and functional characterization of a Fructo-oligosaccharides-Forming enzyme fromAspergillusaculeatus[J]. Appl Biochem Biotechnol, 2016, 179(3): 497-513.
[24]王耸,刘艳苓,姜泽东,等. 棘孢曲霉固态发酵柚皮产柚苷酶的条件优化[J]. 微生物学通报,2015,42(10):1936-1944.
[25]许如意,罗丰,袁廷庆,等. 不同采摘期对黄秋葵果实性状和品质的影响[J]. 长江蔬菜,2011,25(2):18-20.
[26]徐康. 采收期对黄秋葵果实品质及风味物质的影响[J]. 食品与发酵工业,2015,41(4): 207-211.

