克唑替尼耐药细胞H2228/CR对紫杉醇及顺铂的敏感性变化及机制
高海祥
(河北省人民医院,石家庄 050000)
克唑替尼耐药细胞H2228/CR对紫杉醇及顺铂的敏感性变化及机制
高海祥
(河北省人民医院,石家庄 050000)
目的 观察肺腺癌细胞H2228克唑替尼耐药前后对化疗药物紫杉醇和顺铂敏感性变化,并探讨其可能机制。方法 采用克唑替尼体外低浓度梯度递增联合大剂量间断冲击方法处理H2228细胞,培养克唑替尼耐药细胞株H2228/CR。MTT法检测克唑替尼、紫杉醇及顺铂对H2228及H2228/CR细胞的增殖抑制率;实时荧光定量PCR法和Western blotting法分别检测H2228及H2228/CR细胞波形蛋白、N-钙黏蛋白、E-钙黏蛋白的mRNA和蛋白表达。结果 经过6个月的培养,H2228/CR对克唑替尼明显耐药,且对紫杉醇及顺铂的敏感性降低。H2228/CR细胞E-钙黏蛋白mRNA及蛋白表达水平较亲代H2228细胞明显降低,而N-钙黏蛋白、波形蛋白的mRNA及蛋白表达水平较H2228细胞明显增高。结论 克唑替尼耐药细胞H2228/CR对常规化疗药物紫杉醇、顺铂敏感性降低,其耐药机制可能与H2228/CR细胞发生上皮间质转化有关。
非小细胞肺癌;耐药;克唑替尼;紫杉醇;顺铂
克唑替尼为美国国立综合癌症网络(NCCN)和欧洲肿瘤医学会(ESMO)推荐的治疗间变性淋巴瘤激酶(ALK)基因阳性非小细胞肺癌的首选药物[1~7]。但治疗过程中耐药的发生率高[4]。目前肺癌化疗后应用克唑替尼的报道较多,但克唑替尼耐药者对常规化疗药物敏感性的报道鲜见。本研究探讨耐克唑替尼的肺腺癌细胞对紫杉醇和顺铂的敏感性及其相关机制。
1 材料与方法
1.1 材料 细胞株:H2228细胞系(EML4-ALK融合基因阳性肺腺癌细胞)购于ATCC公司;药物及试剂:ALK抑制剂克唑替尼购自美国Sigma-Aldrich公司;RPMI 1640培养基、FBS、胰蛋白酶替代物以及MTT检测试剂购自于美国Gibco公司;鼠抗人波形蛋白单克隆抗、鼠抗人N-钙黏蛋白单克隆抗、鼠抗人E-钙黏蛋白单克隆抗购自美国Abcam公司;HRP标记抗鼠和兔的二抗、逆转录试剂盒、蛋白Marker购自美国Fementas公司。
1.2 H2228耐药细胞株建立 将解冻的肺腺癌H2228细胞株移至离心管中,添加完全培养液,吹打混匀,离心、去上清液,RPMI 1640培养基中加10%的FBS培养液重悬细胞,调整至合适的细胞密度并接种培养瓶中,放入37 ℃、5% CO2细胞培养箱中培养,次日更换一次培养液,PBS缓冲液清洗,0.25%胰蛋白酶消化传代。 采用体外低浓度梯度递增联合大剂量间断冲击方法。根据克唑替尼对细胞半数致死浓度(IC50),取其约80%浓度(80 nmol/L)起始作用H2228细胞,24 h后换液,PBS冲洗,胰酶消化细胞,根据细胞生长情况选择传代周期,持续低浓度诱导,液体每3天更换1次,并取相同浓度的克唑替尼在换液时继续加入,持续培养,待细胞生长稳定后,增加药物筛选浓度至160 nmol/L,以此类推,经过6个月的诱导培养,克唑替尼最终浓度增加至800 nmol/L时部分细胞形态由椭圆形变为纺锤形,细胞排列较松散;采用在该浓度克唑替尼中生长良好的细胞作为本次实验的耐药细胞株,命名为H2228/CR。
1.3 不同浓度克唑替尼、紫杉醇及顺铂对细胞增殖影响的观察 采用MTT法。收集对数生长期H2228及H2228/CR细胞,胰酶消化悬浮并计数,培养液稀释细胞悬液,接种到96孔板,每孔体积200 μL,每组细胞均设置空白调零孔(不含细胞的完全培养基)。于37 ℃、5%CO2培养箱中培养24 h。取出96孔板,吸去旧培养基,PBS液洗涤2次。采用0、12.5、25、50、100、200 nmol/L的克唑替尼干预H2228,采用0、800、1 600、2 000、4 000、8 000 nmol/L的克唑替尼干预H2228/CR;采用0、6.25、12.5、25、50、100 nmol/L的紫杉醇干预H2228及H2228/CR细胞;采用0、25、50、100、200、400 nmol/L的顺铂干预H2228及H2228/CR细胞,原条件培养44 h。取出孔板,每孔加MTT溶液(5 mg/mL)20 μL,继续孵育4 h,终止培养,每孔加150 μL DMSO,脱色摇床低速震荡10 min,溶解结晶物。采用酶联免疫监测仪检测各孔490 nm波长吸光度值(OD490);计算细胞增殖抑制率。细胞增殖抑制率=1-(实验组OD490值-空白调零组OD490值)/(阴性对照组OD490值-空白调零组OD490值)×100%。
1.4 细胞迁移能力检测 采用Transwell小室法。将Transwell小室置入无菌的24孔培养板中。将H2228及H2228/CR细胞分别用胰酶消化,用含0.1%血清的MCCOY′S 5A培养基悬浮,计数,稀释至密度为1×106/mL,每个上室中分别加入200 μL细胞悬液。24孔板下室中均加入600 μL含有30%新生牛血清的MCCOY′S 5A培养基。37 ℃,5%CO2培养箱中继续培养48 h后弃去孔中培养液,PBS清洗2遍,用4 ℃甲醛500 μL/孔加入下室进行固定30 min,用棉签轻轻擦掉上层未迁移细胞,再用0.1%甲紫500 μL染色20 min,用清水洗3遍以上。用200倍显微镜下随机5个视野观察细胞,计数并采集图像。
1.5 细胞波形蛋白、N-钙黏蛋白、E-钙黏蛋白mRNA表达检测 采用实时荧光定量PCR法。TRIzol法提取H2228及H2228/CR的总RNA,并将mRNA反转录为cDNA,参照公司的Realtime说明进行PCR扩增,反应程序为Stage1:预变性95 ℃ 2 min,热循环Stage2:95 ℃ 15 s,60 ℃ 60 s,进行40个循环。扩增完毕后,以GAPDH为内参照基因,目的基因与内参相比,得到目的基因表达的相对定量值(RQ值)。
1.6 细胞波形蛋白、N-钙黏蛋白、E-钙黏蛋白表达检测 采用Western blotting法。应用含有蛋白酶抑制剂的RIPA细胞裂解液裂解H2228及H2228/CR,低温离心机离心,提取上清即为总蛋白;采用BCA法测定蛋白质浓度;100 ℃水浴变性,按次序上样至电泳道,SDS-聚丙烯酰胺凝胶(SDS-PAGE)电泳并转印到PVDF膜上,将膜在含有一抗抗体封闭稀释液中,4 ℃静置孵育过夜。TBST洗膜3次,加入辣根过氧化物酶标记的二抗稀释液,室温下反应1~2 h或4 ℃反应过夜,再次TBST洗膜,增强化学发光法使蛋白条带发光并在X光片上曝光显影。

2 结果
2.1 不同浓度克唑替尼对H2228及H2228/CR细胞的抑制率 经过6个月的培养,H2228细胞可在800 nmol/L浓度的克唑替尼药物中生长,且细胞形态由椭圆形变为纺锤形,细胞排列较松散。12.5、25、50、100、200 nmol/L克唑替尼对H2228细胞的抑制率分别为(8.34±0.067)%、(21.27±0.060)%、(39.98±0.040)%、(53.89±0.041)%、(68.20±0.012)%;800、1 600、2 000、4 000、8 000 nmol/L克唑替尼对H2228/CR细胞的抑制率分别为(5.28±0.038)%、(19.28±0.054)%、(50.95±0.035)%、(76.26±0.024)%、(81.65±0.044)%;克唑替尼对H2228/CR细胞的抑制作用明显减弱,IC50从121.9 nmol/L升至2 618.45 nmol/L,即耐药增加了21.5倍。
2.2 不同浓度紫杉醇和顺铂对H2228及H2228/CR细胞的抑制率 紫杉醇及顺铂对H2228细胞的抑制作用呈浓度依赖性,IC50分别为16.71、60.36 nmol/L,对H2228/CR细胞株的抑制作用减弱,IC50分别为38.6、264.44 nmol/L。详见表1、2。

表1 不同浓度紫杉醇对H2228及H2228/CR细胞的抑制率

表2 不同浓度顺铂对H2228及H2228/CR细胞的抑制率
2.3 H2228及H2228/CR细胞迁移情况 H2228及H2228/CR细胞分别迁移(80.80±17.87)、(130.4±29.82)个,二者比较P<0.01;见插页Ⅰ图3。
2.4 H2228及H2228/CR细胞波形蛋白、N-钙黏蛋白、E-钙黏蛋白mRNA表达 H2228/CR细胞N-钙黏蛋白、波形蛋白mRNA表达明显高于,E钙黏蛋白表达明显低于H2228细胞(P<0.05或<0.01)。见表3。
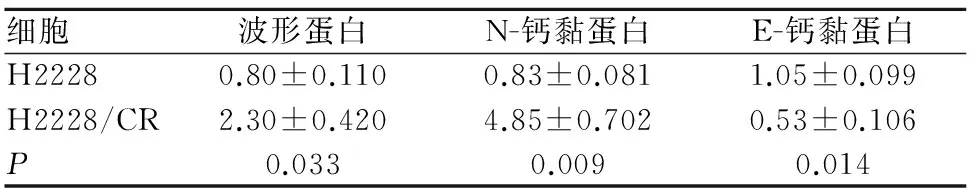
表3 H2228及H2228/CR细胞波形蛋白、N-钙黏蛋白、E-钙黏蛋白mRNA表达比较(RQ值)
2.5 H2228及H2228/CR细胞波形蛋白、N-钙黏蛋白、E-钙黏蛋白蛋白表达 H2228/CR细胞波形蛋白、N-钙黏蛋白表达明显高于,E-钙黏蛋白明显低于H2228细胞(P均<0.05)。见图1。

图1 H2228及H2228/CR细胞波形蛋白、N-钙黏蛋白、E-钙黏蛋白表达
3 讨论
肿瘤细胞耐药是肺癌治疗失败最常见的原因[9]。本研究结果显示, H2228/CR对紫杉醇及顺铂出现不同程度的耐药。进一步分析其耐药可能与耐药细胞株H2228/CR的细胞之间结构松散,且由椭圆形向梭形改变,细胞迁移及侵袭性增强有关,说明H2228/CR细胞可能出现了上皮间质转化(EMT)。EMT是指上皮细胞在特定的生理或病理情况下向间质细胞转化的现象,上皮细胞表型缺失及间质特性的获得是其主要特征。波形蛋白、N-钙黏蛋白是间质细胞的特征性分子学标记物,E-钙黏蛋白是上皮细胞的特征性分子学标记物, 通过调节这些分子标记物可诱发细胞发生上皮及间质之间的相互转化[10]。目前多项研究发现,肺癌细胞对多种抗肿瘤药物的耐药与肺癌细胞发生EMT相关[11~13]。本研究结果显示, H2228/CR细胞E-钙黏蛋白mRNA及其蛋白表达均明显低于H2228细胞,而N-钙黏蛋白、波形蛋白mRNA及其蛋白表达均明显高于H2228细胞,进一步从分子水平证实了耐药细胞发生了EMT。Kim等[12]研究发现,耐克唑替尼细胞发生了EMT;而应用siRNA抑制波形蛋白表达并逆转EMT后,耐药细胞部分恢复了对克唑替尼的敏感性。本研究H2228/CR细胞对常规化疗药物紫杉醇、顺铂均出现不同程度的耐药,与之前报道的相似;应用miR-200c转染耐克唑替尼细胞后发现,耐药细胞亦出现了EMT相反的过程,同时耐药程度减低。
综上所述,EMT是H2228细胞发生对克唑替尼、紫杉醇及顺铂耐药的原因,发生EMT的细胞其耐药是广泛的,包括对化疗药物及分子靶向药物的耐药。临床上ALK阳性肺癌患者首选分子靶向药物为克唑替尼,但后期可能出现肺癌细胞EMT从而对克唑替尼耐药并出现对紫杉醇和顺铂的交叉耐药,如果该患者再次接受包含以上化疗药物的治疗则受益程度会受到限制。今后的研究将针对延缓或逆转肺癌细胞EMT的发生进而延缓肿瘤细胞耐药的发生。
[1] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[2] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013,63(1):11-30.
[3] Shaw AT, Engelman JA. ALK in lung cancer: past, present, and future[J]. J Clin Oncol, 2013,31(8):1105-1111.
[4] Choi YL, Soda M, Yamashita Y, et al. EML4-ALK mutations in lung cancer that confer resistance to ALK inhibitors[J]. N Engl J Med, 2010,363(18):1734-1739.
[5] Sasaki T, Koivunen J, Ogino A, et al. A novel ALK secondary mutation and EGFR signaling cause resistance to ALK kinase inhibitors[J]. Cancer Res, 2011,71(18):6051-6060.
[6] Lindeman NI, Cagle PT, Beasley MB, et al. Molecular testing guideline for selection of lung cancer patients for EGFR and ALK tyrosine kinase inhibitors[J]. Arch Pathol Lab Med, 2013,137(6):828-860.
[7] Ettinger DS, Wood DE, Akerley W, et al. Non-small cell lung cancer, version 1. 2015[J].J Natl Compr Canc Netw, 2014,12(12):1738-1761.
[8] Toyokawa G, Seto T. Anaplastic lymphoma kinase rearrangement in lung Cancer: Its biological and clinical significance[J]. Respir Investig, 2014,52(6):330-338.
[9] Gower A, Wang Y, Giaccone G. Oncogenic drivers, targeted therapies, and acquired resistance in non-small-cell lung cancer[J]. J Mol Med, 2014,92(7):697-707.
[10] Lee JM, Dedhar S, Kalluri R, et al. The epithelial-mesenchymal transition: new insights in signaling, development, and disease[J]. J Cell Biol, 2006,172(7):973-981.
[11] Pattabiraman DR, Weinberg RA. Tackling the cancer stem cells-what hallenges do they pose[J]. Nat Rev Drug Discov, 2014,13(7):497-512.
[12] Kim HR, Kim WS, Choi YJ, et al. Epithelial-mesenchymal transition leads to crizotinib resistance in H2228 lung cancer cells with EML4-ALK translocation[J]. Mol Oncol, 2013,7(6):1093-1102.
[13] Kogita A, Togashi Y, Hayashi H, et al. Hypoxia induces resistance to ALK inhibitors in the H3122 non-small cell lung cancer cell line with an ALK rearrangement via epithelial-mesenchymal transition[J]. Int J Oncol, 2014,45(4):1430-1436.
·作者·编者·读者·
《山东医药》参考文献著录要求
每篇论文须标引参考文献10~20条。正文中引用的文献采用顺序编码制,以引用文献的先后顺序连续编码,并将序号置于方括号中。文后参考文献按GB/T7714-2005《文后参考文献著录规则》采用顺序编码制标注,序号置于方括号中,排列于文后。内部刊物、未发表资料、个人通信等请勿作为文献引用,确需引用时,可将其在正文相应处注明。引用文献(包括文字和表达的原意)务请作者与原文核对无误。日文汉字请按日文规定书写,勿与我国汉字及简化字混淆。参考文献中的作者前1~3名全部列出,3名以上只列前3名,后依文种加表示“,等”的文字。作者姓名一律姓氏在前,名字在后,外国人的名字采用首字母缩写姓氏,缩写名后不加缩写点;不同作者之间用“,”隔开。外文期刊名称用缩写,以Index Medicus中的格式为准;中文期刊用全名。论文题目后加文献类型及标识,如专著[M]、期刊文章[J]等。每条参考文献均须著录卷、期及起止页。作者必须自行核对参考文献原文,无误后将其按引用顺序(用阿拉伯数字)排列于文末。举例:
[1] 杜贾军,孟龙,陈景寒,等.手辅助电视胸腔镜食管切除胃食管胸内吻合术[J].山东医药,2004,44(27):1-3.
[2] Takano M, Mizuno K, Okamatsu K, et al. Mechanical and structural characteristics of vulnerable plaques: analysis by coronary angioscopy and intravascular ultrasound[J]. J Am Coll Cardiol, 2002,38(1):99-104.
[3] 叶任高,陆再英.内科学[M].5版.北京:人民卫生出版社,2000:277-280.
Changes of chemosensitivity of crizotinib-resistant cells H2228/CR to paclitaxel and cisplatin
GAOHaixiang
(HebeiGeneralHospital,Shijiazhuang050000,China)
Objective To observe the sensitivity changes of lung adenocarcinoma H2228 cells to paclitaxel and cisplatin before and after resistance to crizotinib, and to explore the molecular mechanism. Methods Crizotinib-resistant H2228/CR cells were induced by continuous stepwise exposure to crizotinib combined with pulse therapy in vitro. MTT assay was used to measure the growth inhibition ratio of H2228 and H2228/CR cells treated with different concentrations of crizotinib, paclitaxel and cis-platinum. Real-time fluorescence quantification PCR and Western blotting were used to measure the mRNA and protein expression of Vimentin, N-cadherin and E-cadherin in H2228 and H2228/CR cells. Results After being cultured for 6 months, H2228/CR cell displayed significantly resistance to crizotinib and its resistance to paclitaxel and cisplatin was decreased. The mRNA and protein expression of E-cadherin was decreased in H2228/CR cells as compared with that of the parental cell line H2228, while the mRNA and protein expression of N-cadherin and Vimentin was increased in H2228/CR cells. Conclusion The crizotinib-resistant H2228/CR cells decrease sensitivity to standard chemotherapeutic drugs paclitaxel and cisplatin, which may be associated with the epithelial-mesenchymal transition of H2228/CR cells.
non-small-cell lung cancer; drug resistance; crizotinib; paclitaxel; cisplatin
河北省医学科学研究重点课题计划(20160065)。
高海祥(1979-),男,博士,主治医师,研究方向为呼吸系统肿瘤、呼吸系统感染性疾病。E-mail: gaohaixiang0801@163.com
10.3969/j.issn.1002-266X.2017.04.005
R979.1
A
1002-266X(2017)04-0025-04
2016-03-18)

