HBV不同感染状态者血清IL-21、IFN-γ水平变化及其临床意义
王驭风,钱卫,夏澍
(盐城市第三人民医院,江苏盐城224021)
HBV不同感染状态者血清IL-21、IFN-γ水平变化及其临床意义
王驭风,钱卫,夏澍
(盐城市第三人民医院,江苏盐城224021)
目的 探讨不同HBV感染状态者血清IL-21、IFN-γ水平变化及其临床意义。方法 选择HBV感染者74例,根据感染状态分为急性乙肝组15例、慢性HBV携带组17例、慢性乙肝组23例、非活动性HBsAg携带组19例,另选体检健康者20例作为对照组。采用酶联免疫吸附法检测各组血清IL-21、IFN-γ。结果 急性乙肝组血清IL-21、IFN-γ水平明显高于对照组、慢性HBV携带组、慢性乙肝组和非活动性HBsAg携带组(P均<0.05);慢性乙肝组血清IL-21水平明显高于慢性HBV携带组(P<0.05),对照组、慢性HBV携带组、慢性乙肝组和非活动性HBsAg携带组血清IFN-γ水平组间比较均无统计学差异(P均>0.05)。对照组、急性乙肝组、慢性HBV携带组、非活动性HBsAg携带组血清IL-21与IFN-γ水平均呈正相关(r分别为0.896、0.734、0.693、0.701,P均<0.05),慢性乙肝组血清IL-21与IFN-γ水平无相关性(r=0.359,P>0.05)。结论 血清IL-21和IFN-γ水平可反映HBV感染状态,可作为判断乙肝严重程度的指标。
乙型肝炎病毒感染;白介素21;γ干扰素;发病机制
HBV感染是一个严重的公共卫生问题。据统计,全世界人口中约1/3曾感染HBV,每年约有100万人死于HBV感染所致的疾病[1]。HBV感染慢性化是由病毒本身和宿主免疫状态共同决定的,其中宿主免疫状态是决定HBV感染转归的关键[2]。在急性自限性HBV感染者体内,T细胞介导的免疫反应强烈,可控制和清除病毒,防止宿主再次发生感染;而慢性HBV感染者体内相应T细胞反应缺失,T细胞数量和功能降低,是导致HBV感染慢性化的重要原因[3]。IL-21是由活化的CD4+T细胞分泌的细胞因子,可促进CD8+T细胞增殖并强化其细胞应答反应,而CD4+T细胞辅助CD8+T细胞在控制HBV感染慢性化过程中发挥重要作用[4]。2014年1月~2016年1月,我们观察了HBV感染不同状态者外周血IL-21、
IFN-γ水平及CD4+T细胞、CD8+T细胞在HBV感染慢性化过程中的变化。现分析结果并探讨其机制。
1 资料与方法
1.1 临床资料 同期选择我院收治的HBV感染者74例,其中急性乙肝患者15例(急性乙肝组),男9例、女6例,年龄(48.82±9.53)岁;慢性HBV携带者17例(慢性HBV携带组),男12例、女5例,年龄(49.13±10.62)岁;慢性乙肝患者23例(慢性乙肝组),男15例、女8例,年龄(47.91±8.64)岁;非活动性HBsAg携带者19例(非活动性HBsAg携带组),男13例、女6例,年龄(48.78±8.39)岁。所有患者符合《慢性乙型肝炎防治指南》(2010年版)中的诊断标准[5]:急性乙肝:无乙肝病史,HBsAg阳性,血清HBcAg-IgM阳性,血清ALT、 总胆红素升高或正常;慢性HBV携带:血清HBcAb、HBeAg、HBsAg和HBV-DNA阳性,肝功能检测指标正常,肝脏B超未见异常;慢性乙肝:血清HBcAb、HBeAg、HBsAg和HBV-DNA阳性,ALT持续升高,乙肝病程超过半年;非活动性HBsAg携带[6,7]:血清HBsAg阳性、HBeAg阴性、抗HBe阳性或阴性,HBV DNA检测不到(PCR法)或低于最低检测限,1年内连续随访3次以上,ALT均在正常范围。排除标准:合并甲肝、丙肝、丁肝、戊肝者;有遗传性肝病、胆汁淤积性肝病和自身免疫性肝炎者;入组前6个月接受过抗HBV和免疫调节治疗者。选择同期在我院体检健康者20例(对照组),男13例、女7例,年龄(46.8±9.2)岁。各组性别、年龄具有可比性。各组血清ALT、AST水平及乙肝五项检测结果见表1、2。本研究经医院伦理委员会批准,患者均知情同意。
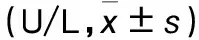
表1 各组血清ALT、AST水平比较
注:与对照组比较,*P<0.05;与急性乙肝组比较,#P<0.05;与慢性HBV携带组比较,△P<0.05;与慢性乙肝组比较,▲P<0.05。

表2 各组乙肝五项检测结果(例)
1.2 血清IL-21、IFN-γ检测 各组均采集晨起空腹静脉血5 mL,3 500 r/min离心10 min,分离血清,-20 ℃冰箱保存。采用双抗体夹心ELISA法检测IL-21、IFN-γ。ELISA试剂盒购于上海恒远生物有限公司,严格按照试剂盒说明操作[6]。分析不同HBV感染状态者血清IL-21与IFN-γ的关系。

2 结果
急性乙肝组血清IL-21、IFN-γ水平显著高于慢性HBV携带组、慢性乙肝组和非活动性HBV携带组(P均<0.05);慢性HBV携带组和慢性乙肝组血清IL-2、IFN-γ水平显著低于急性乙肝组;见表3。Pearson直线相关分析显示,对照组、急性乙肝组、慢性HBV携带组、非活动性HBsAg携带组血清IL-21与IFN-γ水平均呈正相关(r分别为0.896、0.734、0.693、0.701,P均<0.05);而慢性乙肝组血清IL-21与IFN-γ水平无相关性(r=0.359,P>0.05)。

表3 各组血清IL-21、IFN-γ水平比较
注:与对照组比较,*P<0.05;与急性乙肝组比较,#P<0.05;与慢性HBV携带组比较,△P<0.05。
3 讨论
HBV感染的临床表现呈多样性。HBV感染是乙型肝炎疾病进展的始发因素,HBV感染后患者的免疫因素在病毒清除、持续感染及肝细胞损伤过程中有重要作用,但其免疫作用机制仍不十分明确。一般认为HBV感染机体后的免疫应答反应(主要是CD4+T细胞和CD8+T细胞参与的免疫机制引起肝细胞的损伤)可影响疾病的演进及转归过程[7,8]。
CD8+T细胞是HBV感染模型中清除病毒最主要的效应T细胞,感染早期由HBV刺激产生的特异性CD8+T细胞具有一定的抗病毒作用,且CD8+T细胞的生成需要活化的HBV相关CD4+T细胞辅助,而慢性HBV感染患者体内往往出现CD4+T细胞功能耗竭[11]。有研究发现,HBV合并HCV感染者CD4+T细胞、CD8+T细胞相互作用共同起到清除病毒作用,故提高慢性HBV感染患者体内CD4+T细胞和CD8+T细胞数量、恢复其功能以达到清除HBV是乙肝治疗的理想终点[12]。
IL-21是2000年发现的一种细胞因子,由活化的CD4+T细胞分泌,在自身免疫性疾病、肿瘤性疾病及控制病毒感染过程中发挥重要作用。有研究证实,IL-21能够促进CD3抗体活化的胸腺细胞,成熟外周血T细胞的增殖,可通过增强CD8+T细胞的活化、增殖促进功能耗竭的CD8+T细胞对病毒的控制,显著提升CD8+T细胞功能,促进B细胞分泌抗体,继而有效清除病毒[13~15],IL-21水平与HBc18~27特异性的产IFN-γ的CD8+T细胞相关,IL-21可维持CD8+T细胞的抗病毒作用。另有研究发现,在一定程度上病情严重程度与Th17细胞是否处于功能活跃状态呈正相关,Th17细胞是重要的IL-21分泌细胞,可通过IL-21产生相应的免疫效应,在HBV感染炎症损伤严重的重度慢性乙肝的发病机制中起重要作用,在慢加急性肝功能衰竭中较高水平的IL-21可以活化T细胞或B细胞清除病毒感染或通过释放炎性因子损伤肝细胞,也可通过活化肝星状细胞影响HBV感染相关的肝损伤,因此中和IL-21可能是治疗HBV感染相关肝损伤的有效措施。本研究急性乙肝组血清IL-21水平显著高于慢性HBV携带组、慢性乙肝组、非活动性HBsAg携带组和对照组,表明IL-21在急性HBV感染患者体内发挥了促进机体抗病毒免疫反应的作用。本研究HBV携带组(即免疫耐受期患者)血清IL-21水平显著降低,提示IL-21表达降低在HBV感染慢性化中发挥重要作用,慢性乙肝患者体内存在CD4+T细胞功能降低、数量减少,无法发挥其免疫增强功能,抗病毒能力受到抑制[16]。IFN-γ是重要的抗病毒免疫调节细胞因子,其除可通过调节机体免疫反应来抑制HBV的合成外,还可通过非溶细胞机制直接抑制HBV复制。在转基因小鼠的试验中,CD8+T细胞、Th细胞和NK细胞在识别HBV的病毒抗原后会通过分泌IFN-γ抑制肝脏中的HBV复制。Suri等[17]研究发现,IFN-γ除能通过调节机体免疫反应抑制HBV的转录和复制外,还能通过非细胞溶解/损伤机制直接抑制肝细胞内HBV的复制[18]。本研究急性乙肝组血清IFN-γ水平明显高于HBV携带组和非活动性HBsAg携带组,IFN-γ水平变化呈现急性乙肝组>慢性乙肝组>HBV携带组的趋势,与以往研究报道相似。
本研究还发现,IL-21和IFN-γ在不同HBV感染者体内具有良好的相关性,其原因可能为IL-21主要由CD4+T细胞分泌,能促进CD8+T细胞增殖并且强化CD8+T细胞抗病毒功能,而IFN-γ是CD8+T细胞功能活化的指标,可以反映CD8+T细胞功能,CD4+T细胞活化产生大量IL-21,从而促进了CD8+T细胞的抗病毒能力。
综上所述,血清IL-21和IFN-γ水平可反映HBV感染状态,可作为判断乙肝病情严重程度的指标。
[1] 李彩东,陈锡莲,李惠军,等.慢性HBV感染者血清IL-15和IL-16水平与HBVDNA载量的关系及临床意义探讨[J].实用肝脏病杂志,2015,18(6):663-664.
[2] 梁艳,王皓,仲人前.T淋巴细胞和NK细胞在慢性乙型肝炎病毒感染中的作用[J].检验医学,2014,29(1):4-9.
[3] 成利伟,孔歌,李莉,等.慢性乙型肝炎患者PBMC中HBV特异性IL-21表达及其对CD8+T淋巴细胞功能的影响[J].肝脏,2014,19(4):246-249.
[4] 杨晨辰,黄睿,刘勇,等.慢性HBV感染者不同免疫状态下及抗病毒治疗后外周血T细胞亚群比例和细胞因子水平特点[J].中华实验和临床感染病杂志电子版,2014,8(2):35-40.
[5] 李彩东,杨勇卫,李惠军,等.乙型肝炎病毒携带者外周血IFN-γ、IL-32和IL-6的变化及临床相关性[J].国际检验医学杂志,2015,36(18):2622-2624.
[6] 成利伟,孔歌,李莉,等.慢性乙型肝炎患者PBMC中HBV特异性IL-21表达及其对CD8+T淋巴细胞功能的影响[J].肝脏,2014,19(4):246-249.
[7] Ma SW, Huang X, Li YY, et al. High serum IL-21 levels after 12weeks of antiviral therapy predict HBeAg seroconversion in chronic hepatitis B[J]. J Hepatol, 2012,56(4):775-781.
[8] Yu S, Jia L, Zhang Y, et al. IL-12 induced the generation of IL-21-and IFN-γ-co-expressing poly-functional CD4+T cells from human naive CD4+T cells[J]. Cell Cycle, 2015,14(21):3362-3372.
[9] He D, Li M, Guo S, et al. Expression pattern of serum cytokines in hepatitis B virus infected patients with persistently normal alanine aminotransferase levels[J]. J Clin Immunol, 2013,33(7):1240-1249.
[10] Ren G, Esser S, Jochum C, et al. Interleukin 21 augments the hepatitis B virus-specific CD8+T-cell response in vitro in patients coinfected with HIV-1[J]. Aids, 2012,26(17):2145-2153.
[11] Zeng Z, Kong X, Li F, et al. IL-12-based vaccination therapy reverses liver-induced systemic tolerance in a mouse model of hepatitis B virus carrier[J]. J Immunol, 2013,191(8):4184-4193.
[12] Hsu CS, Hsu SJ, Liu WL, et al. IL-21R gene polymorphisms and serum IL-21 levels predict virological response to interferon-based therapy in Asian chronic hepatitis C patients[J]. Antiviral Therapy, 2013,18(4):599-606.
[13] Yang B, Wang Y, Zhao C, et al. Increased Th17 cells and interleukin-17 contribute to immune activation an4d disease aggravation in patients with chronic hepatitis B virus infection[J]. Immunol Lett, 2013,149(1-2):41-49.
[14] Wong GL, Chan HL, Chan HY, et al. Serum interferon-inducible protein 10 levels predict hepatitis Bs antigen seroclearance in patients with chronic hepatitis B[J]. Aliment Pharmacol Ther, 2016,43(1):145-153.
[15] Schmitz I, Schneider C, Fröhlich A, et al. IL-21 restricts virus-driven Treg cell expansion in chronic LCMV infection[J]. PLoS One, 2013,9(5):e10033624.
[16] Liu Y, Zhao P, Qu Z, et al. Frequency of CD4+CXCR5+, TFH cells in patients with hepatitis b virus-associated membranous nephropathy[J]. Int Immunopharmacol, 2014,22(1):98-106.
[17] Suri H, Ren W, Ma W, et al. Interleukin-21 responses in patients with chronic hepatitis B[J]. J Interferon Cytokine Res, 2014,35(2):134-142.
[18] Li L, Jiang Y, Lao S, et al. Mycobacterium tuberculosis-specific IL-21+IFN-γ+CD4+T cells are regulated by IL-12[J]. PLoS One, 2016,11(1):e0147356.
10.3969/j.issn.1002-266X.2017.04.024
R512.6
B
1002-266X(2017)04-0071-03
2016-06-24)

