牦牛乳乳糖酶解及其预热处理条件优化
管声,梁琪*,宋雪梅,黄绍海,张炎,文鹏程
1(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070)2(甘肃省功能乳品工程实验室,甘肃 兰州,730070) 3(甘肃雪顿牦牛乳业股份有限公司,甘肃 兰州,730050)
牦牛乳乳糖酶解及其预热处理条件优化
管声1,2,梁琪1,2*,宋雪梅1,2,黄绍海3,张炎1,2,文鹏程1,2
1(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070)2(甘肃省功能乳品工程实验室,甘肃 兰州,730070) 3(甘肃雪顿牦牛乳业股份有限公司,甘肃 兰州,730050)
针对牦牛乳热处理和乳糖酶解问题,采用夏河鲜牦牛乳为原料,以乳糖水解速率(V0)和微生物数量为评价指标,探究牦牛乳乳糖酶解预热处理参数,并以乳糖水解率为目标对酶解条件进行优化。结果表明:牦牛乳经适宜条件热处理能明显增强外源乳糖酶酶解活性,65 ℃热处理5 min后酶解乳糖,V0升高49.0%。结合实际生产需求,乳糖酶解前对牦牛乳分别进行高温短时和低温长时巴杀处理,确定预热处理参数为85 ℃,13 s;优化得到酶解条件为:酶解温度39 ℃,酶解时间2.4 h,酶添加量2.4 u/mL,乳糖水解率达(79.7±0.9)%,相比未经热处理牦牛乳中同等条件,酶解率升高11.2%~14.0%,且水解率达标(≥70%)时间缩短0.75 h。
牦牛乳;热处理;乳糖;酶解;优化
牦牛乳是青藏高原独特的优质乳源,蛋白质、脂肪、矿物质等营养成分含量均高于普通牛乳,乳糖平均含量为5.03%,较荷斯坦牛乳高约10%[1-2]。我国是乳糖不耐症人群大国,健康成年人乳糖不耐受率为92%,儿童乳糖不耐症发生率也高达30%以上[3],但国内乳品工业中液态白乳低乳糖化率极低,优质乳源在传统加工中未能发挥其优势和价值,因此,探索牦牛乳低乳糖化技术,提升其营养价值,发挥青藏高原地区牦牛乳优质潜力极为重要。
酶水解法是目前牛乳低乳糖化最常用的方法[4-5]。荷斯坦牛乳低乳糖化过程中蛋白组成、含量[6]以及金属离子环境[7]等因素对外源乳糖酶酶解活性影响显著。牦牛乳中酪蛋白含量及其胶束结构以及乳球蛋白、Mg2+、Ca2+、Mn2+、Na+、K+等成分含量与荷斯坦牛乳间差异[8-9]所导致的二者加工特性不容忽视。
作为液态乳加工中不可或缺的关键环节,热处理过程会导致原料乳发生一系列物理化学变化,例如形成不溶性复合物而产生盐析,蛋白质发生降解或与其他组分反应等[10-11],上述变化很可能对乳糖酶解过程产生影响。本试验以甘肃夏河藏区鲜牦牛乳为原料,探究热处理对外源乳糖酶酶解活性的影响,并以乳糖水解速率(V0)为纽带将原料乳热处理与酶解乳糖过程相联系,确定牦牛乳乳糖酶解预热处理参数,并在此基础上,对乳糖酶解条件进行了优化。
1 材料与方法
1.1 材料与仪器
鲜牦牛乳采自甘南夏河健康牦牛;鲜荷斯坦牛乳采自甘肃农业大学奶牛场;β-半乳糖苷酶(来源于乳酸克鲁维酵母3 000 u/g)哈尔滨美华生物科技公司;其他试剂均为国产分析纯。
NRY200恒温摇床,上海南荣实验室设备有限公司;AL204电子天平,梅特勒-托利多仪器(上海)有限公司;HWS26 电热数显恒温水浴锅,上海-恒科科技有限公司;SP-754C紫外可见分光光度计,上海光谱仪器有限公司;GZX-GF101 电热恒温鼓风干燥箱,上海跃进医疗器械有限公司;PHS-3C型pH计,上海仪电科学仪器股份有限公司。
1.2 实验方法
1.2.1 牦牛乳热处理对外源乳糖酶酶解活性的影响
取鲜牦牛乳30 mL,分别在65、75、85 ℃下热处理5 min后迅速降温至38 ℃,添加乳糖酶(1 u/mL)进行恒温酶解,并测定乳样中前20 min内每10 min葡萄糖生成量,以葡萄糖增量即乳糖水解速率(V0)大小判定乳糖酶酶解活性。终止酶解反应时,向乳中加入等体积12% TCA溶液[12]。相同处理条件下,荷斯坦牛乳为对照组。
1.2.2 牦牛乳乳糖酶解预热处理参数确定
取30 mL鲜牦牛乳,其他条件不变,分别考察温度(70~85 ℃)和时间(8~23s)条件下热处理对乳中微生物数量及乳糖水解速率(V0)的影响,确定最佳预热处理参数。
1.2.3 牦牛乳乳糖酶解单因素试验
取30 mL鲜牦牛乳,热处理后迅速降至预定温度,无菌添加乳糖酶,固定其他因素,分别探究酶解温度、酶解时间、酶添加量对乳糖水解率的影响;由于乳糖酶最适pH6.5与牦牛乳pH非常接近[13],故不进行pH优化。
1.2.3.1 酶解温度对乳糖水解率的影响
酶添加量为2 u/mL,酶解时间为2.5 h,在酶解温度分别为28、33、38、43、48 ℃条件下测定乳糖水解率。
1.2.3.2 酶解时间对乳糖水解率的影响
酶解温度为38 ℃,酶添加量为2 u/mL,酶解1.0、1.5、2.0、2.5、3.0 h后测定乳糖水解率。
1.2.3.3 酶添加量对乳糖水解率的影响
酶解温度为38 ℃,酶解时间为2.5 h,酶添加量分别为0.5、1.0、1.5、2.0、2.5 u/mL条件下测定乳糖水解率。
1.2.4 响应面优化试验设计
根据单因素试验结果,依照Box-Benhnken中心组合试验设计原理,以A(温度)、B(时间)和C(E/S)为自变量,进行乳糖酶解条件优化。试验因素与水平设计见表1。

表1 响应面试验因素水平表
1.2.5 测定方法
葡萄糖含量:参照GB/T 16285—2008《食品中葡萄糖的测定》;菌落总数:参照GB4789.2—2010《食品微生物学检测菌落总数测定》;乳糖水解率:参照碘量法[14]测定;乳糖含量:参照SN/T 0871—2012《出口乳及乳制品中乳糖的测定方法》。
1.2.6 数据处理
利用Design Expert 8.0.6软件和SPSS 20.0软件对试验数据进行分析处理。
2 结果分析
2.1 牦牛乳热处理对外源乳糖酶酶解活性的影响
由图1可知,牦牛乳与荷斯坦牛乳经65、75、85 ℃热处理5 min后,乳糖水解速率V0均升高,牦牛乳中V0增量(26.5%~49.0%)约为荷斯坦牛乳V0增量(9.0%~18.0%)的3倍,说明不同乳源牛乳热处理对外源乳糖酶的激活效应存在差异,且牦牛乳中该效应表现更为显著,65 ℃热处理5 min后V0可达1.46 μmolglucose/(mL·min)。JIMÉNEZ等[12]发现,此激活效应主要是由于乳清蛋白尤其是β-乳球蛋白受热变性释放出大量活性巯基所致。同时,经方差分析表明,热处理程度对牦牛乳V0影响显著(P<0.05)。以上结果表明,酶解乳糖前,对牦牛乳采取预热处理,可以有效提高乳糖酶解效率。

图1 热处理对荷斯坦牛乳和牦牛乳中乳糖水解速率(V0)的影响Fig.1 The effect of heating on the lactose hydrolysis rate (V0) of holstein and yak milk
2.2 牦牛乳乳糖酶解预热处理方式的确定
目前液态乳常用热处理方式主要有预热杀菌、巴氏杀菌、超巴氏杀菌和UHT灭菌4种[15]。从保护牦牛乳营养成分和感官品质考虑,本试验选择如表2所示的不同条件巴氏杀菌进行牦牛乳预热处理。

表2 不同形式巴氏热处理对牦牛乳乳糖水解
研究显示,原料乳经低温长时和高温短时巴氏杀菌后酶解乳糖,乳糖水解速率V0无显著差异(P>0.05),但相比原料乳有显著升高(P<0.05)。结合实际生产需求,选择高温短时巴杀作为牦牛乳乳糖酶解预热处理方式。
2.3 牦牛乳乳糖酶解预热处理参数的确定
不同热处理条件下,乳中微生物数量变化如表3所示。经方差分析表明,热处理温度和时间对微生物数量影响显著(P<0.05)。70、75、80、85 ℃下持续8 s,均可使菌落总数符合我国巴氏乳安全标准[16]。

表3 不同热处理条件下微生物数量(对数值)的变化情况
原料乳经不同条件巴杀处理后酶解乳糖,V0变化如图2。单因素方差分析显示,热处理时间和温度对V0均影响显著(P<0.05)。在较短热处理时间内,V0随热处理强度增大,呈上升趋势,85 ℃热处理13 s时V0达最大,为1.51 μmolglucose/(mL·min),原因是乳清蛋白变性程度随热处理温度升高而增大[17],在较高温度(85 ℃)下乳清蛋白完全变性,释放出大量活性巯基使乳糖酶活力明显被激活[12]。延长热处理时间,V0呈下降趋势,这可能是由于变性乳清蛋白与酪蛋白胶粒开始发生聚合,使得乳中活性巯基浓度下降,酶激活效应减弱[18]。因此,在乳中菌落总数符合我国巴氏乳安全标准[16]前提下,85 ℃、13 s更适宜作为乳糖酶解预热处理参数。
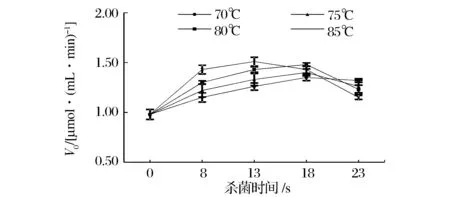
图2 不同条件热处理对乳糖水解速率(V0)的影响Fig.2 The effect of different conditions of heat treatments on the lactose hydrolysis rate(V0)
2.4 牦牛乳乳糖酶解单因素试验
2.4.1 温度对乳糖水解率的影响
由图3可知,当酶解温度由28 ℃升高到38 ℃乳糖水解率呈增大趋势。这是因为,在乳糖酶最适温度以下升高温度可有效促进酶分子运动,增强与乳糖结合能力,促使水解率不断升高[19]。大于38 ℃,随着温度上升,水解率快速下降,这是由于,温度过高使乳糖酶失去部分活性,不能充分酶解乳糖。因此,确定乳糖酶解最适温度为38 ℃。

图3 温度对乳糖水解率的影响Fig.3 The effect of different temperatures on the lactose hydrolysis
2.4.2 时间对乳糖水解率的影响
由图4可知,随着酶解时间延长,β-半乳糖苷酶与乳糖反应愈加充分,使得水解率不断上升。酶解2.5 h,水解率>70%,可以满足乳糖不耐症患者需求[20]。过度延长酶解时间,会延长生产周期,也可能增加原料乳受污染风险,酶解时间以2.5 h为佳。

图4 水解时间对乳糖水解率的影响Fig.4 The effect of time on the lactose hydrolysis
2.4.3 酶添加量对乳糖水解率的影响

图5 酶添加量对乳糖水解率的影响Fig.5 The effect of enzyme concentration on the lactose hydrolysis rate
由图5可知,当酶添加量由0.5 u/mL增大至2 u/mL,水解率呈显著(P<0.05)上升趋势。因为酶用量增大过程中,酶分子同底物结合几率增大,水解率增大。当酶添加量大于2 u/mL后,水解率趋于稳定(P>0.05)。因为酶添加量较大时,酶分子已经结合了底物的大部分酶切位点,继续增加酶用量对酶解反应的贡献减弱。从提高乳糖酶利用率考虑,确定酶添加量为2 u/mL,此时,水解率为76.3%。
2.5 响应面优化牦牛乳乳糖酶解条件
2.5.1 响应面优化设计及试验结果
根据Box-Behnken设计原理,进行17组乳糖酶解试验,结果见表4。利用Design Expert 8.0.6软件对所得数据进行回归分析,得到二次多项回归方程:
Y=76.44+1.55A+1.88B+4.75C+2.15AB+2.25AC-0.50BC-9.25A2-1.35B2-0.69C2。
2.5.2 回归模型的建立和分析

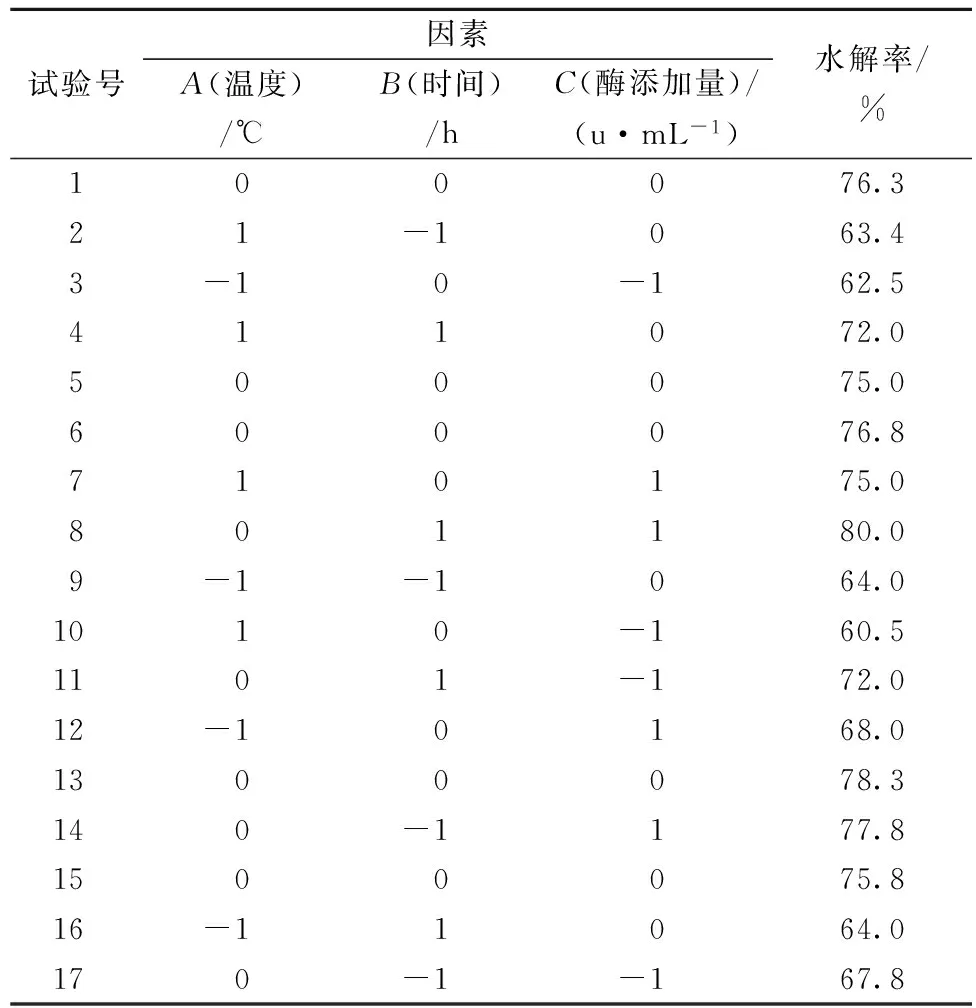
表4 响应面优化设计及试验结果
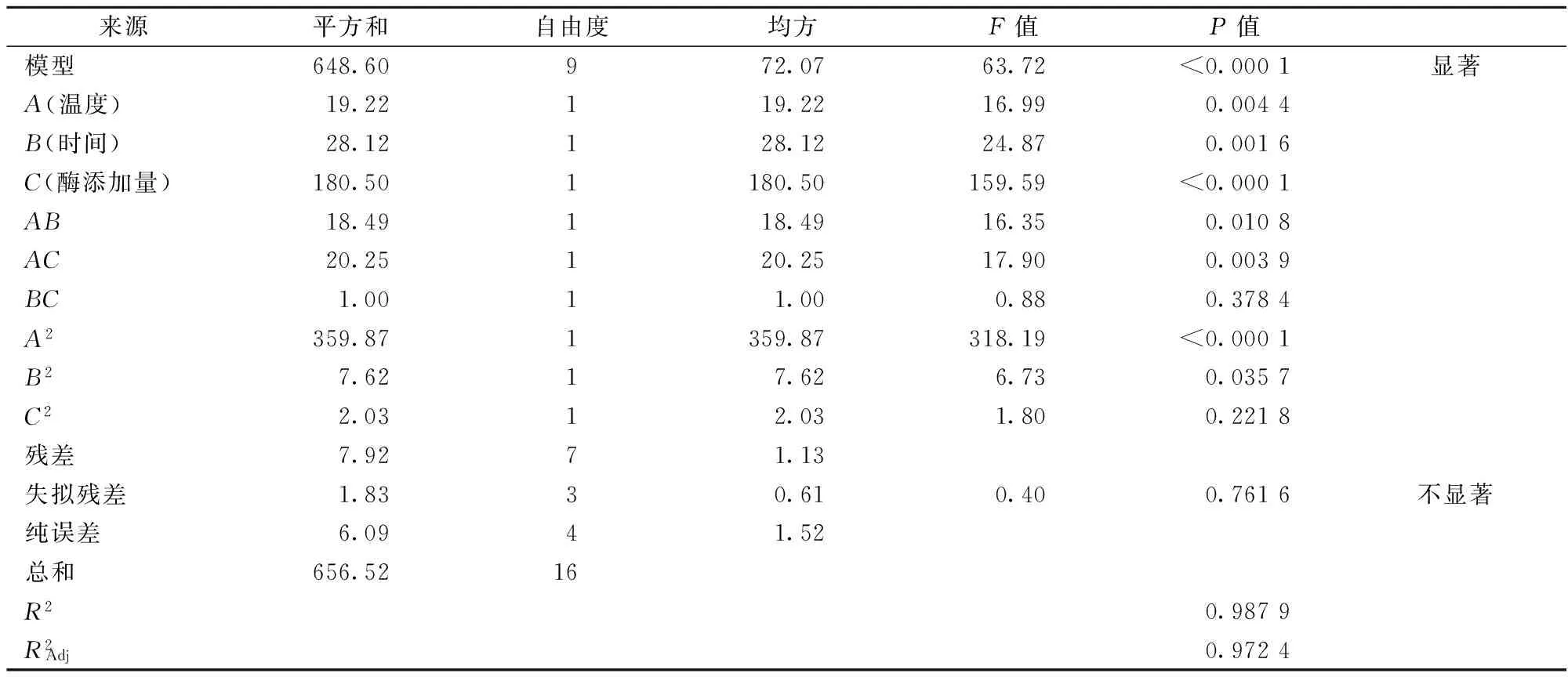
表5 乳糖水解率回归模型方差分析表
2.5.3 回归模型的验证
牦牛乳乳糖酶解最优条件为:温度38.81 ℃、时间2.44 h、酶添加量2.44 u/mL。此条件下,预测水解率达80.2%。根据实际试验条件修订酶解条件为:温度39 ℃、时间2.4 h、酶添加量2.4 u/mL,并进行验证试验(n=3)测得乳糖水解率为(79.7±0.9)%,与预测值非常接近,说明该试验模型可行性较高,优化结果可靠。
2.6 优化工艺验证试验
牦牛乳热处理(85 ℃,13 s)前后,测定乳糖酶解反应底物(乳糖)和产物(葡萄糖)含量。如表6所示,热处理牦牛乳中乳糖含量与原料乳中相当,二者葡萄糖含量均可忽略(<0.01 g/100mL),表明适宜条件热处理对牦牛乳中乳糖无直接影响。这与MESSIA[21]等关于低乳糖荷斯坦牛乳生产加工特性的研究结果相似。

表6 预热处理对牦牛乳中乳糖与葡萄糖含量影响

表7 热处理乳与原料乳中乳糖水解效果比较
从表7可知,以本试验所得最佳条件酶解未经热处理牦牛乳中乳糖,测得乳糖水解率为(67.1±0.5)%,相比热处理乳(85 ℃、13 s)水解率低约11.2%~14.0%。该差异值也高于GREENBERG[22]与KOSIKOWSKI[23]报道的巴氏杀菌处理对荷斯坦牛乳乳糖水解率提升量(5.0%~8.0%)。为进一步客观评价该优化工艺,根据低乳糖乳制品需求[22],本试验设定目标水解率为70%,同等酶解条件(酶添加量2.4 u/mL,酶解温度39 ℃)下,未经热处理牦牛乳乳糖水解率≥70%至少需要2.65 h,然而,按照本试验优化工艺进行酶解处理,仅需 1.9 h,比前者用时缩短0.75 h,显著提高了乳糖酶解环节生产效率。
3 讨论
研究结果表明,乳糖水解速率较乳糖水解率能更加客观、准确地反映出外源乳糖酶在牦牛乳中活性表现情况。牦牛乳经热处理后酶解乳糖,乳糖水解速率最大时外源乳糖酶酶解活性表现最强,说明此热处理乳更适宜进行乳糖酶解。作为乳糖酶解效果的直观表现,以乳糖水解率作为指标优化乳糖酶解条件,更加贴近实际生产需求。同时,通过优化工艺验证试验将牦牛乳经适宜热处理后乳糖水解速率(V0)增量有效转换为更贴近实际生产的衡量指标——乳糖水解率与水解率达标(≥70%)时间,实现了整体研究评价标准的回归与统一。
4 结论
牦牛乳热处理对外源乳糖酶酶解活性具有显著激活效应,85、75、65 ℃热处理5 min后酶解乳糖,乳糖水解速率增量达26.5%~49.0%,约为荷斯坦牛乳3倍。依照实际生产条件,优化牦牛乳乳糖酶解预热处理参数为85 ℃,13 s,乳糖酶解条件为:温度39 ℃,时间2.4 h,酶添加量2.4 u/mL,乳糖水解率可达(79.7±0.9)%。验证试验发现,较未热处理牦牛乳中同等条件酶解乳糖,此优化工艺显著提高了乳糖酶解效率,有效缩短了酶解时间。
[1] SHENG Qing-hai,LI Jian-cai,ALAM M S,et al.Gross composition and nutrient profiles of Chinese yak (Maiwa) milk[J].International Journal of Food Science & Technology,2008,43(3):568-572.
[2] LI Hai-mei,MA Ying,LI Qi-ming,et al.The chemical composition and nitrogen distribution of Chinese yak (Maiwa) milk[J].International Journal of Molecular Sciences,2011,12(8):4 885-4 895.
[3] YANG Yue-xin,HE Mei,CUI Hong-mei,et al.The prevalence of lactase deficiency and lactose intolerance in Chinese children of different ages[J].Chinese Medical Journal,2000,113(12):1 129-1 132.
[4] CPEROTTI M,I VERONICA W,C INES V,et al.Dairy products modified in their lactose content[J].Current Nutrition & Food Science,2012,8(1):8-18.
[5] 常浩祥,杨敏,张炎,等.牦牛乳源乳糖水解工艺及美拉德反应抑制剂的研究[J].食品工业科技,2014,35(13):95-99.
[6] JIMENEZ-GUZMAN J,SARABIA-LEOS C,CRUZ-GUERRERO A E,et al.Interaction between β-lactoglobulin and lactase and its effect on enzymatic activity[J].International Dairy Journal,2006,16(10):1 169-1 173.
[7] JURADO E,CAMACHO F,LUZON G,et al.Kinetic models of activity for β-galactosidases:influence of pH,ionic concentration and temperature[J].Enzyme & Microbial Technology,2004,34(1):33-40.
[8] 李亚茹,郝力壮,牛建章,等.牦牛乳与其他哺乳动物乳功能性营养成分的比较分析[J].食品科学,2016,37(7):249-253.
[9] 马露.奶牛、水牛、牦牛、娟珊牛、山羊、骆驼和马乳特征性成分分析[D].呼和浩特:内蒙古农业大学,2014.
[10] FOX P F,UNIACKE-LOWE T,MCSWEENEY P L H,et al.Dairy chemistry and biochemistry[J].Molecular Aspects of Medicine, 2003,24(1-3):3-9.
[11] YANG Ming,ZHANG Wei-bing,WEN Peng-cheng,et al.Heat stability of yak micellar casein as affected by heat treatment temperatureand duration[J].Dairy Science & Technology,2014,94(5):469-481.
[12] JIMENEZ-GUZMAN J,CRUZ-GUERRERO A E,RODRIGUEZ-SERRANO G,et al.Enhancement of lactase activity in milk by reactive sulfhydryl groups induced by heat treatment[J].Journal of Dairy Dcience,2002,85(10):2 497-2502.
[13] CHEN Wen-guo,CHEN Hui,XIA Yu,et al.Immobilization of recombinant thermostable β-galactosidase fromBacillusstearothermophilus,for lactose hydrolysis in milk[J].Journal of Dairy Science,2009,92(2):491-498.
[14] YOU Yu-ru,CHEN Shu-zhen,He Guang-hua.Determination of Lactose in low-lactose dairy products[J].Food & Machinery,1999,2:36-37.
[15] CLAEYS W L,CARDOEN S,DAUBE G,et al.Raw or heated cow milk consumption:Review of risks and benefits[J].Food Control, 2013,31(1):251-262.
[16] 食品安全国家标准.GB 19645-2010,巴氏杀菌乳[S].北京:中国标准出版社,2010.
[17] APENTEN R K O,GALANI D.Protein stability function relations:native β-lactoglobulin sulphhydryl-disulphide exchange with PDS[J].Journal of the Science of Food & Agriculture,2000,80(80):447-452.
[18] DALGLEISH D G.Denaturation and aggregation of serum proteins and caseins in heated milk[J].Journal of Agricultural and Food Chemistry,1990,38(11):1 995-1 999.
[19] FURLAN S A,SCHNEIDER A L S,MERKLE R,et al.Optimization of pH,temperature and inoculum ratio for the production of β-D-galactosidase byKluyveromycesmarxianususing a lactose-free medium[J].Acta Biotechnologica,2001,21(1):57-64.
[20] SILANIKOVE N,LEITNER G,MERIN U.The Interrelationships between Lactose intolerance and the modern dairy industry: global perspectives in evolutional and historical backgrounds[J].Nutrients,2015,7(9):7 312-7 331.
[21] MESSIA M C,CANDIGLIOTA T,MARCONI E.Assessment of quality and technological characterization of lactose-hydrolyzed milk[J].Food Chemistry,2007,104(3):910-917.
[22] GREENBERG N A,MAHONEY R R.The activity of lactase (Streptococcusthermophilus) in milk and sweet whey[J].Food Chemistry,1984,15(4):307-313.
[23] KOSIKOWSKI F V, WIERZBICKI L E.Lactose hydrolysis of raw and pasteurized milks bySaccharomyceslactislactase[J].Journal of Dairy Science,1973,56(1):146-148.
Optimization of enzymatic hydrolysis of yak milk lactose and preheat treatment process
GUAN Sheng1,2, LIANG Qi1,2*, SONG Xue-mei1,2, HUANG Shao-hai3,ZHANG Yan1,2, WEN Peng-cheng1,2
1(Food Science and Engineering Department of Gansu Agricultural University, Lanzhou 730070, China)2(Functional Dairy Product Engineering Laboratory of Gansu, Lanzhou 730070, China)3(Lanzhou Xuedun Organism Dairy Produce Co. Ltd., Lanzhou 730050, China)
For a range of issues about heat treatment and lactose enzymolysis of yak milk, using yak milk derived from xiahe town Gansu province as raw material, taking microorganisms and lactose hydrolysis rate (V0) as assessment index, the preheat treatment conditions of lactose enzymolysis were determined. The conditions of lactose enzymolysis were optimized with lactose hydrolysis rate (V0) as index. The results showed that optimal heat treatment of yak milk significantly enhanced exogenous lactase enzyme activity. After enzymatic hydrolysis of lactose at 65 ℃ for 5 min, theV0was up to 49.0%. According to the requirement of actual production, pasteurized treatments using low temperature long time (LTLT) and high temperature short time (HTST) respectively were performed before lactose enzymolysis of yak milk, the condition for lactose enzymolysis was determined as 85 ℃ for 13 s. Response surface analysis (RSA) was applied to optimize the conditions of lactose enzymolysis on the foundation of single-factor experiment. The condition of lactose enzymolysis were determined as follows: enzymolysis temperature was 39 ℃, enzymolysis time was 2.4 h, amount of enzyme was 2.4 u/mL. The lactose hydrolysis rate reached 79.7%±0.9% under the optimized conditions, which was 11.2%-14.0% comparatively improvement comparing with the raw material in the same condition, while the time to meet the standard requirements (≥70%) has been reduced by 0.75 h.
yak milk; heat treatment; lactose; enzymolysis; optimize
10.13995/j.cnki.11-1802/ts.201701020
硕士研究生(梁琪教授为通讯作者,E-mail:liangqi@gsau.edu.cn)。
国家自然科学基金地区科学基金项目-牦牛乳硬质干酪脂肪酸的构成特征及氧化调控机制研究(31660468);甘肃省高等学校科研项目(2014A-061)
2016-08-11,改回日期:2016-09-08

