运动发酵单胞菌和休哈塔假丝酵母混合发酵秸秆产乙醇
黄达明,王美娟,管国强,崔凤杰*,霍书豪,赵鹏翔,张军宏,卜令习,赵正凯
1(江苏大学 食品与生物工程学院,江苏 镇江,212013) 2(国网节能服务有限公司北京生物质能源技术中心,北京,100053)
运动发酵单胞菌和休哈塔假丝酵母混合发酵秸秆产乙醇
黄达明1,王美娟1,管国强1,崔凤杰1*,霍书豪1,赵鹏翔2,张军宏2,卜令习2,赵正凯2
1(江苏大学 食品与生物工程学院,江苏 镇江,212013) 2(国网节能服务有限公司北京生物质能源技术中心,北京,100053)
首先考察了运动发酵单胞菌(Zymomonasmobilis,Z.mobilis)和休哈塔假丝酵母(Candidashehatae,C.shehatae)分别利用葡萄糖或木糖为唯一底物时的乙醇发酵特性;其次,研究了单菌及双菌发酵混合糖(葡萄糖和木糖比例为 3∶1)的产乙醇性能;在此基础上,考察了单菌和双菌培养应用于玉米秸秆发酵产乙醇的可行性。结果表明,Z.mobilis和C.shehatae的接种方式显著影响混合糖发酵产乙醇的效率,当分步接种发酵48 h后,乙醇产量达到最高,为25.77 g/L。当以60 g/L NaOH预处理的玉米秸秆为底物时,分步接种可高效利用秸秆酶解产物(葡萄糖和木糖)实现乙醇产量的最大值(22.34 g/L),提示Z.mobilis和C.shehatae分步接种发酵可最大化地发酵秸秆中的葡萄糖和木糖生产乙醇,有利于乙醇的高产率生产,可为实现纤维原料生产燃料乙醇的工业化提供参考。
混合糖;运动发酵单胞菌;休哈塔假丝酵母;乙醇;玉米秸秆
以木质纤维素为原料生产燃料乙醇是当前能源领域研究的热点[1]。木质纤维素原料包括农作物秸秆、林业加工废料、甘蔗及城市垃圾中所含的废弃生物质等[2]。木质纤维原料中纤维素和半纤维素分别约占干重的35%~45%和20%~40%。研究表明,充分利用木质纤维原料中的木糖发酵生成乙醇,能使木质纤维原料的乙醇产量增加25%。因此,木糖的乙醇发酵一直被人们视为木质纤维原料生物转化生产乙醇是否经济可行的关键环节[3-4]。
运动发酵单胞菌(Zymomonasmobilis)在酒精发酵中具有优良的工业应用潜力。与传统酵母相比,具有发酵速度快、底物利用率高、生物量得率低、乙醇产率高等特点,并能耐受高浓度乙醇和底物[5]。该菌可以利用葡萄糖和果糖等产乙醇,但不能发酵木糖等五碳糖。自1980年发现一些微生物可发酵木糖产乙醇以来,已有200多个菌株被证实可利用木糖。其中,约有30余种菌株可发酵木糖产乙醇,休哈塔假丝酵母(Candidashehatae)、鞣管囊酵母(Pachysolentannophilus)和树干毕赤酵母(Pichiastipitis)等被认为最具工业应用潜力[6]。目前,构建能够同时发酵木糖与葡萄糖的基因工程菌也是木质纤维素生物转化领域的研究热点之一[7-8]。
本文首先分别考察了Z.mobilis或C.shehatae单菌发酵和双菌混合发酵单糖或混合糖(葡萄糖和木糖的比例为3∶1)时底物的利用效率和乙醇的生产性能。在此基础上,以NaOH预处理的玉米秸秆为底物,探索了单菌和双菌培养应用于秸秆发酵产乙醇的可行性,以期为提供一种能充分利用秸秆水解产物葡萄糖和木糖生产乙醇和有效提高木质纤维素的利用效率提供参考。
1 材料与方法
1.1 菌种与培养基
葡萄糖发酵菌株:运动发酵单胞菌(Z.mobilis),种子培养液(g/L)[9]:葡萄糖100.0,KH2PO42.0,酵母膏10.0,pH 7.0。装液量100mL/250mL,30 ℃静置培养12 h。
木糖发酵菌株:休哈塔假丝酵母(C.shehatae),种子培养液(g/L)[6]:葡萄糖20.0,胰蛋白胨3.0,酵母膏5.0。装液量100 mL/250 mL,30 ℃、100 r/min培养12 h。
发酵培养基(g/L):葡萄糖25.0~200.0和/或木糖5.0~120.0,酵母膏5.0,(NH4)2SO45.0, KH2PO42.0,MgSO40.5。经121 ℃灭菌15 min后接种发酵。
1.2 原料与主要试剂
玉米秸秆预处理:玉米秸秆取自河南焦作,经60 ℃烘干至恒重(水分含量小于5%)。将玉米秸秆剪至4~5 cm,用SF130 型锤片式粉碎机进行粉碎,经5.00 mm筛孔过筛。将粉碎玉米秸秆按1∶10(g∶mL)加入1 mol/L的NaOH溶液中,经室温(25℃左右)下预处理24 h后,水洗至中性,烘干(水分含量小于2%)备用。
纤维素酶Spezyme CP:由Genencor International提供,其最适纤维素酶活温度为50~55 ℃。经测定,纤维素酶活为489 U/mL,木聚糖酶活为807 U/mL。
1.3 单菌发酵不同浓度的葡萄糖或木糖
配制葡萄糖浓度分别为25、50、100、150、200 g/L或者木糖浓度分别为5、15、30、60、120 g/L发酵培养基,经121 ℃灭菌15 min后按10%(v/v)接种量接种,30 ℃培养48 h。每隔12 h取样。
1.4 混合糖发酵产乙醇
参考玉米秸秆中葡萄糖和木糖比例(约为3∶1),配置混合糖发酵培养基(g/L):葡萄糖45.0,木糖15.0,酵母膏5.0,(NH4)2SO45.0, KH2PO42.0,MgSO40.5。经121 ℃灭菌15 min后接种发酵。
采用3种接种模式发酵混合糖产乙醇:1)单菌发酵混合糖:在混合糖发酵培养基中只接入C.shehatae,30 ℃、100 r/min的条件下培养48 h;或只接入Z.mobilis,30 ℃静置培养48 h;2)双菌同步接种发酵混合糖:将休哈塔假丝酵母和运动发酵单胞菌同时接入混合糖发酵培养基后30 ℃静置培养48 h;3)双菌分步接种发酵混合糖:先接入Z.mobilis,30 ℃静置培养24 h后再接入Z.mobilis,继而在30 ℃、100 r/min的条件下培养24 h。各实验组每隔12 h取样,分别测定残留葡萄糖/木糖浓度和乙醇产量等。
1.5 20L发酵罐同步糖化发酵秸秆产乙醇
秸秆发酵培养基(g/L):NaOH预处理的秸秆60.0,添加酵母粉5.0,(NH4)2SO45.0, KH2PO43.0,MgSO40.5,121 ℃灭菌20 min后,添加纤维素酶Spezyme CP,添加量为50 FPU/g秸秆;发酵体积为60%,即12 L,接种量为5%(v/v),发酵温度30 ℃,发酵pH 6.5。按照1.4中接种模式发酵48 h,其中,采用间歇式搅拌和搅拌转速50 r/min条件分别培养Z.mobilis和C.shehatae时,搅拌转速和温度分别为50 r/min和30 ℃;当同时或分步接种运Z.mobilis和C.shehatae时发酵时,其种子液体积比设为1∶1。定期取样检测发酵液中残留葡萄糖/木糖浓度和乙醇产量等。
1.6 分析方法
乙醇含量测定采用气相色谱外标法[10-11]:HP-5890;氢火焰检测器,氮气作载气。色谱条件:FID检测器;进样口温度210 ℃;检测器温度 250℃;柱温初始温度40 ℃;载气为氮气,流速:1 mL/min,空气:流速400 mL/min;H2:流速47 mL/min;分流比40∶1。
采用SBA-40C型生物传感分析仪测定发酵液中葡萄糖含量;采用分析试剂盒(D-Xylose Assay Kit)测定发酵液中木糖含量[12]。
1.7 数据处理
实验结果采用SPSS10.0软件进行处理。图和表中结果为3个重复的平均值±标准偏差。采用one way ANOVA进行试验数据的方差分析,P<0.05 表明差异显著。
2 结果与分析
2.1 单菌发酵不同浓度单糖产乙醇
2.1.1Z.mobilis/C.shehatae的葡萄糖发酵特性
前期研究表明,Z.mobilis可高效快速地发酵底物葡萄糖生产乙醇,并具有高浓度的底物葡萄糖和乙醇的耐受性[5]。由图1(a)可以看出,运动发酵单胞菌在不同糖浓度下,发酵液中乙醇终浓度随着糖含量的增加而增加。当糖浓度为200 g/L的时候,发酵进行到36 h时,达到最大值91.3 g/L。由图1(b)可以看出,当葡萄糖浓度在50 g/L时,休哈塔假丝酵发酵产的乙醇量最大达到21.06 g/L。

图1 葡萄糖为碳源时运动发酵单胞菌和休哈塔假丝酵母的乙醇发酵特性Fig.1 Ethanol fermentation performance from glucose by Z. mobilis and C. shehatae
2.1.2C.shehatae的木糖发酵性能
休哈塔假丝酵母C.shehatae被认为是能直接利用木糖进行乙醇发酵并被认为最具有工业价值的菌种之一[13]。由表1可以看出,C.shehatae产乙醇量随木糖浓度和发酵时间的增加而增加。但过高木糖浓度(>60 g/L)似乎对底物消耗、菌体生长和乙醇产量均有副作用。特别是在木糖浓度为120 g/L时,发酵48 h后,残糖浓度为65.20 g/L,而乙醇产量仅为9.9 g/L,显著低于木糖浓度60 g/L时的产量(15.35g/L)。葛菁萍等研究发现,休哈塔假丝酵母CandidashehataeHDYXHT-01在优化条件下,可以发酵木糖(80 g/L)生产26.18 g/L的乙醇[14]。
表1 休哈塔假丝酵母发酵木糖产乙醇
Table 1 Ethanol production from xylose byC.shehatae

初始木糖浓度/(g·L-1)发酵时间/h残糖量/(g·L-1)OD600乙醇/(g·L-1)5121.93±0.221.07±0.122.00±0.23240.12±0.021.21±0.082.22±0.15360.10±0.041.33±0.142.19±0.20480.09±0.021.37±0.102.42±0.0915129.57±0.351.04±0.071.81±0.13245.07±0.471.24±0.074.58±0.50361.88±0.051.32±0.116.17±0.73480.29±0.091.40±0.067.07±0.17301220.26±0.871.11±0.103.02±0.322411.90±1.311.43±0.026.46±0.28365.32±0.331.500±0.108.82±0.56482.78±0.081.56±0.1410.14±0.92601241.12±3.151.34±0.083.04±0.122431.54±4.231.43±0.116.86±0.253618.63±0.951.57±0.069.26±0.724818.15±0.891.64±0.0915.34±0.871201288.56±1.360.98±0.142.92±0.092477.34±5.481.23±0.064.84±0.563666.20±4.421.39±0.028.38±0.674865.20±3.821.48±0.149.94±0.89
2.2 单菌或双菌发酵混合糖产乙醇
2.2.1 单菌发酵混合糖产乙醇
参考NaOH预处理秸秆水解液中葡萄糖和木糖的比例(约为3∶1),设定葡萄糖和木糖浓度分别为45 g/L和15 g/L,用于考察单菌或双菌发酵混合碳源产乙醇的情况。
由图2(a)可知,运动发酵单胞菌只能利用葡萄糖发酵生产乙醇。发酵24 h后,残留葡萄糖含量为1.75 g/L,乙醇产量迅速增加至19.57 g/L。发酵液中木糖含量基本保持不变。48 h后,葡萄糖被全部消耗,乙醇产量为20.92 g/L。而休哈塔假丝酵母在发酵初期优先利用葡萄糖供菌体生长和乙醇生产(图2(b))。发酵24 h后葡萄糖的质量浓度降低至1.70 g/L,此时开始利用木糖,表明葡萄糖对木糖的利用有竞争性抑制作用;发酵终点时,乙醇产量达到19.98 g/L。
2.2.2 双菌发酵混合糖产乙醇
由图3(a)可知,Z.mobilis、C.shehatae同步接种发酵12 h时,葡萄糖已被快速消耗至8.85 g/L,在此期间,葡萄糖抑制了双菌利用木糖,木糖的浓度仍维持在15.0 g/L左右。待葡萄糖基本上全部被消耗后(发酵24 h后),木糖浓度逐渐被利用降低至最低。当发酵48 h时,乙醇产量为23.02 g/L,高于单菌发酵产的乙醇量(约20 g/L)。分步接种时,即,先接入Z.mobilis,24 h后再接入C.shehatae,其发酵过程如图3(b)所示。由于运动发酵单胞菌不利用木糖,在24 h内,木糖含量保持恒定。当接入C.shehatae后,木糖逐渐开始减少。发酵至终点(48 h)后,乙醇产量为4组混合糖发酵实验中的最大值,达到25.77 g/L。我们前期研究发现,Z.mobilis利用葡萄糖合成乙醇的转化率显著高于C.shehatae[15]。因此,在前24 h同步接种发酵阶段,C.shehatae与Z.mobilis竞争利用葡萄糖合成乙醇,而分步接种Z.mobilis发酵阶段无C.shehatae生长竞争,从而导致分步接种发酵乙醇产量显著高于同步接种。
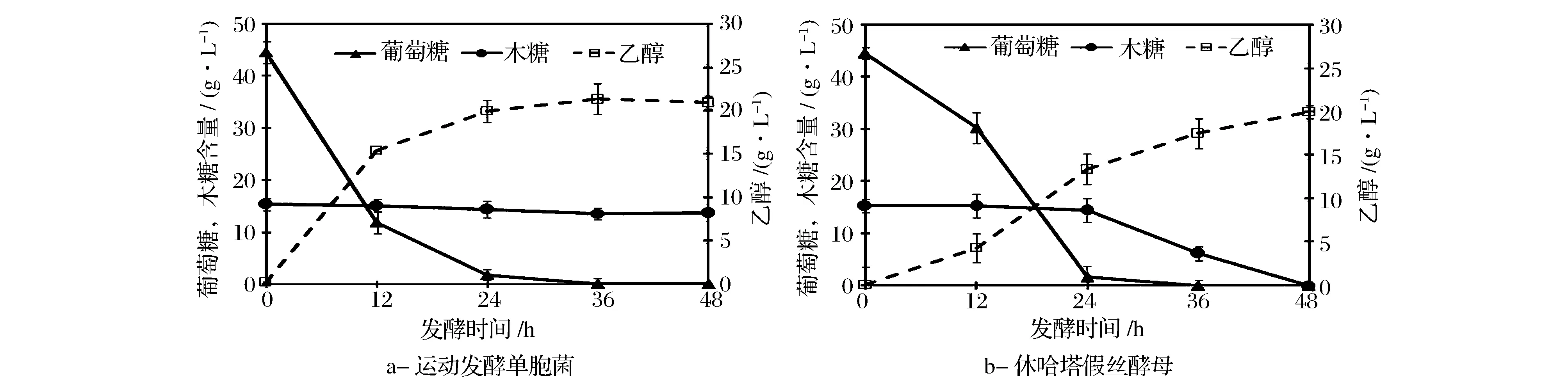
图2 以混合糖为底物时运动发酵单胞菌及休哈塔假丝酵母的乙醇发酵性能Fig.2 Ethanol fermentation performance from mixed sugars by Z. mobilis and C. shehatae
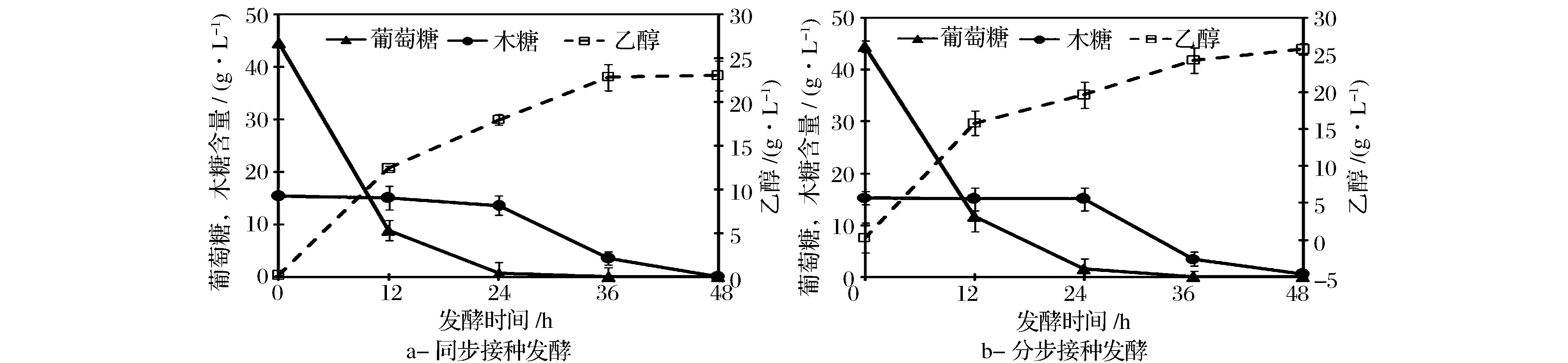
图3 接种方式对混合菌发酵混合糖生产乙醇的影响Fig.3 Effect of one-step and two-step inoculation on ethanol fermentation performance from mixed sugars by Z. mobilis and C. shehatae
2.3 双菌混合同步/分步接种发酵玉米秸秆生产乙醇
配制含有NaOH预处理的玉米秸秆浓度为60 g/L的发酵培养基。单菌或双菌接种Z.mobilis和C.shehatae,并添加市售的Spezyme CP纤维素酶,考察其在20 L发酵罐规模下同步糖化发酵秸秆产乙醇的情况。
2.3.1 单菌发酵NaOH预处理秸秆产乙醇
接种Z.mobilis同步糖化发酵秸秆产乙醇过程如图4(a)所示。发酵期间,葡萄糖浓度始终保持较低水平,表明Z.mobilis可快速利用酶解秸秆产生的葡萄糖,用于菌体生长或乙醇生产。由于该菌不能利用木糖,发酵醪中木糖浓度持续累积至8.86 g/L。当发酵48 h时,乙醇产量为16.90 g/L。而由图4(b)可知,接种C.shehatae的48 h发酵过程中,葡萄糖和木糖均保持较低水平,表明该菌利用了秸秆酶解产的葡萄糖和木糖用于生长和产物合成,其在发酵终点时,乙醇产量达到12.38 g/L。
图4 以玉米秸秆为底物时运动发酵单胞菌及休哈塔假丝酵母的乙醇发酵性能Fig.4 Ethanol fermentation performance from NaOH-treated corn stover by Z. mobilis and C. shehatae
2.3.2 双菌混合同步/分步接种发酵NaOH预处理秸秆产乙醇
由图5(a)可知,Z.mobilis和C.shehatae同步接种发酵时,葡萄糖和木糖均被较快利用,在发酵醪中维持较低的浓度;当发酵48 h时,乙醇含量达到19.72 g/L。由图5(b)可知,先接种Z.mobilis培养24 h,葡萄糖持续被利用,而木糖累积至4.63 g/L。后经接种C.shehatae后,葡萄糖和木糖均以较快速度被利用;当发酵终点时,乙醇产量达到22.34 g/L。

图5 接种方式对混合菌同步/分步接种发酵秸秆生产乙醇的影响Fig.5 Effect of one-step and two-step inoculation on ethanol fermentation performance from NaOH-treated corn stover by Z. mobilis and C. shehatae
3 讨论
为了充分利用木质纤维素中的葡萄糖和木糖,已有部分研究探索了单菌或双菌发酵葡萄糖/木糖混合糖生产乙醇的最适条件。如宋向阳等发现,树干毕赤酵母在发酵80.9 g/L的混合糖(葡萄糖与木糖比率为2∶1)时,优先利用葡萄糖,待葡萄糖几乎被消耗完后, 对木糖的利用开始占主导地位, 发酵终点时乙醇浓度达到33.2 g/L[16]。而葡萄糖发酵菌种(如运动发酵单胞菌Z.mobilis,酿酒酵母S.cerevisiae和克鲁维酵母K.marxianus等)和木糖发酵菌种(粗糙脉孢菌N.crassa,毕赤酵母P.pastoris,嗜鞣管囊酵母P.tannophilus和休哈塔假丝酵母C.shehatae等)的生长和发酵特性差异明显,在双菌混合发酵产乙醇的过程中,需充分协调二者对碳氮源等营养物质竞争关系。李晴等通过对比休哈塔假丝酵母单菌发酵、休哈塔假丝酵母和酿酒酵母两步发酵和休哈塔假丝酵母和酿酒酵母同步发酵等模式下对混合糖(葡萄糖和木糖) 的利用情况,发现2 种酵母同步发酵能够有效解除葡萄糖的抑制,加快木糖利用速率,在最适条件下,乙醇产量达到21.71 g/L[1]。为了实际应用秸秆类木质纤维素生产高附加值产物,张健等开发了休哈塔假丝酵母与酿酒酵母分步接种、3 阶段同步糖化共发酵(SSCF)的乙醇生产工艺,直接以丁酮溶液爆破的稻米秸秆为底物,经无添加营养物发酵约6.5 d后,乙醇收得率可达26.9g/100g(干秸秆),具有较好的参考价值[12]。
基于以上研究现状,本论文系统地研究Z.mobilis和C.shehatae单菌或双菌发酵混合糖产乙醇的性能,发现Z.mobilis可以高效转化200 g/L的葡萄糖为91.3 g/L的乙醇;而C.shehatae可充分利用低浓度葡萄糖和木糖混合糖。二者的接种方式显著影响混合糖发酵产乙醇的效率,其中,分步接种发酵48 h(先接入Z.mobilis发酵24 h后,再接入C.shehatae发酵24 h)后,乙醇产量最高于达到25.77 g/L。在此基础上,对比分析了单菌或混合菌在20 L发酵罐规模下利用60 g/L的NaOH预处理玉米秸秆产乙醇的性能,证实相同培养条件下,Z.mobilis和C.shehatae分步接种可高效利用秸秆酶解产物(葡萄糖和木糖),发酵48 h后乙醇产量达到最大,达到22.34 g/L,基本实现了最大化地把秸秆中的葡萄糖和木糖转化为乙醇。为提升和优化该工艺的生产性能,后续将进一步研究混菌分步接种发酵工艺,如优化接种时间,分阶段控制培养温度和pH等,以期为增加秸秆中混合糖的转化效率和乙醇的产量提供技术参考。
[1] 李晴,宋向阳,范晓阳,等.混菌戊糖己糖发酵产乙醇的研究[J].林产化学与工业,2015,35(2):111-116.
[2] 路鹏,江滔,李国学.木质纤维素乙醇发酵研究中的关键点及解决方案[J].农业工程学报,2006,22(9):237-240.
[3] 汤斌,周逢云,张庆庆,等.Candidashehatae的纯化及其利用木糖和葡萄糖发酵的特性研究[J].食品科学,2009,30(3):159-162.
[4] KORDOWSKA-WIATER M,TARGOSKI Z.Ethanol fermentation on glucose/xylose mixture by co-cultivation of restricted glucose catabolite repressed mutants ofPichiastipitiswith respiratory deficient mutants ofSaccharomycescerevisiae[J].Acta Microbiologica Polonica,2002,51(4):345-352.
[5] 吴赫川,马莹莹,张宿义,等.运动发酵单胞菌(Zymomonasmobilis)发酵乙醇的研究进展[J].酿酒科技,2015(2):94-99.
[6] 周逢云,汤斌,张庆庆,等.休哈塔假丝酵母发酵木糖产乙醇的研究[J].安徽工程科技学院学报, 2007,22(4):25-28.
[7] 周稳,付烈,王俊卿,等.重组运动发酵单胞菌发酵木糖产乙醇的研究[J].化学与生物工程,2011,28(5):23-27.
[8] LI Yuan,PARK J Y,SHIROMA R,et al.Improved ethanol and reduced xylitol production from glucose and xylose mixtures by the mutant strain ofCandidashehataeATCC22984[J].Applied Biochemistry and Biotechnology,2012,166(7):1 781-1 790.
[9] 彭玉麟,崔慧霄,史延茂,等.温度对运动发酵单胞菌乙醇产量及动力学参数的影响[J].食品与发酵工业,1992,18(2):50-54.
[10] ZHANG Jian,ZHANG Wen-xue,YANG Jian,et al.Pretreatment of rice straw using a butanone or an acetaldehyde dilute solution explosion for producing ethanol[J].Applied Biochemistry and Biotechnology,2012,166(7):1 856-1 870.
[11] TATSAPOM T,TIPONG N,KAMONCHANOK A,etal.Fermentation of rice bran hydrolysate to ethanol usingZymomonasmobilisbiofilm immobilization on DEAE-cellulose[J].Electronic Journal of Biotechnology,2015,18(3):196-201.
[12] 张健,张文学,吴正云.秸秆制乙醇的休哈塔假丝酵母与酿酒酵母共混SSCF工艺优化[J].食品与发酵工业,2013,39(10):125-129.
[13] MUJGAN T O,NURDAN E S.Fermentation of sunflower seed hull hydrolysate to ethanol byPichiastipitis[J].Bioresour Technol,2008,99(7): 2 162-2 169.
[14] 葛菁萍,刘国明,杨晓峰等.休哈塔假丝酵母HDYXHT-01利用木糖生产乙醇的发酵工艺优化[J].生物工程学报,2011,27(3):404-411.
[15] DELGENES J P,MOLETTA R,NAVARRO J M.Effects of lignocellulose degradation products on ethanol fermentations of glucose and xylose bySaccharomycescerevisiae,Zymomonasmobilis,Pichiastipitis, andCandidashehatae[J].Enzyme and Microbial Technology,1996,19:220-225.
[16] 宋向阳,陈牧,毛连山等.戊糖己糖混合糖发酵生产乙醇的主要影响因素[J].南京师大学报,2009,32(1):115-119.
Ethanol production from corn stover using mixed cultures ofZymomonasmobilisandCandidashehatae
HUANG Da-ming1, WANG Mei-juan1, GUAN Guo-qiang1,CUI Feng-jie1*,HUO Shu-hao1, ZHAO Peng-xiang2, ZHANG Jun-hong2, BO Ling-xi2, ZHAO Zheng-kai2
1(School of Food and Biological Engineering, Jiangsu University, Zhenjiang,212013, China) 2( Beijing Biomass Energy Technology Center, State Grid Energy Conservation Service Ltd, Beijing,100053, China)
The fermentation ofZymomonasmobilisandCandidashehataeusing different concentrations of glucose and xylose were firstly investigated. Then ethanol production performance from glucose, xylose, mixed sugars (glucose and xylose) and NaOH-treated corn stover by single strain and mixed cultures ofZ.mobilisandC.shehataewere further studied. Results showed that stepwise inoculation ofZ.mobilisandC.shehataesignificantly affected the ethanol production from mixed sugars. The highest ethanol concentration of 25.77g/L was achieved whenZ.mobiliswas inoculated firstly and followed byC.shehataeafter 24 h fermentation (two-step inoculation). During simultaneous saccharification and fermentation by the mixed cultures in a 20L fermentor, the highest ethanol concentration of 22.34 g/L was obtained from 60g/L of NaOH-treated corn stover using two-step inoculation of mixed culture with low sugar accumulation. Our results suggested that the two-step inoculation ofZ.mobilisandC.shehataecould maximize fermentation of glucose and xylose in biomass to produce ethanol and offered a reference for using lignocelluloses as raw materials to produce fuel ethanol.
mixed sugar;Zymomonasmobilis;Candidashehatae; ethanol; corn straw
10.13995/j.cnki.11-1802/ts.201701006
教授(崔凤杰教授为通讯作者,E-mail:fengjiecui@163.com)。
国家电网公司科技项目资助(合同号:SGECS56-2014); International Foundation for Science ( F/4930-2F)
2016-06-02,改回日期:2016-07-01

