Pichiapastoris细胞的酶法水解
张永杰,牛丹丹,*,吴海洋,黄磊,董自星,刘晓光,叶秀云,路福平*
1 (天津科技大学 生物工程学院,工业发酵微生物教育部重点实验室,天津,300457) 2(福州大学 生物科学与工程学院,福建省海洋酶工程重点实验室,福建 福州,350116) 3 (天津科技大学 化工与材料学院,生物化工系,天津,300457)
Pichiapastoris细胞的酶法水解
张永杰1,牛丹丹1,2*,吴海洋1,黄磊1,董自星3,刘晓光3,叶秀云2,路福平1*
1 (天津科技大学 生物工程学院,工业发酵微生物教育部重点实验室,天津,300457) 2(福州大学 生物科学与工程学院,福建省海洋酶工程重点实验室,福建 福州,350116) 3 (天津科技大学 化工与材料学院,生物化工系,天津,300457)
以工业酶制剂生产中的废弃毕赤酵母细胞为对象,研究并建立了酶法制备酵母浸出物的新工艺。新工艺为:10%(w/v)废弃毕赤酵母菌体中加入β-甘露聚糖酶、β-葡聚糖酶和果胶酶,于50 ℃作用12 h;再加入中性蛋白酶,于50 ℃作用7 h;再加入DNA酶和RNA酶,于37 ℃作用4 h。离心收集上清液,真空冷冻(或喷雾)干燥获得酵母浸出物。运用这一技术,酵母细胞组分的溶出率达到66.2%,固形物收得率为65.7%。使用该研究制得的酵母浸出物培养重要工业微生物菌种,其支撑细胞生长繁殖的效果显著优于市售酵母粉。
酵母浸出物;酶法制备;毕赤酵母
酵母细胞抽提物或浸出物(yeast extract)是以酵母细胞(主要是啤酒酵母或面包酵母)为原料,经过自溶或酶解等制得。酵母浸出物含有18种以上的氨基酸,尤其含有谷物中含量不足的赖氨酸;还富含B族维生素和钙、镁、锌、铁、硒等微量元素[1]。酵母浸出物除了作为微生物培养基的主要组成外,近年来已发展成为食品工业中的原/辅料,在营养、调味和保健方面发挥其独特功效。
酵母细胞及其浸出物长期以来一直是食品发酵工业研究的重要内容,国内外有关酵母浸出物的研究主要集中在制备过程的影响因素[2]、生产方法[3]、下游工艺[4]、富含5’-单磷酸鸟苷(5’-GMP)的酵母抽提物的生产[5-6]以及酵母浸出物在生产红酒澄清剂[7]、芳香成分[8]、棕榈油酸[9]和治疗肉鸡的坏死性肠炎[10]等方面。但就酵母浸出物的生产技术研究,长期停留在以自溶为基础的工艺优化方面,深入研究不多。
酵母浸出物的生产技术主要有:自溶法、酶解法和酸解法,其中自溶法仍然是我国酵母浸出物制备的主要方法;酸解法因为污染严重、产品质量低等已经不再被使用。酵母浸出物的生产原料主要为啤酒酿制后的酵母废弃生物体,所采用的生产工艺的关键步骤是物理诱导酵母细胞自溶,在细胞自溶时释放相关水解酶系使得细胞生物体酶解,此法简便易行但收得率较低[2]。酶解法制备酵母浸出物是一种高效、绿色制造技术,目前,世界上仅日本采用酶法生产酵母浸出物;我国利用酶法技术生产酵母浸出物工艺尚未成熟[1],其中各关键因素、酶制剂的种类与使用方式等有待深入研究。
新型酵母资源替代啤酒酵母制备酵母浸出物是一个值得关注的研究方向,其中备受关注的便是能够进行高密度培养的巴斯德毕赤酵母(Pichiapastoris)[11]。作为重要酶制剂工业生产宿主的巴斯德毕赤酵母,在其完成酶制剂的生产后,主要作为废弃物通过烘干等物理处理,用作动物饲料的添加剂或辅料,营养价值远远没有得到应有的开发与利用。为此,本研究探索全酶法处理巴斯德毕赤酵母废弃细胞制备酵母浸出物的新方法,并评价所获得酵母浸出物的营养价值。
1 材料与方法
1.1 酶与菌种
巴斯德毕赤酵母(P.pastoris)GS115为本实验室保藏,用YPD培养基(酵母膏1%,蛋白胨2%,葡萄糖2%)进行培养。地衣芽胞杆菌CBBD302为本课题组前期研究中选育的可用于多种工业酶高效表达的工业宿主细胞,大肠杆菌JM109为分子克隆常用实验菌株,均由本实验室保藏,以M9’培养基(以M9培养基为基础,添加12.05%的酵母膏并去除其中含磷元素的成分)进行培养。
β-甘露聚糖酶(60 000 U/g)、β-葡聚糖酶(20 000 U/g)和果胶酶(100 000 U/g)购自江苏锐阳生物科技有限公司;中性蛋白酶(20 000 U/g)、DNA酶(330 U/g)、RNA酶(35 000 U/g)为通过本实验室前期研制的重组菌发酵制备获得。其他药品和试剂均为分析级,购自国药集团化学试剂有限公司。
1.2 酶活测定方法
中性蛋白酶活性测定采用福林酚法[13]。核酸酶活性测定采用紫外分光光度法[14]。其基本方法是:将0.1 mL酶液与0.2 mL 2 mg/mL热变性的小牛胸腺DNA在37 ℃孵育30 min后,用7%的高氯酸终止反应,再加入3 mL预冷的蒸馏水,在10 000×g,4 ℃条件下离心15 min,再用紫外分光光度计在260 nm下测定上清液的吸光值。反应液与对照的吸光值之差为1时定义为1个酶活力单位(U)。
1.3 单酶水解试验
离心收集废弃的毕赤酵母细胞,然后将其用每种酶的最适缓冲液配制成10% (w/v)的酵母液,分别用β-甘露聚糖酶(50 ℃,pH 5.5)、β-葡聚糖酶(50 ℃,pH 4.8)、果胶酶(50 ℃,pH 5.0)、中性蛋白酶(50 ℃,pH 7.0)、DNA酶(37 ℃,pH 7.0)和RNA酶(37 ℃,pH 7.0)在各自最适反应条件下对酵母细胞进行单独作用。在不同时间点取样分析酵母细胞溶出情况,以溶出率进行描述。
(1)
式中:η,溶出率,%;m0,初始酵母细胞质量,g;m1剩余酵母细胞质量,g。
1.4 组合酶水解试验
在10% (w/v)的酵母液中,分别添加β-甘露聚糖酶、β-葡聚糖酶以及果胶酶中的任意两种酶或同时添加3种酶,于50 ℃对酵母细胞进行酶解,并在不同时间点取样,通过测定上清中还原糖的含量来判断组合酶的作用效果,以单个酶对酵母的酶解作用为对照。
在β-甘露聚糖酶、β-葡聚糖酶以及果胶酶作用至酵母泥质量不再变化后,用0.1 mol/L NaOH调节pH至7.0,再加入中性蛋白酶于50 ℃对酵母细胞进行作用,考察中性蛋白酶的协同作用效果。
1.5 酶法制备酵母浸出物的基本流程
在上述实验的基础上,确定酶法制备冻干酵母浸出粉的基本工艺流程,并与现有工艺进行比较。采用该工艺流程制备酵母浸出物,并通过不同时间点取样,确定该工艺流程中酵母泥质量的变化情况。再取3个250 mL三角瓶,分别加入等量(约0.85 g)的酵母泥。然后采用上述工艺流程酶解酵母细胞,离心后(12 000 r/min,10 min),将上清液在烘箱中烘至恒重,并称重,计算细胞组成溶出率与固形物收得率。
(2)
式中:R,固形物收得率,%;m0′,酶解前酵母干重,g;m1′,酶解酵母细胞上清液总质量,g;m2,反应过程中外加入的酶制剂,调pH时所加的NaOH等干重总和,g;ρ,上清液固形物含量,%。
1.6 微生物生长试验
采用1.1描述的培养基,并用含有25 mL M9培养基的250 mL三角瓶,在37 ℃、220 r/min下分别培养地衣芽胞杆菌CBBD302和大肠杆菌JM109,通过测定细胞生物量,考察并比较其生长情况。同样,将YPD培养基中的酵母浸出粉替换为本研究获得的酵母浸出物,30 ℃、220 r/min下培养毕赤酵母GS115,研究其对酵母细胞生长的影响。细胞生物量的测定采用分光光度计法进行[12]。
1.7 酵母浸出物的组成分析
酵母浸出物的全组成成分采用气相色谱-质谱联用仪(GC-MS)进行分析。色谱条件如下:色谱柱:Agilent HP-5毛细管柱(30 m×250 μm×0.25 μm),载气:高纯氦气,载气流速:1.0 mL/min;进样方式:不分流;进样量:1 μL。初始温度70 ℃,维持4 min,以3 ℃/min升到133 ℃,再以2 ℃/min升到200 ℃,再以3℃/min升到220 ℃,最后以5 ℃/min升到260 ℃。进样口温度:270 ℃;接口温度:280 ℃;离子化方式:电子轰击(EI),温度230 ℃,电子能量70 eV;四级杆温度150 ℃,质谱扫描范围为85~500m/z。
此外,还原糖含量的测定采用3,5-二硝基水杨酸(DNS法)[15];酵母干物质含量测定按照文献方法进行[1]。
2 结果与讨论
2.1 不同酶制剂对巴斯德毕赤酵母细胞的作用特征
酵母浸出物制备的相应酶制剂的首选需要其能打开酵母的细胞壁[16-17]。据估算60 min内酶解1 g酵母细胞时酶的添加量为:β-甘露聚糖酶508.5 U、β-葡聚糖酶508.5 U、果胶酶56.5 U、中性蛋白酶56.5 U。以此为基础,在酶的最适作用条件下酶解酵母细胞,结果如图1a所示。
在加入β-甘露聚糖酶、中性蛋白酶、β-葡聚糖酶或果胶酶作用1 h后,酵母细胞的溶出率达到21%~43%。可见,上述酶皆能明显加速酵母细胞的裂解效率与程度、促进内含物的释放。其中,果胶酶的作用效果最好,这可能是因为除了作用于果胶外,它还可以降解几丁质、β-葡聚糖等[18],从而有利于细胞组成的水解与内含物的快速释放。酶解5 h后酵母细胞的溶出率达到42%~48%,继续延长作用时间,酶解作用不明显(图1a)。此外,通过增加酶的添加量,溶出率增加不显著(未发表数据)。可见,本实验中计算出的用酶剂量适合巴斯德毕赤酵母细胞的溶出。
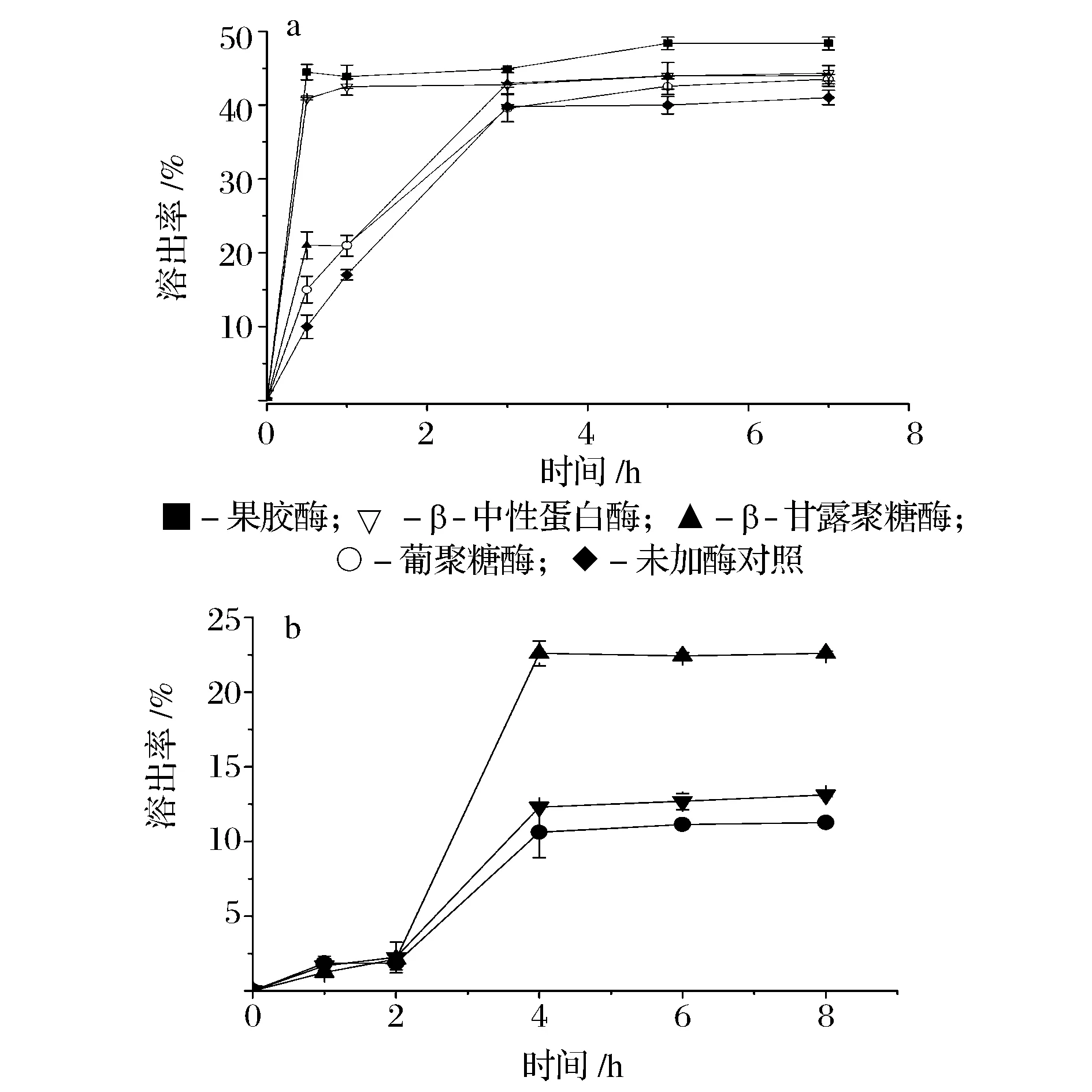
▲-DNA酶;▼-RNA酶;●-未加酶的对照图1 不同的酶制剂对毕赤酵母细胞的作用Fig.1 Effects of different enzymes on the hydrolysis of P. pastoris GS115 cells (注:50℃、pH 7.0条件下自溶6 h,冷却至37℃后,再加入DNA酶或RNA酶。)
本研究进一步考察了DNA酶或RNA酶对酵母细胞浸出物形成的影响,采用自溶后的酵母细胞为作用对象,结果如图1b所示。在330 U/g DNA酶或3.5万 U/g RNA酶的作用下,前期对细胞组成的溶出作用不明显,后期DNA酶呈现明显的作用而RNA酶作用效果一般。由此也可以看出,通过细胞自溶获得酵母浸出物的工艺过程中DNA酶相对不足。
2.2 组合酶对酵母细胞的水解作用
细胞的不同组分意味着酶的组合可以对酵母细胞溶出具有协同作用。为此,以可溶性还原糖释放量为指标,研究了β-甘露聚糖酶、β-葡聚糖酶和果胶酶之间的可能协同作用对毕赤酵母细胞的酶解作用。在酶的作用下,随着反应时间的延长,酶解上清中还原糖含量不断增加。其中,3种酶共同作用明显优于2种酶之间的组合作用,并显著优于单酶的作用(图2)。

▲-β-甘露聚糖酶+果胶酶;▼-果胶酶;△-β-葡聚糖酶;◆-β-甘露聚糖酶图2 组合酶对酵母细胞的作用Fig.2 Effects of different enzyme combinations on the hydrolysis of yeast cells
在β-甘露聚糖酶、β-葡聚糖酶和果胶酶共同作用至酵母泥质量不再变化时(约12 h),补加中性蛋白酶,酵母细胞的溶出率和上清中还原糖的含量随作用时间不断增加(图3)。可见,中性蛋白酶显著提高酵母细胞蛋白组分的溶出;蛋白酶的添加进一步激发了还原糖的释放,可见蛋白酶与糖基水解酶之间也存在协同作用。

图3 中性蛋白酶对毕赤酵母的作用Fig.3 Effects of neutral protease on the degradation of yeast cells
2.3 酶法制备酵母浸出物工艺流程
基于上述研究结果,拟定的酶法制备酵母浸出物新工艺为:(1)制备100 g/L酵母液,pH 5.5;(2)按干菌体质量计算,每克干菌体质量加入:508.5 U β-甘露聚糖酶、508.5 U β-葡聚糖酶和56.5 U果胶酶,于50 ℃酶解12 h;(3)调pH至7.0后,加入56.5 U中性蛋白酶,于50 ℃酶解7 h;(4)65 ℃灭酶30 min后,冷却至37 ℃,加入18.8 U DNA酶和300 U RNA酶解,继续酶解4 h;(5)离心(12 000 r/min,5 min)取上清液,经冷冻干燥或喷雾干燥获得粉状酵母浸出物。
以废弃的毕赤酵母细胞为原料,采用上述工艺流程制备酵母浸出物,在1.0 L反应体系下,主要工段酵母细胞溶出率分别是:β-甘露聚糖酶、β-葡聚糖酶和果胶酶协同作用后,酵母细胞的溶出率达到60.5%;进一步加入蛋白酶后的溶出率为64.5%;再在DNA酶和RNA酶的作用下,酵母细胞组分溶出率达到66.2%,固形物收得率达到65.7%。明显高于已有报道中采用酶促自溶法以啤酒废酵母为原料制备酵母浸出物的59.16%[1]、50%的固形物收得率[4]或用鲜酵母制备酵母抽提物的56.32%的收得率[16]。
在酶促自溶法制备酵母浸出物的生产工艺中,除了利用细胞自身的水解酶系(蛋白酶、核酸酶、糖基水解酶等)外,通过外加木瓜蛋白酶和溶壁酶等进行酶促自溶,并后续再使用中性蛋白酶、5’磷酸二酯酶以及磷酸腺苷脱氨酶等进行酶解[16]。显然,用酶成本过高且复杂,特别是溶壁酶、磷酸二酯酶和磷酸腺苷脱氨酶等属于特别昂贵的酶种[1]。可见,与酶促自溶法相比,本研究建立的酶法制备酵母浸出物路线,是从酵母的细胞壁开始对其大分子物质组成进行逐步酶法拆解(水解),具有水解效率高、操作简单、生产周期短、便于操作与自动化控制等优点,有利于后续的工业化放大与应用。
2.4 酵母浸出物组成分析与营养
采用GC-MS对所本研究制得的酵母浸出物的单体组成成分进行全分析。其中匹配度高于85%的部分物质列于表1中。该酵母浸出物的主要成分有糖类、氨基酸、核苷、脂肪酸及有机酸等物质,这些单体物质对生物体营养支持与细胞生长繁殖是十分重要的。

表1 GC-MS分析酵母浸出物的单体组成成分
分别用本研究中制备的酵母粉替换1.1中描述的M9’培养基和YPD培养基中的酵母抽提物(OXOID),进行培养基配制,以此培养基分别培养地衣芽胞杆菌CBBD302、大肠杆菌JM109以及毕赤酵母GS115,结果如图4所示。采用本法制备的酵母浸出物能够很好支持包括地衣芽胞杆菌、大肠杆菌JM109和毕赤酵母的生长,摇瓶条件下,地衣芽胞杆菌、大肠杆菌和毕赤酵母的最大细胞生物量(A600)分别为4.495、3.902和42.03,较对照分别提高了1.9倍、1.3倍和0.1倍;对细菌营养与繁殖具有极为显著的营养支撑作用。

a:地衣芽胞杆菌CBBD302;b:大肠杆菌JM109;c:毕赤酵母GS115;■:培养基中采用用自制酵母粉;○:培养基中采用酵母抽提物(OXOID)图4 酵母浸出物对微生物生长的作用Fig.4 Effects of yeast extracts on the cell growth of different microorganisms
3 结论
本研究依据酵母细胞组成大分子的基本特征,采用酶法水解路线实现了酵母细胞浸出物的高效酶法制备,由此获得的酵母浸出物可更好满足常见工业菌株如大肠杆菌、地衣芽胞杆菌、巴斯德毕赤酵母细胞的营养与生长需求。研究结果还将有利于现有酵母浸出物制备工艺的改进,也为发酵工业中废弃菌体资源化利用提供新的技术支持。
[1] 刘杰. 高品质生化培养基用酵母抽提物制备的研究[D]. 广州: 华南理工大学, 2011.
[2] TANGULER H, ERTEN H. Utilisation of spent brewer′s yeast for yeast extract production by autolysis: The effect of temperature[J]. Food & Bioproducts Processing, 2008, 86(4):317-321.
[3] SAYED E T, BARAKAT N A M, ABDELKAREEM M A, et al. Yeast extract as an effective and safe mediator for the baker’s-yeast-based microbial fuel cell[J]. Industrial & Engineering Chemistry Research, 2015, 54(12):3 116-3 122.
[4] IN M J, DONG C K, CHAE H J. Downstream process for the production of yeast extract using brewer′s yeast cells[J]. Biotechnology & Bioprocess Engineering, 2005, 10(1):85-90.
[5] SOMBUTYANUCHIT P, SUPHANTHARIKA M, VERDUYN C. Preparation of 5′-GMP-rich yeast extracts from spent brewer′s yeast[J]. World Journal of Microbiology and Biotechnology, 2001, 17(2):163-168.
[6] CHAE H J, JOO H, IN M J. Utilization of brewer′s yeast cells for the production of food-grade yeast extract. Part 1: effects of different enzymatic treatments on solid and protein recovery and flavor characteristics[J]. Bioresource Technology, 2001, 76(3):253-258.
[7] LOCHBüHLER B, MANTEAU S, MORGE C, et al. Yeast protein extracts: an alternative fining agent for red wines[J]. European Food Research & Technology, 2015, 240(4):689-699.
[8] LIN Mei-li, LIU Xiao-sheng, XU Qian-qian, et al. Aroma-active components of yeast extract pastes with a basic and characteristic meaty flavour[J]. Journal of the Science of Food & Agriculture, 2014, 94(5):882-889.
[10] M′SADEQ S A, WU Shu-biao, CHOCT M, et al. Use of yeast cell wall extract as a tool to reduce the impact of necrotic enteritis in broilers[J]. Poultry Science, 2015, 94(5):898-905.
[11] SCORER C A, CLARE J J, MCCOMBIE W R, et al. Rapid selection using G418 of high copy number transformants ofPichiapastorisfor high-lever foreign gene expression[J]. Nature Biotechnology, 1994, 12(2):181-184.
[12] 陈延君, 王红旗, 王然, 等. 鼠李糖脂对微生物降解正十六烷以及细胞表面性质的影响[J]. 环境科学, 2007, 28(9):2 117-2 122.
[13] YU Gang, LIU Jin-liang,XIE Lin-qin, et al. Characterization, cloning, and heterologous expression of a subtilisin-like serine protease gene VlPr1 fromVerticilliumlecanii[J]. The Journal of Microbiology, 2012, 50(6):939-946.
[14] CHESBRO W R, AUBORN K. Enzymatic detection of the growth ofStaphylococcusaureusin foods[J]. Applied Microbiology, 1967, 15(5):1 150-1 159.
[15] 赵凯, 许鹏举, 谷广烨. 3,5-二硝基水杨酸比色法测定还原糖含量的研究[J]. 食品科学, 2008, 29(8):534-536.
[16] REZANKA T, MATOULKOVD, KOLOUCHOVI,et al. Extraction of brewer’s yeasts using different methods of cell disruption for practical biodiesel production[J]. Folia Microbiologica, 2015, 60(3):225-234.
[17] 孟国庆, 王传宝, 朱陶, 等. 啤酒废酵母细胞破壁方法的研究[J]. 中国果菜, 2014, 34(12):30-34.
[18] KITTUR F S, VISHU KUMAR A B, VARADARAJ M C, et al. Chitooligosaccharides-preparation with the aid of pectinase isozyme fromAspergillusnigerand their antibacterial activity[J]. Carbohydrate Research, 2005, 340(6):1 239-1 245.
Enzymatic hydrolysis ofPichiapastoriscells
ZHANG Yong-jie1, NIU Dan-dan1,2*,WU Hai-yang1,HUANG Lei1,DONG Zi-xing3, LIU Xiao-guang3, YE Xiu-yun2, LU Fu-ping1*
1(Key Laboratory of Industrial Fermentation Microbiology, Ministry of Education, College of Biotechnology,Tianjin University of Science & Technology, Tianjin 300457,China) 2 (Fujian Provincial Key Laboratory of Marine Enzyme Engineering, College of Biological Science and Engineering, Fuzhou University, Fuzhou 350116,China) 3 (Department of Biological Chemical Engineering, College of Chemical Engineering and Material Sciences,Tianjin University of Science & Technology, Tianjin 300457,China)
Yeast extract contains abundant nutrition and has wide applications in condiment, pharmaceuticals, health care, microbial fermentation and other industries. Using spent yeast cell mass ofPichiapastorisformed during the production of industrial enzymes as raw materials, a novel enzymatic process for preparing yeast extract was established as follows. Spent cells ofP.pastoriswere re-suspended to a final concentration of 10% (w/v). β-Mannases, β-glucanase and pectinase were then added simultaneously to hydrolyze yeast cells at 50 ℃ for 12 h. The hydrolysis was then continuously carried out with neutral protease at 50 ℃ for 7 h. Additionally, the reaction mixture was treated with DNase and RNase for another 4 h. After all enzymatic treatments had been administered, the hydrolysate was centrifuged, and yeast extract was obtained from the supernatant by vacuum freeze-drying or spray drying, with a dissolution rate of 66.2% and a dry matter yield of 65.7%. Yeast extract prepared in this study was much better than that from commercial sources in cultivating microorganisms, including industrially important strainsEscherichiacoli,Bacilluslicheniformis, andP.pastoris.
yeast extract; enzymatic preparation;Pichiapastorisbiomass
10.13995/j.cnki.11-1802/ts.201701014
硕士研究生(牛丹丹,路福平教授为通讯作者,E-mail: ddniu0529@fzu.edu.cn,lfl@tust.edu.cn)。
天津市高等学校科技发展基金计划项目(20130628);天津市应用基础与前沿技术研究计划(青年基金项目)(14JCQNJC09200);福建省教育厅产学研(JA15049);国家自然科学基金国际(地区)合作与交流项目(31461143026)
2016-06-22,改回日期:2016-07-29

