不同促溶剂对酵母细胞在发酵液中自溶的影响
冀红芹,甄玉国,2 *,刘乙辰,赵小丽,陈 雪
(1.吉林农业大学吉农博瑞奶牛饲料研发中心,吉林 长春 130118;2.长春博瑞饲料集团有限公司技术中心,吉林 长春 130114)
随着我国及世界饲料工业的发展和蛋白质资源的日益匮乏[1],酵母越来越多的受到人们的关注。酵母的应用极为广泛,主要是因为其营养物质丰富:优质蛋白质含量达40%~60%,氨基酸成分含量较高且比例均衡,还含有酵母菌分泌的蛋白酶、消化酶、核苷酸、B族维生素、小肽等具有生物活性的成分[2]。酵母细胞壁的主要活性成分β-葡聚糖和甘露寡糖具有通过刺激机体细胞和体液免疫来提高免疫性能、促进有益菌生长以及抑制有害菌生长的作用,维持肠道和动物机体健康[3]。
然而,其独特而坚固的细胞壁结构使酵母的利用率较低。本试验通过不同方式的自溶,将酵母细胞内的营养物质释放出来。产物富含核苷酸、B族维生素、活性小肽、游离氨基酸及酵母细胞壁多糖等多种成分,兼有酵母原生质成分和酵母细胞壁多糖两部分的营养性能和生物活性功能。
酵母细胞自溶通过改变环境条件,激活酵母细胞本身含有的蛋白酶、核酸酶、碳水化合物水解酶和葡聚糖酶等多种内源酶,将细胞内的大分子化合物水解成小分子,然后通过细胞壁的孔隙渗透到细胞外。由于酵母细胞内源酶活力有限,并且在自溶过程中不断降低,自溶率很难提高[4]。
提高酵母细胞自溶率的方法主要有3种,(1)运用物理方法如高压均质、超声波、温差法等将酵母细胞破壁,使内容物溢出;(2)化学方法:通过添加NaCl、乙醇、硫胺素等化学物质,调节酵母细胞内外的渗透压、改变细胞膜通透性、刺激酵母细胞内源酶的活性,提高酵母自溶的得率;(3)生物学手段:采用外加酶促进酵母细胞壁或胞内大分子的水解来提高酵母自溶得率[5]。
通过研究添加不同促溶剂(NaCl、木瓜蛋白酶和β-葡聚糖酶等),探讨其对酵母细胞在发酵液中自溶的影响。
1 材料与方法
1.1 材料与试剂
酵母发酵液(自制);NaCl、木瓜蛋白酶(活力>800U/mg)、β-葡聚糖酶(活力>5 000 U/mg):上海源叶生物科技有限公司。
1.2 仪器与设备
pHS-2C型数字式酸度计:上海SANXIN公司;MS分析天平:美国梅特勒-托利多公司;岛津UV-1201分光光度计:日本岛津公司;Eppendorf 5810R高速冷冻离心机:德国艾本德股份公司;HH-S2数显恒温水浴锅:金南仪器制造有限公司。
1.3 方法
1.3.1 试验工艺
取高密度流加发酵所得酵母发酵液(菌体密度为干质量30g/L),控制条件(NaCl添加量/酶添加量、温度、时间、pH)自溶后,置于85℃水浴保持15min灭酶活,5 000r/min离心10min,测定酵母细胞自溶后胞内物质的得率。
1.3.2 指标测定方法
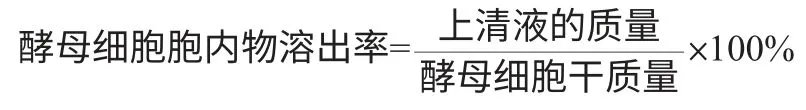
将自溶后的发酵液5 000r/min 离心后,分离上清液和沉淀,将上清液烘干至质量恒定,胞内物溶出率计算公式如下:
2 结果与讨论
2.1 以NaCl为促溶剂的自溶
据报道[6],氯化物、乙醇、乙酸乙酯、硫胺素、脂肪酸钠、甲苯、硫醇类试剂、氮酮、酵母抽提物、右旋糖等都能起到促进酵母自溶的作用。其中NaCl作为安全经济的促溶剂,经常被用在酵母自溶中。NaCl可以通过提高酵母细胞外环境中的渗透压,促进酵母细胞内的原生质体为达到与环境中渗透压平衡而失水,形成了质壁分离,导致细胞内容物外溢。质壁分离达到一定时间后会引起细胞死亡,酵母细胞由此开始降解。NaCl可以加速酵母自溶,缩短生产时间,同时对核糖核酸(ribose nucleic acid,RNA)的降解也有促进作用,可以增大底物对核糖体核糖核酸(ribo somal RNA)裂解酶的敏感程度,且核糖体吸附核糖核酸酶的能力会因NaCl浓度的提高而下降,从而使核糖核酸酶活性增强[7]。
2.1.1 NaCl添加量对酵母自溶的影响
添加NaCl能使酵母细胞内外产生渗透压差,有利于胞内物质的外溢,并且具有一定程度的防腐作用。
取发酵液30mL,将pH调节为5.0,添加不同含量的NaCl,在55℃自溶24h,测定酵母细胞胞内物的溶出率。酶添加量分别为酵母细胞干质量的0%、3%、6%、9%、12%。
由图1可知,NaCl添加量为0%~12%时,酵母细胞胞内物的溶出率有先升高后降低的趋势,在NaCl添加量为9%时达到最大值。随后稍有降低,可能由于NaCl添加量较高时,影响酵母细胞内源酶的活性。因此,酵母细胞在发酵液中的自溶,NaCl为最适宜添加量为9%。

图1 NaCl添加量对酵母自溶的影响Fig.1 Effect of NaCl addition on yeast autolysis
2.1.2 pH对酵母自溶的影响
酵母自溶是一个在多种内源酶共同参与并协同作用的酶促反应过程,各种酶(蛋白酶、核酸酶、β-葡聚糖酶等)的最适pH值各不相同。蛋白酶作为酵母自溶中最重要的内源酶,其适宜的pH值分别为7.5、6.5、6.2 和3.5[8];核酸酶的最适pH值为5~7[9],β-葡聚糖酶的最适pH值为4.5~4.8。据报道,酵母自溶时的最适pH值为5~8,当pH>8时自溶液易产生不良气味甚至变质。
取发酵液30mL,添加9%NaCl,调节pH分别为3、4、5、6、7,在55℃自溶24h,测定酵母细胞胞内物的溶出率,结果如图2所示。
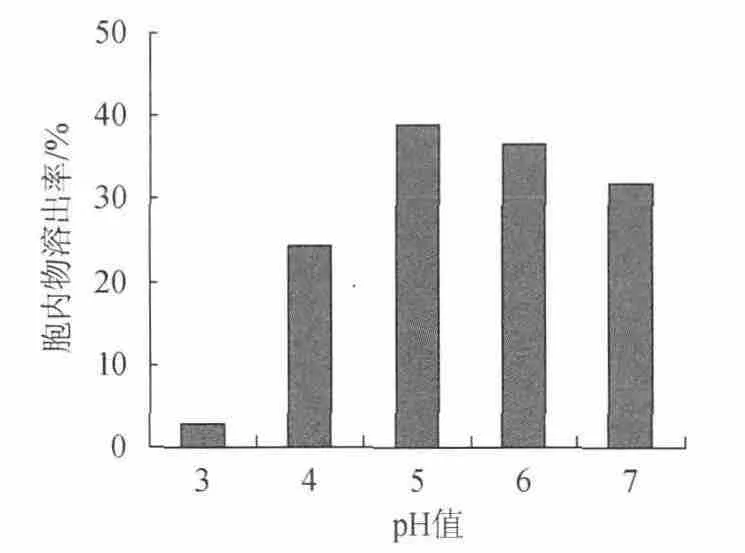
图2 pH对以NaCl为促溶剂的酵母自溶的影响Fig.2 Effect of pH on yeast autolysis based on NaCl as cosolvent
由图2可知,pH对酵母细胞的自溶具有显著影响。当pH值为3~5时,随着pH值的逐渐增大,酵母细胞胞内物溶出率明显上升,当pH值为5时达到最大。这是因为当pH值为5时,达到了酵母体内自溶酶系的最适pH值,自溶酶可以充分水解底物;随着pH的降低,内源酶系对底物的水解的作用受到抑制,影响自溶效果,过低的pH会使酶的三维结构改变进而致其失活,pH值为3时,胞内物的溶出率低于其他各组;当pH值>5时,随着pH值的增加自溶效果下降。因此,酵母在发酵液中自溶的pH选择5为最适宜。
2.1.3 温度对酵母自溶的影响
自溶内源酶的活性受到环境温度的影响,而酵母细胞内源酶系中的每种酶都需要不同的最适温度。如酵母核酸酶的最适宜温度为55℃,蛋白酶的最适温度范围在30~60℃[10]。
取发酵液30mL,添加9%NaCl,调节pH值为5,分别在45℃、50℃、55℃、60℃、65℃自溶24 h,测定酵母细胞胞内物的溶出率,结果如图3所示。
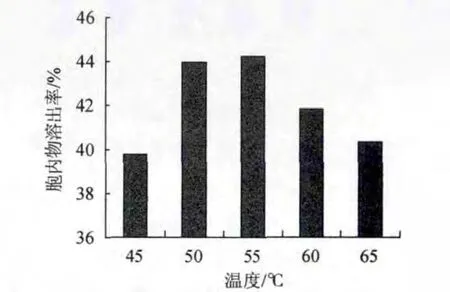
图3 温度对以NaCl为促溶剂的酵母自溶的影响Fig.3 Effect of temperature on yeast autolysis based on NaCl as cosolvent
由图3可知,当温度为55℃时,酵母细胞内容物溶出率最高,酵母细胞内源酶系统可以发挥最大的活性。因此,酵母在发酵液中的自溶的温度选择55℃为最适宜。
2.1.4 时间对酵母自溶的影响
在50℃、pH 5.0、NaCl添加量为9%条件下自溶,测其酵母细胞胞内物的溶出率,结果如图4所示。酵母细胞死亡需要一定的时间,只有细胞死亡后,胞内的各类水解酶系才能被活化发挥作用。由图4可知,在本试验所选的时间内自溶过程中酵母细胞内容物是不断溢出的,16h内增加迅速,而16h后一直缓慢增加,与宁正祥[11]的研究酵母细胞的自溶可以在5d内持续进行一致。由于酵母细胞自溶自溶时间过长会导致染菌而时间过短不能有效的获取酵母细胞内容物,因此选择48h为宜。

图4 时间对以NaCl为促溶剂的酵母自溶的影响Fig.4 Effect of time on yeast autolysis based on NaCl as cosolvent
2.1.5 以NaCl为促溶剂的酵母自溶条件优化正交试验
为得到影响酵母细胞内容物得率的主次因素,获得以NaCl为促溶剂的酵母自溶最佳工艺条件,在单因素试验基础上,进一步采用L9(34)正交试验设计,试验设计及结果见表1。
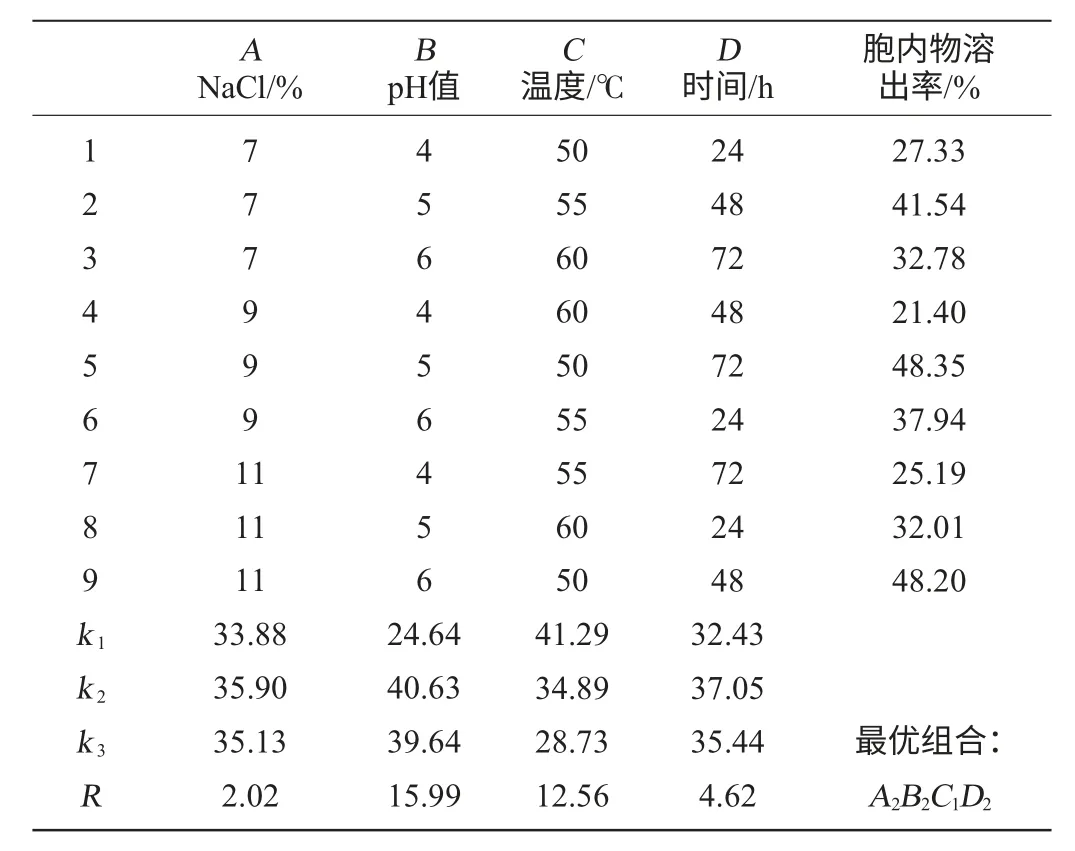
表1 以NaCl为促溶剂的自溶条件优化正交试验结果与分析Table 1 Results and analysis of orthogonal test for autolysis condition optimization using NaCl as cosolvent
由表1可知,4个因素对自溶影响的大小顺序为pH值>温度>时间>NaCl添加量。由正交试验得出以NaCl为促溶剂的酵母发酵液内的自溶条件为A2B2C1D2,即pH5,温度50℃、时间48h、NaCl添加量为9%。在此优化条件下进行验证试验测得酵母细胞在发酵液内自溶,酵母细胞胞内物溶出率达到49.30%。
2.2 以葡聚糖酶为促溶剂的自溶条件优化正交试验
由酵母细胞自溶原理可以得知,影响酵母自溶的主要因素是其细胞壁的结构[12]。细胞壁一般占酵母干质量的25%左右,并且由三层组成类似三明治的结构,由内层向外分别为β-葡聚糖、蛋白质和甘露寡糖。β-葡聚糖是维持酵母细胞壁刚性的主要功能性成分,其中大部分为β-1,3-葡聚糖。β-葡聚糖酶的主要作用是水解细胞壁的β-葡聚糖,使其多聚糖链断裂,扩大细胞壁上的孔隙[13]。由此促进细胞内容物外溢,从而提高了酵母自溶时酵母细胞内容物的得率。
2.2.1 酶的添加量对酵母自溶的影响
取发酵液30mL,将pH调节为5.0,添加不同含量的β-葡聚糖酶,在55℃下自溶24h,测定酵母细胞胞内物的溶出率。酶添加量分别为酵母细胞干质量的0%、0.3%、0.6%、0.9%、1.2%,结果如图5所示。
由图5可知,随着酶添加量的增加,酵母细胞胞内物溶出率逐渐增高,添加量在0~0.6%范围内,酵母细胞胞内物溶出率显著增加,而0.6%~1.2%范围内胞内物溶出率无显著差异。因此,从经济上考虑,β-葡聚糖酶的添加量为0.6%。
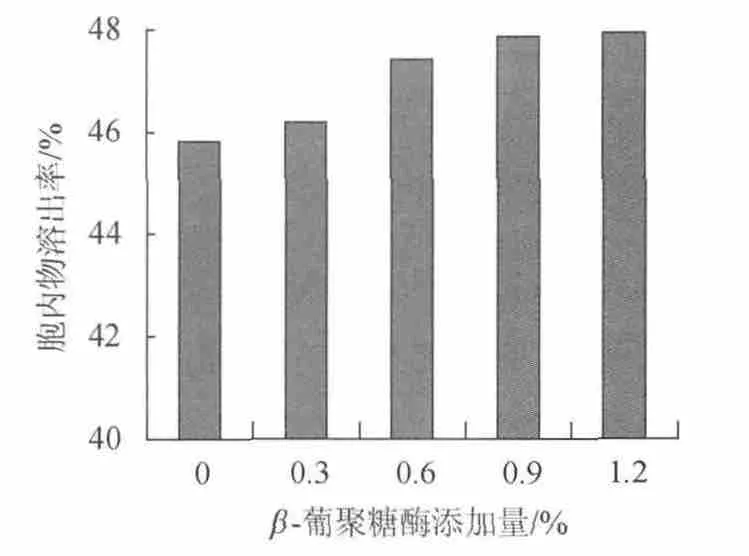
图5 葡聚糖酶添加量对酵母自溶的影响Fig.5 Effect of β-glucanas addition on yeast autolysis
2.2.2 温度对酵母自溶的影响
取发酵液30mL,将pH调节为5.0,添加0.6%的β-葡聚糖酶,在不同温度条件下自溶24h,测定酵母细胞胞内物的溶出率。温度分别为45℃、50℃、55℃、60℃和65℃,结果如图6所示。

图6 温度对以β-葡聚糖酶为促溶剂的酵母自溶的影响Fig.6 Effect of temperature on yeast autolysis based on β-glucanas as cosolvent
由图6可知,温度为50~55℃时,酵母细胞胞内物溶出率显著高于其他温度,其中50℃时最高。因此,以β-葡聚糖酶在此自溶体系中的最适温度为50℃,此结果与以NaCl为促溶剂的结果一致,说明在此温度下,外加β-葡聚糖酶与酵母细胞内源酶系在此发酵液中可以共同保持反应活性。
2.2.3 pH对酵母自溶的影响
取发酵液30mL,添加0.6%的β-葡聚糖酶,分别调节pH值为4.5、5.0、5.5、6.0、6.5,在,50℃温度条件下自溶24h,测定酵母细胞胞内物的溶出率,结果见图7所示。
由图7可知,β-葡聚糖酶的最适pH为6.0~6.5[14],从以NaCl为促溶剂的酵母细胞自溶结果可以得到酵母细胞内源酶进行自溶的最适宜pH值为5,结果在pH值为5和6分别有一个峰值,由在NaCl为促溶剂的酵母细胞自溶结果可知,pH为5.0 的时候酵母细胞内源酶起主要作用;所以pH为6.0时,外加酶起主要作用。因此,以β-葡聚糖酶为促溶剂的酵母细胞自溶最适宜pH为6。
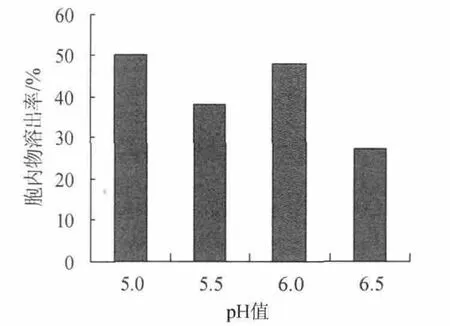
图7 pH对以β-葡聚糖酶为促溶剂的酵母自溶的影响Fig.7 Effect of pH on yeast autolysis based on β-glucanas as cosolvent
2.2.4 时间对酵母自溶的影响
在50℃、pH 6.0、β-葡聚糖酶添加量为1%条件下自溶,测其酵母细胞内容物随时间推移的溢出量变化曲线见图8。

图8 时间对以β-葡聚糖酶为促溶剂的酵母自溶的影响Fig.8 Effect of time on yeast autolysis based on β-glucanas as cosolvent
由图8可知,随着时间的延长,酵母细胞内容物的溶出率不断增加,作用16h时还在显著增加。作用时间超过24h后则缓慢增加。
为使酵母细胞内容物有效的溶出,且不会由于作用时间过长而导致染菌,选取48h为最佳自溶时间。
2.2.5 以β-葡聚糖为促溶剂的酵母自溶条件优化正交试验
在单因素试验的基础上,采用正交试验对以β-葡聚糖酶为促溶剂的酵母自溶方案进行综合优化。选取β-葡聚糖酶添加量、pH值、温度、时间进行4因素3水平正交试验。试验设计和结果分析见表2。
由表2可知,4因素对自溶影响的大小顺序为添加量>时间>温度>pH值。由正交试验得出以β-葡聚糖酶为促溶剂的酵母发酵液内的自溶条件为:pH 6.5,温度55℃、时间24h、酶添加量为0.6%。在此优化条件下进行验证试验测得酵母细胞在发酵液内自溶,酵母细胞胞内物溶出率达到49.98%。
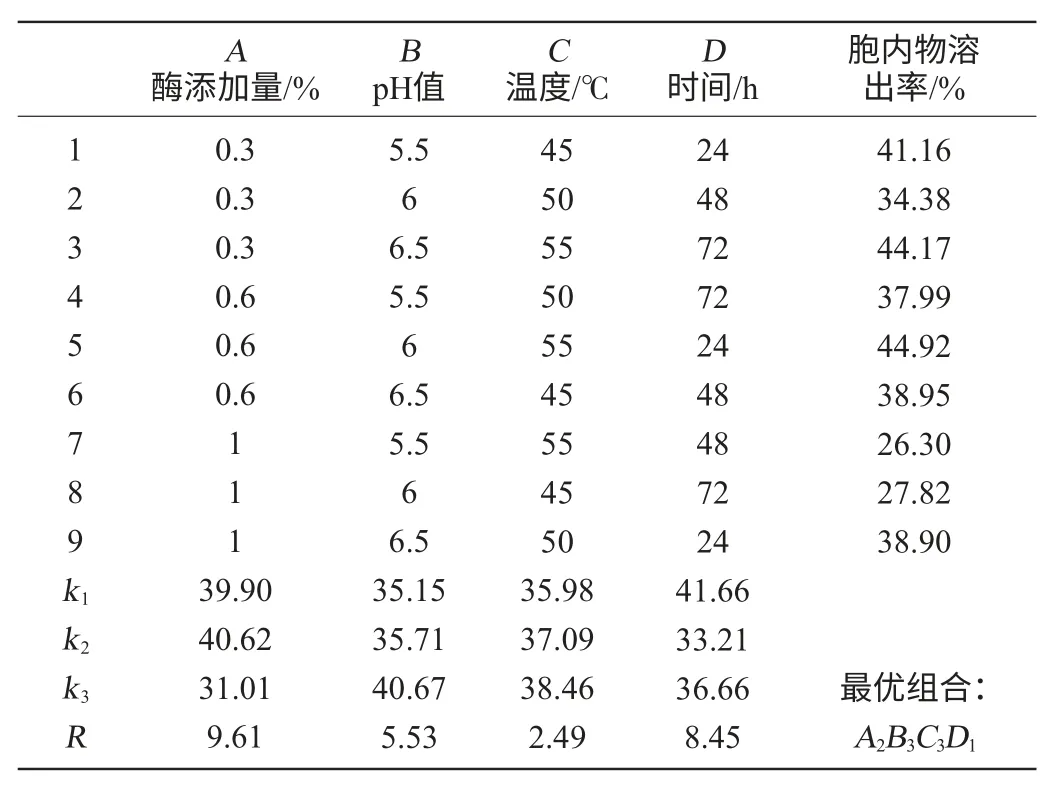
表2 以β-葡聚糖酶为促溶剂的自溶条件优化正交试验结果与分析为促溶剂的自溶正交表Table 2 Results and analysis of orthogonal test for autolysis condition optimization using β-glucanas as cosolvent
2.3 以木瓜蛋白酶为促溶剂的自溶
外加蛋白酶可以降解酵母细胞壁和细胞膜表面的蛋白、增大细胞壁孔隙,并且将细胞内的大分子蛋白水解为可以通过细胞壁孔隙的小肽和氨基酸,溶进自溶液中。据报道,最有效的促进酵母水解的酶类是巯基蛋白酶,主要有木瓜蛋白酶、无花果蛋白酶、菠萝蛋白酶等,木瓜蛋白酶效果最显著[15]。
木瓜蛋白酶(papain)简称木瓜酶,又称为木瓜酵素。是利用未成熟的番木瓜(carica papaya)果实中的乳汁,采用现代生物工程技术提炼而成的纯天然生物酶制品,其是一种含疏基(-SH)肽链内切酶,具有蛋白酶和酯酶的活性,有较广泛的特异性,对动植物蛋白、多肽、酯、酰胺等有较强的水解能力。
魏丕芳等[16]研究结果显示,啤酒废酵母正常自溶对细胞壁甘露聚糖有一定的水解作用,加盐可减缓甘露糖的游离,外加木瓜蛋白酶可强烈的破坏甘露聚糖。
2.3.1 木瓜蛋白酶的添加量对胞内物溶出率的影响
取发酵液30mL,将pH调节为5.0,添加不同含量的木瓜蛋白酶,在55℃下自溶24h,测定酵母细胞胞内物的溶出率,结果见图9。酶添加量分别为酵母细胞干质量的0%、0.5%、1%、2%。
由图9可知,添加木瓜蛋白酶的试验组结果均高于不添加酶的对照组。酶的添加量为0.5%时,酵母细胞胞内物溶出率达到最大值,增加酶的添加量并不能进一步提高溶出率。因此,酵母细胞在发酵液中自溶时所需木瓜蛋白酶的最适添加剂量为酵母细胞干质量的0.5%。
2.3.2 温度对胞内物溶出率的影响
取发酵液30mL,将pH调节为5.0,添加0.5%的木瓜蛋白酶,在不同温度条件下自溶24h,测定酵母细胞胞内物的溶出率。温度分别为45℃、50℃、55℃、60℃和65℃,结果如图10所示。

图9 木瓜蛋白酶添加量对酵母自溶的影响Fig.9 Effect of papain addition on yeast autolysis
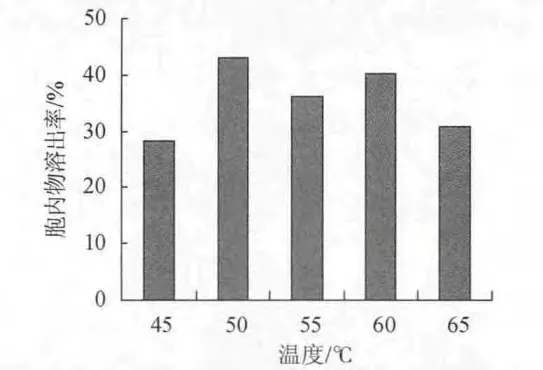
图10 温度对以木瓜蛋白酶为促溶剂的酵母自溶的影响Fig.10 Effect of temperature on yeast autolysis based on papain as cosolvent
由图10可知,在45~65℃范围内,随着温度的升高,酵母细胞胞内物溶出率出现两个峰值,分别在50℃、60℃,这是因为以木瓜蛋白酶为促溶剂的酵母细胞自溶是一个酵母内生酶和外加酶联合作用的反应过程,木瓜蛋白酶的适宜作用温度为60~65℃,而酵母细胞内源酶系的最佳反应温度为50℃。
2.3.3 pH值对胞内物溶出率的影响
取发酵液30mL,添加0.5%的木瓜蛋白酶,分别调节pH值为4.5、5.0、5.5、6.0、6.5,在50℃温度条件下自溶24h,测定酵母细胞胞内物的溶出率,结果如图11所示。
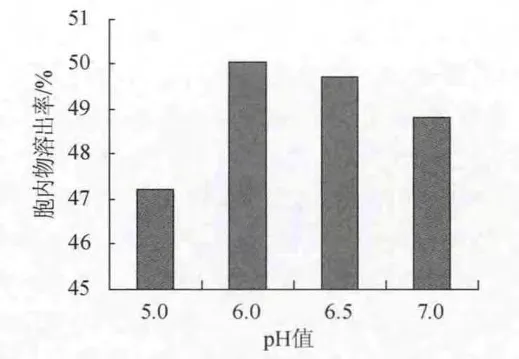
图11 pH对以木瓜蛋白酶为促溶剂的酵母自溶的影响Fig.11 Effect of pH on yeast autolysis based on papain as cosolvent
由图11可知,木瓜蛋白酶的最适pH为6.0~6.5,结果在pH为6.0时达到最大值。因此,以木瓜蛋白酶为促溶剂的酵母细胞自溶最适宜pH为6.0。
2.3.4 时间对酵母自溶的影响
在50℃、pH 6.0、木瓜蛋白酶添加量为1%条件下自溶,测其酵母细胞内容物随时间推移的溢出量变化曲线,以确定其自溶时间,结果见图12。由图12可知,72h内随着自溶时间的延长,酵母细胞胞内物溶出率不断增加。为使酵母细胞内容物有效的溶出,且不会由于作用时间过长而导致染菌,选取48h为最佳自溶时间。

图12 时间对以木瓜蛋白酶为促溶剂的酵母自溶的影响Fig.12 Effect of time on yeast autolysis based on papain as cosolvent
2.3.5 以木瓜蛋白酶为促溶剂的酵母自溶条件优化正交试验
在单因素试验的基础上,采用正交试验对以木瓜蛋白酶为促溶剂的酵母自溶方案进行优化。选取木瓜蛋白酶添加量、pH值、温度、时间进行4因素3水平正交试验,试验设计和结果分析见表3。

表3 以木瓜蛋白酶为促溶剂的自溶条件优化正交试验结果与分析Table 3 Results and analysis of orthogonal test for autolysis condition optimization using papain as cosolvent
由表3可知,4因素对自溶影响的大小顺序为温度>pH值>添加量>时间。由正交试验得出以木瓜蛋白酶为促溶剂的酵母发酵液内的自溶条件为pH 6,温度60℃、时间72 h、酶添加量为1%。在此优化条件下进行验证试验测得酵母细胞在发酵液内自溶,胞内物溶出率达到51.53%。
比较3种不同促溶剂下酵母细胞在发酵液中自溶所得酵母细胞胞内物的溶出率,结果表明木瓜蛋白酶作为促溶剂时酵母细胞内容物的得率最高,比NaCl为促溶剂时提高2%左右,即外加酶促进酵母细胞自溶的效果较小。由于应用高密度发酵所得酵母菌直接自溶,与啤酒废酵母泥相比本试验中的酵母菌具有较高活性,细胞壁厚且坚固,自溶率难以提高,试验结果与陶兴无[5]所得面包酵母酶促自溶结果一致。
3 结论
综合以上结果可以如下结论:木瓜蛋白酶和β-葡聚糖酶均可以促进酵母细胞自溶,酵母细胞内容物溶出率提高2%左右。
[1]饶应昌,谭鹤群.我国饲料资源的缺口原因及其对策的探讨[J].饲料工业,2000(3):5-6.
[2]谢幼梅.饲用酵母的质量鉴别[J].农业知识,2000(16):42.
[3]赵芳芳,张日俊.酵母细胞壁生理功能及其应用[J].中国饲料,2003,(17):17-19.
[4]李 祥,彭 莉,王 毅,等.酵母自溶研究[J].中国酿造,2001,20(5):17-19.
[5]陶兴无.外加酶提高酵母自溶抽提物得率的研究[J].中国酿造,2004,23(12):13-16.
[6]江 凌,田小群,朱明军,等.自溶-酶联技术制备啤酒废酵母抽提物工艺及产物理化参数研究[J].现代食品科技,2008,124(5):444-447.
[7]李 杨,包清彬,孔 凌,等.酵母抽提物自溶工艺优化[J].食品工业,2011(5):62-65.
[8]王治权,陈远何,尚水英.啤酒酵母实用技术[M].上海:上海科学普及出版社,1990.
[9]陈 洁,王 璋.酵母抽提物中呈味核苷酸含量偏低的原因探讨(1)啤酒酵母中核酸酶性质研究[J].食品科学,2005,25(1):108-111.
[10]杨建梅,李 红,杜金华.啤酒废酵母自溶条件的研究[J].中国酿造,2012,31(2):95-99.
[11]宁正祥.酵母细胞自溶动力学研究[J].微生物学报,1994,34(3):213-219.
[12]邹东恢,江 洁.β-葡聚糖酶的开发与应用研究[J].农产品加工,2005(8):7-9.
[13]MADDOX IS,HOUGH JS.Proteolytic enzymes ofSaccharomyces carlsbergensis[J].Biochem J,1970,117(5):843-852.
[14]宫春波,谢丽源.β-葡聚糖酶及在啤酒工业中的应用[J].广州食品工业科技,2002,18(1):58-59.
[15]MILIC T V,RAKIN M,MARINKOVIC S S.Utilization of baker's yeast(Saccharomyces cerevisiae) for the production of yeast extract:effects of different enzymatic treatments on solid,protein and carbohydrate recovery[J].J Serb Chem Soc,2007,72(5):451-457.
[16]魏丕芳.不同自溶方式对啤酒废酵母甘露聚糖的降解作用[J].食品研究与开发,2008(9):75-77.

