猪苓菌核自噬相关基因ATG8的克隆及表达分析
刘蒙蒙,邢咏梅,郭顺星
猪苓菌核自噬相关基因ATG8的克隆及表达分析
刘蒙蒙,邢咏梅,郭顺星
目的 克隆分离猪苓自噬相关基因 ATG8,并探讨其在猪苓防御蜜环菌入侵过程中的作用。
方法 以猪苓菌核为材料,采用 RT-PCR 方法得到自噬相关基因的开放读码框全长,并利用荧光定量 PCR 检测该基因在不同猪苓菌核部位的表达量。
结果 该基因开放读码框为 387 bp,编码 128 个氨基酸;该蛋白分子量为 14.838 kD,理论等电点为 5.85。氨基酸序列多重比对及系统发育树结果显示 PuATG8 与蚁巢伞属(termitomyces sp.)亲缘关系最近,与皱革菌(Punctularia strigosozonata)、密褐褶孔菌(Gloeophyllum trabeum)、立枯丝核菌(Rhizoctonia solani)有较高的同源性。PuATG8 为ATG 家族同源基因。荧光定量 PCR 结果表明,PuATG8 在未被蜜环菌侵染的猪苓菌核及被蜜环菌侵染的菌核中都有表达,其中被侵染部分的表达量显著上调。
结论 PuATG8 可能参与了猪苓菌核的防御反应。
猪苓; 自噬; 基因表达; 克隆
www.cmbp.net.cn 中国医药生物技术, 2016, 11(5):415-419
细胞自噬是广泛存在于真核生物细胞内的一种正常的分解代谢过程,是细胞在缺乏营养或胁迫条件下,通过降解细胞内衰老的蛋白质、受损伤的细胞结构和细胞器,为细胞的重建、再生和修复提供必需原料,实现细胞内物质的再利用,是生物体中一种重要的防御和保护机制[1-2]。自噬在生物的许多生理过程中扮演着重要的角色,比如生物体对外界胁迫的适应:如氧化应激胁迫[3]、盐[4]、干旱[5]和微生物侵染[6-7]等;参与生物体生长发育和分化过程中的细胞重建[8]。所以细胞自噬在真核细胞中是一个无处不在的正常的代谢过程[9],作为一个细胞质量控制开关来消除衰老的细胞器和结构以维持内稳态[10-11]。但迄今为止,关于自噬过程的研究仍主要集中在酵母和哺乳动物中,在微生物中,尤其是大型真菌中的研究还特别少。
自噬相关(ATG)蛋白参与许多细胞自噬过程的核心阶段[12]。目前,已经在酵母中发现了 31 种ATG 蛋白,其中 18 种蛋白(ATG1-10、ATG12-14、ATG16-18、ATG29、ATG31 等)已经被证明参与了自噬体的形成[13]。在自噬体形成的过程中,大部分自噬蛋白都以其独特的作用方式行使着不同的功能。
猪苓菌核与蜜环菌是一种特殊的共生关系。在自然条件下只有当蜜环菌侵入猪苓菌核时猪苓菌核才能生长发育。在形成共生关系的过程中,蜜环菌会侵入猪苓菌核。猪苓人工栽培实践已经证明,栽培猪苓菌核不加带有生长蜜环菌菌索的菌棒,猪苓就不能生长繁殖。在实践生产中利用蜜环菌菌材伴栽猪苓技术,尤其是在栽培穴中增放大量树叶后,对提高猪苓产量起到了极好的效果。本课题组先前的形态学研究发现,在蜜环菌侵染猪苓菌核的部位,部分猪苓菌核细胞会激发自噬降解过程,但是其分子机制尚属空白。
本课题组在前期构建猪苓 RNA-seq 文库中发现一个特异表达的 unigene 序列,它与自噬相关蛋白基因 ATG8 具有高度同源性,推测该序列在蜜环菌侵染猪苓菌核部位高表达,可能与猪苓的防御性相关。本研究以猪苓为材料,以 unigene 序列为基础设计基因特异性引物,利用 RT-PCR 方法克隆了unigene 的开放读码框的全长,对其全长序列、结构和功能进行初步分析,并对其在蜜环菌侵染猪苓菌核后的表达进行了分析,以期为进一步揭示该基因的功能以及探讨猪苓防御反应的分子机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试猪苓菌核 2014 年 8 月采自山西古县猪苓厂。
1.1.2 主要试剂和仪器 M-MLV Reverse Transcriptase Kit 购于美国 Promega 公司;Phanta Max Super-Fidelity DNA Polymerase Mix 购于南京诺唯赞生物科技有限公司;RNeasy 植物 RNA 快速提取试剂盒购于 Qiagen 公司;胶回收试剂盒、SYBR®Premix Ex TaqTM试剂盒、Zero Background pTOPO-Blunt Simple Cloning Kit 和大肠杆菌(Escherichia coli)JM109 感受态细胞均购于北京艾德莱生物科技有限公司;NanoDropTM2000 分光光度计购于美国 Thermo Fisher 公司。
1.2 方法
1.2.1 总 RNA 提取及检测 应用 RNeasy 植物RNA 快速提取试剂盒并按照操作说明提取各样品RNA,使用 NanoDropTM2000 分光光度计测定各总 RNA 质量和纯度,使用 1.2% 的琼脂糖凝胶电泳检测 RNA 的完整性。应用 M-MLV Reverse Transcriptase Kit 反转录合成 cDNA 第一链并存放于 -20 ℃ 备用。
1.2.2 基因克隆 在本课题组已测得的猪苓转录组数据库中搜索到一个自噬相关基因 ATG8 的全长 cDNA 序列,利用 Primer3 软件(http:// bioinfo.ut.ee/primer3-0.4.0/)分别从起始密码子与终止密码子开始设计一对引物,即 ATG8p1:ATGG TCAGGTCCAAGTTCAAAGACG,ATG8p2:TCA TGCATCGGATGGTAACTCTAGC。以猪苓 cDNA为模板进行 RT-PCR,总反应体积为 25 μl,包括:10 mmol/L dNTPs 0.5 μl,1 μl cDNA,12.5 μl Phanta Max Buffer,0.5 μl Phanta Max Super-Fidelity DNA Polymerase,ATG8p1 及 ATG8p2 各 1 μl(10 mmol/L)和 8.5 μl ddH2O。扩增反应条件为:94 ℃ 4 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,40 个循环;72 ℃ 延伸 10 min。
1.2.3 ATG8 基因的生物信息学分析 利用 ORF Finder 程序(http://www.ncbi.nih.gov/gorf/gorf.htmL)进行开放阅读框架预测,Blast 程序(http://www. ncbi.nlm.nih.gov/blast/)进行序列同源性的比较,ExPASy 的 ProtParam 工具(http://www.expasy.org/ tools/protparam.html)进行蛋白质理化性质(等电点、分子量)分析,MEGA 6.0 软件进行氨基酸序列同源性分析及系统发育分析,构建 Neighbor-Joining进化树,1000 次重复,其他均为默认设置。
1.2.4 实时荧光定量 PCR 分析 利用实时荧光定量 PCR 技术分析 ATG8 的表达,用猪苓β-tublin 基因作为内参。分别取被蜜环菌侵染的菌核(CT)以及未被蜜环菌侵染的菌核(CK)提取RNA 后用 M-MLV Reverse Transcriptase Kit 反转录获得 cDNA,用 Roche LightCycler®480II 对目的基因的表达水平进行检测。根据 ATG8 基因全长设计荧光定量引物 Q-ATG F(5' AGACGAGCA TCCCTTTGAGA 3')和 Q-ATG R(5' TTGGCCA ACAGTGAGATCAG 3'),并以猪苓 β-tublin 为内参基因,引物为 tub-F(5' CCTTCCTTGGCAACTC GACA 3')和 tub-R(5' TCGTCCATACCCTCC TGTGT 3')。使用 SYBR®Premix Ex TaqTM试剂盒进行 qPCR 反应,其体系为 15 μl,其中包括 7.5 μl 2 × SYBR®Premix ExTaqTMMaster Mix,0.5 μl 引物(10 μmol/L),2 μl cDNA 模板以及 4.5 μl ddH2O。反应程序设定如下:预变性 95 ℃ 30 s;95 ℃ 5 s,60 ℃ 32 s,40 个循环,同时绘制熔解曲线。所有 PCR 反应都设 3 次重复。
2 结果
2.1 PuATG8 基因全长的克隆
以未被蜜环菌侵染的猪苓菌核的 RNA 所反转录的 cDNA 为模板,利用引物 ATG8p1 和ATG8p2 通过 RT-PCR 方法得到一个长度约为400 bp 的片段(图 1),得到的产物片段经回收、克隆、测序获 387 bp 的完整 ORF 序列,与转录组文库中的 unigene 序列的 ORF 区一致,进而验证已成功获得 PuATG8 基因的全长 ORF。BLAST分析表明其为 ATG8 的同源基因,因此将其命名为PuATG8。
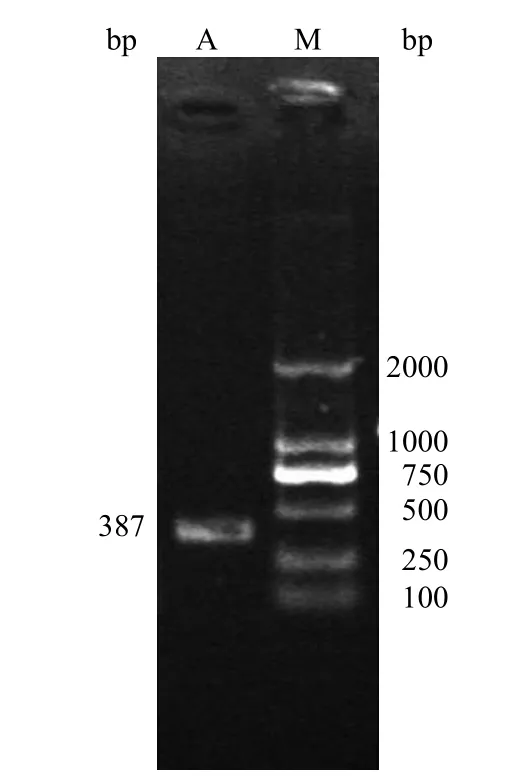
图1 基因扩增结果(A:PuATG8;M:DL2000)Figure 1 PCR product of PuATG8 (A: PuATG8; M: DL2000)
2.2 PuATG8 蛋白结构及序列分析
PuATG8 编码 128 个氨基酸,推导 PuATG8蛋白分子量为 14.838 kD,理论等电点 5.85。将推测的氨基酸序列提交到 NCBI 的保守域数据库(Conserved Domain Database,CDD)进行搜索,结果显示该蛋白序列具有 ATG8 蛋白的完整保守结构域和功能位点(图 2)。
将推测的氨基酸序列在 NCBI 上进行 Blastp比对分析后发现,PuATG8 与皱革菌(Punctularia strigosozonata)、密褐褶孔菌(Gloeophyllum trabeum)、立枯丝核菌(Rhizoctonia solani)和毛韧革菌(Stereum hirsutum)的 ATG8 相似度较高,分别为 98%、97%、97% 和 96%,部分结果见图 3。
选取 10 个与 PuATG8 蛋白同源性较高的其他真菌的 ATG8 蛋白,分析其系统进化关系,用MEGA 6.0 通过 Neighbor joining(NJ)法构建了系统发育树。结果显示,PuATG8 与蚁巢伞属(termitomyces sp.)遗传距离最近,其次是Moniliophthora roreri 和毛韧革菌(Stereum hirsutum)(图 4)。
2.3 PuATG8 在猪苓菌核中的表达
通过实时定量 PCR 检测猪苓菌核不同部位的PuATG8 基因的转录达水平,10 倍梯度稀释测得PuATG8 基因引物和内参基因 β-tublin 引物扩增效率分别为 95.26% 和 94.43%,两对引物熔解曲线都只有对应的单峰,没有出现二聚体杂峰,符合实时荧光定量 PCR 要求。定量 PCR 结果表明该基因在被蜜环菌侵染的猪苓菌核中的表达量要高于未被蜜环菌侵染的猪苓菌核,是其的 7.85 倍(图 5)。表明 PuATG8 基因可能参与猪苓菌核对蜜环菌胁迫的应答过程。

图2 ATG8 蛋白的保守结构域Figure 2 Conserved protein domains of ATG8 protein
图3 PuATG8 氨基酸序列比对分析Figure 3 Alignment and analysis of amino acid sequences of PuATG8

图4 系统进化树分析Figure 4 Phylogenetic tree analysis
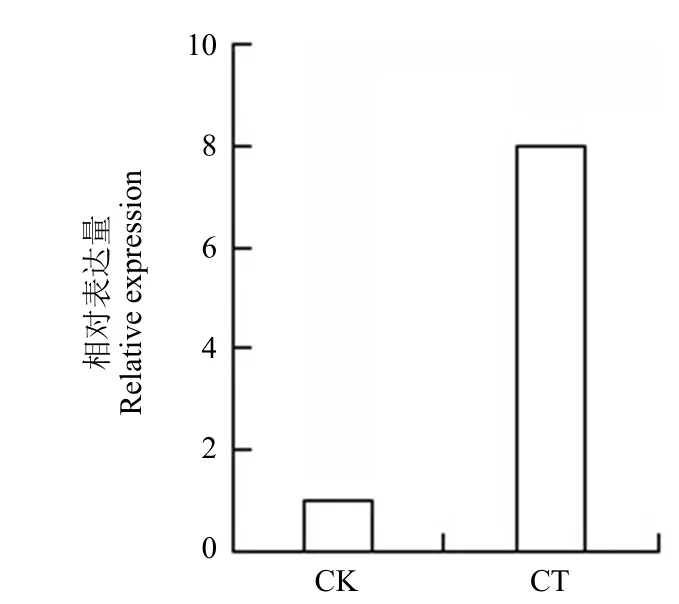
图5 猪苓 PuATG8 蛋白基因的组织特异性表达分析(CK:未被侵染的猪苓菌核;CT:被蜜环菌侵染的猪苓菌核)Figure 5 qRT-PCR analysis of the PuATG8 expression (CK:Controlled medullar tissue; CT: Treated medullar tissue)
3 讨论
本研究从猪苓中克隆得到了一个自噬相关基因 PuATG8 的全长 ORF。氨基酸序列多重比对及系统发育树结果显示 PuATG8 与蚁巢伞属(termitomyces sp.)亲缘关系最近,与皱革菌(Punctularia strigosozonata)、密褐褶孔菌(Gloeophyllum trabeum)、立枯丝核菌(Rhizoctonia solani)有较高的同源性。且具有保守的组氨酸结构域,这些结果表明,PuATG8 为 ATG8 家族的同源基因,可能与其他 ATG8 具有相似的结构和功能。
ATG8 是自噬体的标记蛋白[14]。ATG8 基因家族编码类泛素蛋白,它们在自噬体的形成过程中起着重要的作用[15-16]。现有研究证明,拟南芥无论在正常营养条件下还是在营养缺乏条件下,都会表达ATG8 基因,并且其在根中的表达量高于茎和叶中的表达量,基因主要分布在成熟区及接触土壤吸取营养的根冠部位表达,说明自噬相关基因与植物在逆境环境下的生存有关系[17]。Yoshimoto 等[18]通过荧光定量 PCR 发现拟南芥在缺氮的条件下,ATG8a-ATG8f 基因会上调表达。另外,在其他逆境胁迫下,也观察到植物中 ATG8 基因的上调表达。如被灰霉病菌侵染拟南芥,通过 RNA gel-blot 分析检测到 ATG8a 表达上调[19];将玉米放置黑暗条件,进行缺氮处理,通过 RT-PCR 与 Western blot 检测,均观察到了 ATG8 的上调表达[20]。以上实验,从 RNA 水平和蛋白质水平证明了自噬基因参与了植物的抗逆生理过程。
ATG8 基因在响应生物胁迫中均表现出了一定的功能,自噬体可能具有双重功能:抗细胞死亡或促细胞死亡,而自噬体发挥何种功能依赖于自身的水平。本试验中荧光定量结果表明 PuATG8 基因在受到蜜环菌侵染后,猪苓菌核可能通过增加PuATG8 表达量来参与逆境胁迫应答过程。PuATG8基因在猪苓菌核抵抗逆境中的具体作用有待进行深入研究。
[1] Glick D, Barth S, Macleod KF. Autophagy: cellular and molecular mechanisms. J Pathol, 2010, 221(1):3-12.
[2] Yorimitsu T, Klionsky DJ. Autophagy: molecular machinery for self-eating. Cell Death Differ, 2005, 12 Suppl 2:1542-1552.
[3] Xiong Y, Contento AL, Nguyen PQ, et al. Degradation of oxidized proteins by autophagy during oxidative stress in Arabidopsis. PlantPhysiol, 2007, 143(1):291-299.
[4] Bassham DC, Laporte M, Marty F, et al. Autophagy in development and stress responses of plants. Autophagy, 2006, 2(1):2-11.
[5] Wang Y, Liu YL. Progress in plant autophagy. Chin J Cell Biol, 2010,32(5):677-698. (in Chinese)王燕, 刘玉乐. 植物细胞自噬研究进展. 中国细胞生物学学报,2010, 32(5):677-698.
[6] Colombo MI. Autophagy: a pathogen driven process. IUBMB Life,2007, 59(4-5):238-242.
[7] Lerena MC, Vázquez CL, Colombo MI. Bacterial pathogens and the autophagic response. Cell Microbiol, 2010, 12(1):10-18.
[8] Di Bartolomeo S, Nazio F, Cecconi F. The role of autophagy during development in higher eukaryotes. Traffic, 2010, 11(10):1280-1289.
[9] Yoshimoto K. Beginning to understand autophagy, an intracellular self-degradation system in plants. Plant Cell Physiol, 2012, 53(8):1355-1365.
[10] Vellai T. Autophagy genes and ageing. Cell Death Differ, 2009, 16(1):94-102.
[11] Mizushima N. Autophagy: process and function. Genes Dev, 2007,21(22):2861-2873.
[12] Shpilka T, Weidberg H, Pietrokovski S, et al. Atg8: an autophagy-related ubiquitin-like protein family. Genome Biol, 2011,12(7):226.
[13] Suzuki K, Kubota Y, Sekito T, et al. Hierarchy of Atg proteins in pre-autophagosomal structure organization. Genes Cells, 2007, 12(2):209-218.
[14] Longatti A, Tooze SA. Vesicular trafficking and autophagosome formation. Cell Death Differ, 2009, 16(7):956-965.
[15] Xie Z, Nair U, Klionsky DJ. Atg8 controls phagophore expansion during autophagosome formation. Mol Biol Cell, 2008, 19(8):3290-3298.
[16] Nakatogawa H, Ichimura Y, Ohsumi Y. Atg8, a ubiquitin-like protein required for autophagosome formation, mediates membrane tethering and hemifusion. Cell, 2007, 130(1):165-178.
[17] Slavikova S, Ufaz S, Avin-Wittenberg T, et al. An autophagy-associated Atg8 protein is involved in the responses of Arabidopsis seedlings to hormonal controls and abiotic stresses. J Exp Bot, 2008, 59(14):4029-4043.
[18] Yoshimoto K, Hanaoka H, Sato S, et al. Processing of ATG8s,ubiquitin-like proteins, and their deconjugation by ATG4s are essential for plant autophagy. The Plant Cell, 2004, 16(11):2967-2983.
[19] Lai Z, Wang F, Zheng Z, et al. A critical role of autophagy in plant resistance to necrotrophic fungal pathogens. Plant J, 2011, 66(6):953-968.
[20] Chung T, Suttangkakul A, Vierstra RD. The ATG autophagic conjugation system in maize: ATG transcripts and abundance of the ATG8-lipid adduct are regulated by development and nutrient availability. Plant Physiol, 2009, 149(1):220-234.
Objective To clone and isolate the autophagy-related protein 8 (ATG8) gene and investigate the function of this gene in the defense of Polyporus umbellatus.
Methods A new ATG8 gene, designated as PuATG8, was isolated from the Polyporus umbellatus sclerotia using RT-PCR. The expression analysis of PuATG8 in different parts of Polyporus umbellatus sclerotia was carried out by quantitative RT-PCR assay.
Results The full-length of open reading frame was 387 bp, encoding a putative protein of 129 amino acids with a molecular weight of 14.838 kD and a theoretical pI of 5.85. Phylogenetic tree analysis indicated that PuATG8 had the highest similarity with ATG8 from termitomyces sp., and was highly homologous to Punctularia strigosozonata, Gloeophyllum trabeum and Rhizoctonia solani. Quantitative RT-PCR showed that PuATG8 was expressed in P. umbellatus sclerotia irrespective of Armillaria infection. Meanwhile, the expression of PuATG8 in the sclerotia with A. mellea infection was significantly up-regulated.
Conclusion This PuATG8 gene may be involved in the defense response of Polyporus umbellatus sclerotia.
Author Affiliations: Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100193, China (LIU Meng-meng, XING Yong-mei, GUO Shun-xing); Institute of Bioinformatics and Medical Engineering, School of Electrical and Information Engineering, Jiangsu University of Technology, Changzhou 213001, China (LIU Meng-meng)
www.cmbp.net.cn Chin Med Biotechnol, 2016, 11(5):415-419
Cloning and expression analysis of a autophagy-related protein 8 encoding gene in Polyporus umbellatus
LIU Meng-meng, XING Yong-mei, GUO Shun-xing
Polyporus umbellatus; Autophagy; Gene expression; Gene cloning
GUO Shun-xing, Email: sxguo1986@163.com
10.3969/j.issn.1673-713X.2016.05.005
国家自然科学基金(30830117、31201666);山西省煤基重点科技攻关项目(FT2014-03);河北山区特色中药材种质资源评价与仿野生栽培技术研究与示范(16232503D)
100193 北京,中国医学科学院北京协和医学院药用植物研究所(刘蒙蒙、邢咏梅、郭顺星);213001 常州,江苏理工学院电气信息工程学院生物信息与医药工程研究所(刘蒙蒙)
郭顺星,Email: sxguo1986@163.com
2016-07-25

